Mediadora fosfolipídida induzida transformação em culturas tridimensionais
Summary
O presente protocolo descreve a criação de culturas 3D ‘no topo’ de uma linha celular epitelial de mama não transformada, MCF10A, que foi modificada para estudar a transformação induzida pelo Fator de Ativação de Plaquetas (PAF). A imuno-fluorescência tem sido usada para avaliar a transformação e é discutida em detalhes.
Abstract
Vários modelos foram desenvolvidos para estudar o câncer, como modelos de roedores e linhas celulares estabelecidas. Insights valiosos sobre carcinogênese foram fornecidos por estudos que utilizam esses modelos. As linhas celulares têm proporcionado uma compreensão da desregulamentação da sinalização molecular associada à tumorigênese mamária, enquanto modelos de roedores são amplamente utilizados para estudar características celulares e moleculares do câncer de mama in vivo. O estabelecimento de culturas 3D de células epiteliais e cancerosas mamárias auxilia na ponte entre modelos in vivo e in vitro , imitando as condições in vivo in vitro. Este modelo pode ser usado para entender a desregulamentação de eventos complexos de sinalização molecular e as características celulares durante a carcinogênese mamária. Aqui, um sistema de cultura 3D é modificado para estudar uma transformação induzida por mediadores fosfolipídides (Fator de Ativação de Plaquetas, PAF). Os imunomoduladores e outras moléculas secretadas desempenham um papel importante na iniciação e progressão do tumor na mama. No presente estudo, culturas acinadoras 3D de células epiteliais mamárias são expostas a características de transformação expostas ao PAF, como perda de polaridade e características celulares alteradas. Este sistema de cultura 3D ajudará a lançar luz sobre perturbações genéticas e/ou epigenéticas induzidas por várias pequenas entidades de moléculas no microambiente tumoral. Além disso, este sistema também fornecerá uma plataforma para a identificação de novos, bem como genes conhecidos que podem estar envolvidos no processo de transformação.
Introduction
Uma miríade de modelos estão disponíveis para estudar a progressão do câncer, sendo cada um deles único e representando um subtipo dessa doença complexa. Cada modelo fornece insights únicos e valiosos sobre a biologia do câncer e melhorou os meios para imitar a condição real da doença. Linhas celulares estabelecidas cultivadas como monocamadas forneceram insights valiosos sobre processos vitais in vitro, como proliferação, invasividade, migração e apoptose1. Embora a cultura celular bidimensional (2D) tenha sido a ferramenta tradicional para investigar a resposta das células mamíferas a várias perturbações ambientais, a extrapolação desses achados para prever respostas em nível tecidual não parece suficientemente convincente. A maior limitação das culturas 2D é que o microambiente criado difere em grande parte do do próprio tecido mamário2. A cultura 2D carece da interação das células com a matriz extracelular, que é vital para o crescimento de qualquer tecido. Além disso, as forças de tração experimentadas pela célula nas culturas de monocamadas dificultam a polaridade dessas células, alterando assim a sinalização celular e o comportamento 3,4,5. Sistemas de cultura tridimensionais (3D) abriram uma nova avenida no campo da pesquisa sobre câncer com sua capacidade de imitar as condições in vivo in vitro. Muitas pistas microambientais cruciais que são perdidas na cultura celular 2D poderiam ser restabelecidas usando culturas 3D de matriz extracelular rica em laminino (lrECM)6.
Vários estudos identificaram a importância do microambiente tumoral na carcinogênese 7,8. Fatores associados à inflamação são uma parte importante do microambiente. O Fator de Ativação de Plaquetas (PAF) é um mediador fosfolipídide secretado por várias células imunes que media múltiplas respostas imunes 9,10. Altos níveis de PAF são secretados por diferentes linhas de células cancerígenas de mama e estão associados à maior proliferação11. Estudos do nosso laboratório mostraram que a presença prolongada de PAF em culturas acinar leva à transformação das células epiteliaismamárias 12. O PAF ativa o receptor PAF (PAFR), ativando o eixo de sinalização PI3K/Akt13. O PAFR também está associado ao EMT, invasão e metástase14.
O presente protocolo demonstra um sistema modelo para estudar a transformação induzida pelo PAF, utilizando culturas 3D de células epiteliais mamárias, como foi descrito anteriormente por Chakravarty et al.12. As células epiteliais mamárias cultivadas na matriz extracelular (culturas 3D) tendem a formar esferoides polarizados presos pelo crescimento. Estes são chamados de acini e se assemelham muito ao acini do tecido mamário, a menor unidade funcional da glândula mamária, in vivo15. Estes esferoides (Figura 1A,B) consistem em uma monocamada de células epiteliais polarizadas estreitamente embaladas em torno de um lúmen oco e anexadas à membrana do porão (Figura 1C). Este processo de morfogênese foi bem descrito na literatura16. Quando semeadas no LrECM, as células passam por divisão e diferenciação para formar um aglomerado de células, que então polarizam a partir do dia 4. Até o dia 8, o acini consiste em um grupo de células polarizadas que estão em contato direto com a matriz extracelular e um aglomerado de células não polarizadas dentro das células externas polarizadas, sem contato com a matriz. Essas células não polidas são conhecidas por serem submetidas à apoptose até o dia 12 da cultura, formando um lúmen oco. Até o dia 16, as estruturas presas pelo crescimento são formadasem 16.
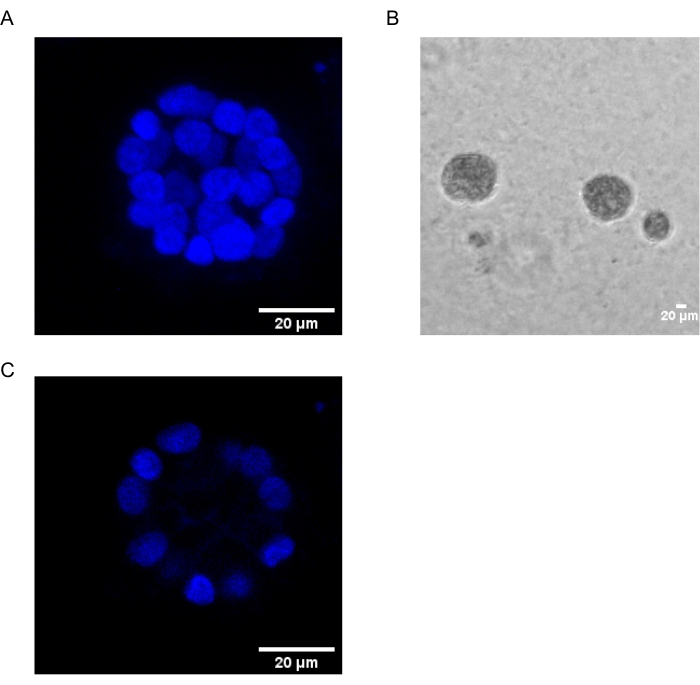
Figura 1: Núcleos de células em acini manchadas com uma mancha nuclear. (A) construção 3D do acini. (B) Imagem de contraste de fase do acini MCF10A cultivada em Matrigel por 20 dias. (C) A seção mais central mostra a presença de um lúmen oco. Barra de escala = 20 μm. Clique aqui para ver uma versão maior desta figura.
Ao contrário das culturas 2D, as culturas acinar ajudam a distinguir células normais e transformadas através de mudanças aparentes de morfologia. Células epiteliais de mama não transformadas formam acini com um lúmen oco, imitando o acini mamário humano normal. Esses esferoides, após a transformação, mostram uma morfologia interrompida caracterizada por uma grande perda de polaridade (uma das marcas do câncer), ausência de lúmen, ou interrupção do lúmen oco (devido à evasão da apoptose) que pode ser induzida devido à desregulamentação de vários genes 17,18,19,20 . Essas transformações podem ser estudadas utilizando técnicas comumente utilizadas, como a imunofluorescência. Assim, o modelo de cultura celular 3D pode funcionar como um método simples para investigar o processo de morfogênese acinar mama e carcinogênese mamária. A criação de um sistema de cultura 3D para entender o efeito de um mediador fosfolipídico, PAF, ajudará na triagem de medicamentos pré-clínicos de alto rendimento.
Este trabalho adaptou o protocolo de cultura 3D ‘no topo’16,21 para estudar a transformação induzida pelo PAF22. As alterações fenotípicas induzidas pela exposição do acini ao mediador fosfolipídico foram estudadas por meio da imunofluorescência. Vários marcadores de polaridade e epitelial para transição mesenquimal (EMT)foram utilizados no estudo. A Tabela 1 menciona sua localização normal e seu fenótipo esperado após a transformação.
| Anticorpos | Marcas | Localização normal | Fenótipo transformado |
| α6-Integrin | Basolateral | Basal com mancha lateral fraca | Mancha lateral forte / Apical |
| β-Catenin | Junção celular | Basolateral | Localização anormal / nuclear ou citoplasmática |
| Vimentina | Emt | Presença ausente/fraca | Up-regulation |
Tabela 1: Marcadores utilizados no estudo. Diferentes marcadores utilizados com sua localização na presença e ausência de tratamento paf.
Este método pode ser melhor utilizado para estudar/testar drogas plausíveis e genes-alvo para vários subtipos de câncer de mama. Isso pode fornecer um dado de resposta a medicamentos mais próximo do cenário in vivo , auxiliando no desenvolvimento mais rápido e confiável de medicamentos. Além disso, este sistema pode ser usado para estudar a sinalização molecular associada à resposta a drogas e resistência a drogas.
Protocol
Representative Results
Discussion
Modelos baseados em linhas celulares estabelecidos são amplamente utilizados para estudar o processo de carcinogênese. As culturas monocamadas das células continuam a fornecer insights sobre as várias vias de sinalização molecular que mediam mudanças características nas célulascancerosas 32. Estudos sobre o papel de oncogenes conhecidos como Ras, Myc e p53 mutado foram relatados pela primeira vez usando culturas monocamadas como o sistema modelo 33,34,35,36.</…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos ao IISER Pune Microscopy Facility pelo acesso a equipamentos e infraestrutura e suporte para os experimentos. Este estudo foi apoiado por uma bolsa do Departamento de Biotecnologia (DBT), Govt. da Índia (BT/PR8699/MED/30/1018/2013), Conselho de Pesquisa em Ciência e Engenharia (SERB), Govt. of India (EMR/2016/001974) e em parte pelo IISER, fundo Pune Core. A. K. foi financiada pela bolsa CSIR-SRF, L.A. foi financiada através de bolsa DST-INSPIRE, V.C foi financiada pela DBT (BT/PR8699/MED/30/1018/2013).
Materials
| 0.05% Trypsin EDTA | Invitrogen | 25300062 | |
| 16% paraformaldehyde | Alfa Aesar | AA433689M | |
| Anti Mouse Alexa Flour 488 | Invitrogen | A11029 | |
| Anti Rabbit Alexa Flour 488 | Invitrogen | A-11008 | |
| BSA | Sigma | A7030 | |
| Chamber Coverglass | Nunc | 155409 | |
| Cholera Toxin | Sigma | C8052-1MG | 1 mg/mL in dH2O |
| Confocal Microscope | Leica | Leica SP8 | |
| DMEM | Gibco | 11965126 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | E9644-0.2MG | 100 mg/mL in dH2O |
| F(ab’)2 fragment of antibody raised in goat against mouse antigen | Jackson Immunoresearch | 115-006-006 | |
| GM130 antibody | Abcam | ab52649 | |
| Goat Serum | Abcam | ab7481 | |
| Hoechst | Invitrogen | 33258 | |
| Horse Serum | Gibco | 16050122 | |
| Hydrocortisone | Sigma | H0888 | 1 mg/mL in ethanol |
| Image Processing Software | ImageJ | ||
| Insulin | Sigma | I1882 | 10 mg/mL stock dH2O |
| lrECM (Matrigel) | Corning | 356231 | |
| Mounting reagent (Slow fade Gold Anti-fade) | Invitrogen | S36937 | |
| Nuclear Stain (Hoechst) | Invitrogen | 33258 | |
| PAF | Cayman Chemicals | 91575-58-5 | Methylcarbamyl PAF C-16, procured as a 10 mg/mL in ethanol |
| Penicillin-Streptomycin | Lonza | 17-602E | |
| Sodium Azide | Sigma | S2002 | |
| Tris Base | Sigma | B9754 | |
| Triton X-100 | Sigma | T8787 | |
| Tween 20 | Sigma | P9416 | |
| Vimentin antibody | Abcam | ab92547 | |
| α6-integrin antibody | Millipore | MAB1378 |
References
- Lacroix, M., Leclercq, G. Relevance of breast cancer cell lines as models for breast tumours: an update. Breast Cancer Research and Treatment. 83 (3), 249-289 (2004).
- Vargo-Gogola, T., Rosen, J. M. Modelling breast cancer: one size does not fit all. Nature Reviews Cancer. 7 (9), 659-672 (2007).
- Runswick, S. K., O’Hare, M. J., Jones, L., Streuli, C. H., Garrod, D. R. Desmosomal adhesion regulates epithelial morphogenesis and cell positioning. Nature Cell Biology. 3 (9), 823-830 (2001).
- Streuli, C. H., Bailey, N., Bissell, M. J. Control of mammary epithelial differentiation: basement membrane induces tissue-specific gene expression in the absence of cell-cell interaction and morphological polarity. Journal of Cell Biology. 115 (5), 1383-1395 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. Journal of Cell Biology. 129 (3), 591-603 (1995).
- Bissell, M. J., Kenny, P. A., Radisky, D. C. Microenvironmental regulators of tissue structure and function also regulate tumor induction and progression: the role of extracellular matrix and its degrading enzymes. Cold Spring Harbor Symposia on Quantitative Biology. 70, 343-356 (2005).
- Heinrich, E. L., et al. The inflammatory tumor microenvironment, epithelial mesenchymal transition and lung carcinogenesis. Cancer Microenvironment. 5 (1), 5-18 (2012).
- Gonda, T. A., Tu, S., Wang, T. C. Chronic inflammation, the tumor microenvironment and carcinogenesis. Cell Cycle. 8 (13), 2005-2013 (2009).
- Berdyshev, E. V., Schmid, P. C., Krebsbach, R. J., Schmid, H. H. Activation of PAF receptors results in enhanced synthesis of 2-arachidonoylglycerol (2-AG) in immune cells. The FASEB Journal. 15 (12), 2171-2178 (2001).
- Rola-Pleszczynski, M., Stankova, J. Cytokine gene regulation by PGE(2), LTB(4) and PAF. Mediators of Inflammation. 1 (2), 5-8 (1992).
- Bussolati, B., et al. PAF produced by human breast cancer cells promotes migration and proliferation of tumor cells and neo-angiogenesis. The American Journal of Pathology. 157 (5), 1713-1725 (2000).
- Chakravarty, V., et al. Prolonged exposure to platelet activating factor transforms breast epithelial cells. Frontiers in Genetics. 12, 634938 (2021).
- Chen, J., et al. Platelet-activating factor receptor-mediated PI3K/AKT activation contributes to the malignant development of esophageal squamous cell carcinoma. Oncogene. 34 (40), 5114-5127 (2015).
- Chen, J., et al. Feed-forward reciprocal activation of PAFR and STAT3 regulates epithelial-mesenchymal transition in non-small cell lung cancer. Cancer Research. 75 (19), 4198-4210 (2015).
- Vidi, P. A., Bissell, M. J., Lelievre, S. A. Three-dimensional culture of human breast epithelial cells: the how and the why. Methods in Molecular Biology. 945, 193-219 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105 (2), 223-235 (1989).
- Petersen, O. W., Ronnov-Jessen, L., Howlett, A. R., Bissell, M. J. Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells. Proceedings of the National Academy of Sciences. 89 (19), 9064-9068 (1992).
- Shaw, K. R., Wrobel, C. N., Brugge, J. S. Use of three-dimensional basement membrane cultures to model oncogene-induced changes in mammary epithelial morphogenesis. Journal of Mammary Gland Biology and Neoplasia. 9 (4), 297-310 (2004).
- Weaver, V. M., Fischer, A. H., Peterson, O. W., Bissell, M. J. The importance of the microenvironment in breast cancer progression: recapitulation of mammary tumorigenesis using a unique human mammary epithelial cell model and a three-dimensional culture assay. Biochemistry and Cell Biology. 74 (6), 833-851 (1996).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nature Methods. 4 (4), 359-365 (2007).
- Bodakuntla, S., Libi, A. V., Sural, S., Trivedi, P., Lahiri, M. N-nitroso-N-ethylurea activates DNA damage surveillance pathways and induces transformation in mammalian cells. BMC Cancer. 14, 287 (2014).
- Banerjee, A., et al. A rhodamine derivative as a "lock" and SCN− as a "key": visible light excitable SCN− sensing in living cells. Chemical Communications. 49 (25), 2527-2529 (2013).
- Ren, G., et al. Reduced basal nitric oxide production induces precancerous mammary lesions via ERBB2 and TGFbeta. Scientific Reports. 9 (1), 6688 (2019).
- Anandi, L., Chakravarty, V., Ashiq, K. A., Bodakuntla, S., Lahiri, M. DNA-dependent protein kinase plays a central role in transformation of breast epithelial cells following alkylation damage. Journal of Cell Science. 130 (21), 3749-3763 (2017).
- Sonnenberg, A., et al. Integrin alpha 6/beta 4 complex is located in hemidesmosomes, suggesting a major role in epidermal cell-basement membrane adhesion. Journal of Cell Biology. 113 (4), 907-917 (1991).
- Pignatelli, M., Cardillo, M. R., Hanby, A., Stamp, G. W. Integrins and their accessory adhesion molecules in mammary carcinomas: loss of polarization in poorly differentiated tumors. Human Pathology. 23 (10), 1159-1166 (1992).
- Natali, P. G., et al. Changes in expression of alpha 6/beta 4 integrin heterodimer in primary and metastatic breast cancer. British Journal of Cancer. 66 (2), 318-322 (1992).
- Davis, T. L., Cress, A. E., Dalkin, B. L., Nagle, R. B. Unique expression pattern of the alpha6beta4 integrin and laminin-5 in human prostate carcinoma. Prostate. 46 (3), 240-248 (2001).
- Liu, J. S., Farlow, J. T., Paulson, A. K., Labarge, M. A., Gartner, Z. J. Programmed cell-to-cell variability in Ras activity triggers emergent behaviors during mammary epithelial morphogenesis. Cell Reports. 2 (5), 1461-1470 (2012).
- Liu, C. Y., Lin, H. H., Tang, M. J., Wang, Y. K. Vimentin contributes to epithelial-mesenchymal transition cancer cell mechanics by mediating cytoskeletal organization and focal adhesion maturation. Oncotarget. 6 (18), 15966-15983 (2015).
- Kapalczynska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Schulze, A., Lehmann, K., Jefferies, H. B., McMahon, M., Downward, J. Analysis of the transcriptional program induced by Raf in epithelial cells. Genes & Development. 15 (8), 981-994 (2001).
- McCarthy, S. A., Samuels, M. L., Pritchard, C. A., Abraham, J. A., McMahon, M. Rapid induction of heparin-binding epidermal growth factor/diphtheria toxin receptor expression by Raf and Ras oncogenes. Genes & Development. 9 (16), 1953-1964 (1995).
- Willis, A., Jung, E. J., Wakefield, T., Chen, X. Mutant p53 exerts a dominant negative effect by preventing wild-type p53 from binding to the promoter of its target genes. Oncogene. 23 (13), 2330-2338 (2004).
- Haupt, S., Raghu, D., Haupt, Y. Mutant p53 drives cancer by subverting multiple tumor suppression pathways. Frontiers in Oncology. 6, 12 (2016).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6 (2018).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. ASSAY and Drug Development Technologies. 12 (4), 207-218 (2014).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Saraiva, D. P., Matias, A. T., Braga, S., Jacinto, A., Cabral, M. G. Establishment of a 3D co-culture with MDA-MB-231 breast cancer cell line and patient-derived immune cells for application in the development of immunotherapies. Frontiers in Oncology. 10, 1543 (2020).

