מתווך פוספוליפידים המושרה טרנספורמציה בתרבויות תלת מימדיות
Summary
הפרוטוקול הנוכחי מתאר את הקמתן של תרביות תלת-ממדיות ‘על גבי’ של קו תאי אפיתל שד ללא טרנספורמציה, MCF10A, ששונה כדי לחקור טרנספורמציה המושרה על-ידי גורם מפעיל טסיות (PAF). אימונו-פלואורסצנציה שימשה להערכת השינוי ונדונה בפירוט.
Abstract
מספר מודלים פותחו כדי לחקור סרטן, כגון מודלים של מכרסמים וקווי תאים מבוססים. תובנות חשובות על קרצינוגנזה סופקו על ידי מחקרים המשתמשים במודלים אלה. קווי תאים סיפקו הבנה של דה-רגולציה של איתותים מולקולריים הקשורים לגידולי שד, בעוד שמודלים של מכרסמים נמצאים בשימוש נרחב לחקר מאפיינים תאיים ומולקולריים של סרטן השד in vivo. הקמת תרביות תלת-ממד של אפיתל השד ותאים סרטניים מסייעת לגשר על הפער בין מודלים in vivo ו– in vitro על ידי חיקוי תנאי in vivo במבחנה. ניתן להשתמש במודל זה כדי להבין את הדה-רגולציה של אירועי איתות מולקולריים מורכבים ואת המאפיינים התאיים במהלך סרטן השד. כאן, מערכת תרבית תלת-ממדית משתנה כדי לחקור טרנספורמציה המושרה על-ידי מתווך פוספוליפידים (גורם מפעיל טסיות, PAF). אימונומודולטורים ומולקולות מופרשות אחרות ממלאים תפקיד מרכזי בייזום הגידול ובהתקדמותו בשד. במחקר הנוכחי, תרביות אצינאר תלת-ממדיות של תאי אפיתל בשד נחשפות למאפייני טרנספורמציה של PAF כגון אובדן קוטביות ושינויים בתכונות התאים. מערכת תרבית תלת-ממדית זו תסייע לשפוך אור על הפרעות גנטיות ו/או אפיגנטיות המושרות על-ידי ישויות שונות של מולקולות קטנות במיקרו-סביבה של הגידול. בנוסף, מערכת זו תספק גם פלטפורמה לזיהוי גנים חדשים וידועים שעשויים להיות מעורבים בתהליך הטרנספורמציה.
Introduction
מספר עצום של מודלים זמינים כדי לחקור את התקדמות הסרטן, כל אחד מהם להיות ייחודי ומייצג תת סוג של מחלה מורכבת זו. כל מודל מספק תובנות ייחודיות ובעלות ערך על הביולוגיה של הסרטן ושיפר את האמצעים לחקות את מצב המחלה בפועל. קווי תאים מבוססים שגודלו כחד-שכבתיים סיפקו תובנות חשובות על תהליכים חיוניים במבחנה, כגון התפשטות, פולשות, נדידה ואפופטוזיס1. אף על פי שתרבית תאים דו-ממדית (2D) היא הכלי המסורתי לחקור את התגובה של תאי יונקים למספר הפרעות סביבתיות, אקסטרפולציה של ממצאים אלה כדי לחזות תגובות ברמת הרקמה אינה נראית משכנעת מספיק. המגבלה העיקרית של התרביות הדו-ממדיות היא שהמיקרו-סביבה שנוצרת שונה במידה רבה מזו של רקמת השד עצמה2. תרבית דו-ממדית חסרה את האינטראקציה של התאים עם המטריצה החוץ-תאית, החיונית לצמיחה של כל רקמה. כמו כן, כוחות מתיחה שחווה התא בתרביות חד-שכבתיות מעכבים את הקוטביות של תאים אלה, ובכך משנים את האיתות וההתנהגות של התא 3,4,5. מערכות תרבית תלת-ממדיות (תלת-ממדיות) פתחו אפיק חדש בתחום חקר הסרטן עם יכולתן לחקות את תנאי ה-in vivo במבחנה. רמזים מיקרו-סביבתיים חיוניים רבים שאבדו בתרבית תאים דו-ממדית יכולים להתבסס מחדש באמצעות תרביות תלת-ממדיות של מטריצה חוץ-תאית עשירה בלמינין (lrECM)6.
מחקרים שונים זיהו את החשיבות של מיקרו-סביבה של הגידול בסרטן 7,8. גורמים הקשורים לדלקת הם חלק מרכזי מהמיקרו-סביבה. גורם מפעיל טסיות (PAF) הוא מתווך פוספוליפידים המופרש על ידי תאי חיסון שונים המתווך תגובות חיסוניות מרובות 9,10. רמות גבוהות של PAF מופרשות על ידי קווי תאים שונים של סרטן השד וקשורות לשגשוג מוגבר11. מחקרים מהמעבדה שלנו הראו כי נוכחות ממושכת של PAF בתרביות אצנר מובילה לשינוי של תאי אפיתל השד12. PAF מפעיל את קולטן ה-PAF (PAFR), ומפעיל את ציר האיתות PI3K/Akt13. דווח כי PAFR קשור גם ל-EMT, פלישה וגרורות14.
הפרוטוקול הנוכחי מדגים מערכת מודל לחקר טרנספורמציה המושרה על ידי PAF, תוך שימוש בתרביות תלת-ממדיות של תאי אפיתל השד, כפי שתואר בעבר על ידי Chakravarty et al.12. תאי אפיתל השד הגדלים על המטריצה החוץ-תאית (תרביות תלת-ממדיות) נוטים ליצור ספרואידים מקוטבים שנעצרו על-ידי צמיחה. אלה נקראים acini ודומים מאוד acini של רקמת השד, היחידה הפונקציונלית הקטנה ביותר של בלוטת החלב, in vivo15. הספרואידים האלה (איור 1A,B) מורכבים ממונו-שכבה של תאי אפיתל מקוטבים צפופים שמקיפים לומן חלול ומחוברים לקרום המרתף (איור 1C). תהליך זה של מורפוגנזה תואר היטב בספרות16. כאשר הם נזרעים על lrECM, התאים עוברים חלוקה והתמיינות כדי ליצור אשכול תאים, אשר לאחר מכן מקטבים מיום 4 ואילך. עד יום 8, האצ’יני מורכב מקבוצה של תאים מקוטבים הנמצאים במגע ישיר עם המטריצה החוץ-תאית וצביר של תאים לא מקוטבים הסגורים בתוך התאים המקוטבים החיצוניים, ללא מגע עם המטריצה. ידוע כי תאים לא מקוטבים אלה עוברים אפופטוזיס עד יום 12 של התרבית, ויוצרים לומן חלול. עד יום 16, מבנים שנעצרו על ידי צמיחה נוצרים16.
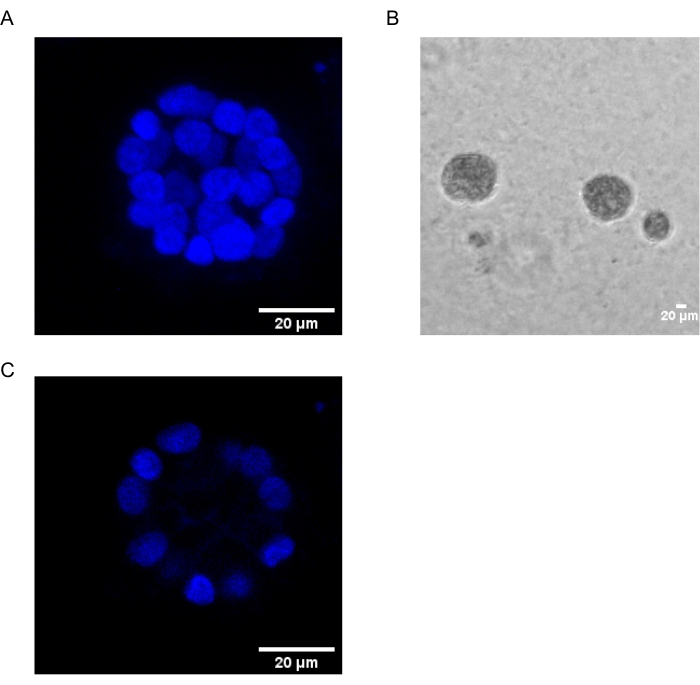
איור 1: גרעינים של תאים באצ’יני המוכתמים בכתם גרעיני . (A) בנייה תלת-ממדית של האצ’יני. (B) תמונת ניגודיות פאזה של MCF10A acini שגדלה על Matrigel במשך 20 יום. (C) החלק המרכזי ביותר מראה נוכחות של לומן חלול. סרגל קנה מידה = 20 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
שלא כמו תרביות דו-ממדיות, תרביות אצ’ינאר מסייעות להבחין בין תאים נורמליים לתאים שעברו טרנספורמציה באמצעות שינויים מורפולוגיים לכאורה. תאי אפיתל שד שאינם מותמרים יוצרים acini עם לומן חלול, המחקה את אציני השד האנושי הרגיל. ספרואידים אלה, עם הטרנספורמציה, מראים מורפולוגיה משובשת המאופיינת באובדן גדול של קוטביות (אחד מסימני ההיכר של סרטן), היעדר לומן, או שיבוש של לומן חלול (עקב התחמקות מאפופטוזיס) שעלול להיגרם עקב הסרת רגולציה של גנים שונים17,18,19,20 . ניתן לחקור טרנספורמציות אלה באמצעות טכניקות נפוצות כגון אימונופלואורסצנציה. לפיכך, מודל תרבית התאים התלת-ממדית יכול לתפקד כשיטה פשוטה לחקור את התהליך של מורפוגנזה של אצנר השד וסרטן השד. הקמת מערכת תרבית תלת-ממדית להבנת ההשפעה של מתווך פוספוליפידים, PAF, תסייע בבדיקת תרופות פרה-קלינית בתפוקה גבוהה.
עבודה זו התאימה את פרוטוקול התרבות התלת-ממדית ‘על גבי‘ 16,21 לחקר טרנספורמציה המושרה על ידי PAF 22. השינויים הפנוטיפיים הנגרמים על ידי חשיפה של האציני למתווך הפוספוליפידים נחקרו באמצעות אימונופלואורסצנציה. במחקר נעשה שימוש בסמני קוטביות ואפיתל שונים למעבר מזנכימלי (EMT). טבלה 1 מזכירה את הלוקליזציה הרגילה שלהם ואת הפנוטיפ הצפוי שלהם בעת הטרנספורמציה.
| נוגדנים | סימני | לוקליזציה רגילה | פנוטיפ מותמר |
| α6-אינטגרין | בזולטרלי | בזל עם כתם רוחבי חלש | כתם רוחבי / אפיקלי חזק |
| β-קטנין | צומת תא-תא | בזולטרלי | לוקליזציה חריגה / גרעינית או ציטופלסמית |
| וימנטין | EMT | נוכחות נעדרת / חלשה | אפ-רגולציה |
טבלה 1: סמנים ששימשו במחקר. סמנים שונים המשמשים עם לוקליזציה שלהם בנוכחות והיעדר טיפול PAF.
ניתן להשתמש בשיטה זו בצורה הטובה ביותר כדי לחקור/לסנן תרופות סבירות ולמקד גנים עבור תתי-סוגים שונים של סרטן השד. זה יכול לספק נתוני תגובה לתרופות קרוב יותר לתרחיש in vivo , ולסייע בפיתוח תרופות מהיר ואמין יותר. כמו כן, ניתן להשתמש במערכת זו כדי לחקור את האיתות המולקולרי הקשור לתגובה לתרופות ולעמידות לתרופות.
Protocol
Representative Results
Discussion
מודלים מבוססים המבוססים על קווי תאים נמצאים בשימוש נרחב כדי לחקור את תהליך הסרטן. תרביות חד-שכבתיות של תאים ממשיכות לספק תובנות על מסלולי האיתות המולקולריים השונים המתווכים שינויים אופייניים בתאים סרטניים32. מחקרים על תפקידם של אונקוגנים ידועים כגון Ras, Myc ו-p53 שעברו מוטציה דו?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
אנו מודים למתקן המיקרוסקופיה IISER פונה על הגישה לציוד ותשתיות ותמיכה בניסויים. מחקר זה נתמך על ידי מענק מהמחלקה לביוטכנולוגיה (DBT), ממשלת הודו (BT/PR8699/MED/30/1018/2013), מועצת המחקר למדע והנדסה (SERB), ממשלת הודו (EMR/2016/001974) ובחלקו על ידי IISER, מימון Pune Core. א. ק. מומן על ידי מלגת CSIR-SRF, לוס אנג’לס מומנה באמצעות מלגת DST-INSPIRE, V.C מומנה על ידי DBT (BT/PR8699/MED/30/1018/2013).
Materials
| 0.05% Trypsin EDTA | Invitrogen | 25300062 | |
| 16% paraformaldehyde | Alfa Aesar | AA433689M | |
| Anti Mouse Alexa Flour 488 | Invitrogen | A11029 | |
| Anti Rabbit Alexa Flour 488 | Invitrogen | A-11008 | |
| BSA | Sigma | A7030 | |
| Chamber Coverglass | Nunc | 155409 | |
| Cholera Toxin | Sigma | C8052-1MG | 1 mg/mL in dH2O |
| Confocal Microscope | Leica | Leica SP8 | |
| DMEM | Gibco | 11965126 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | E9644-0.2MG | 100 mg/mL in dH2O |
| F(ab’)2 fragment of antibody raised in goat against mouse antigen | Jackson Immunoresearch | 115-006-006 | |
| GM130 antibody | Abcam | ab52649 | |
| Goat Serum | Abcam | ab7481 | |
| Hoechst | Invitrogen | 33258 | |
| Horse Serum | Gibco | 16050122 | |
| Hydrocortisone | Sigma | H0888 | 1 mg/mL in ethanol |
| Image Processing Software | ImageJ | ||
| Insulin | Sigma | I1882 | 10 mg/mL stock dH2O |
| lrECM (Matrigel) | Corning | 356231 | |
| Mounting reagent (Slow fade Gold Anti-fade) | Invitrogen | S36937 | |
| Nuclear Stain (Hoechst) | Invitrogen | 33258 | |
| PAF | Cayman Chemicals | 91575-58-5 | Methylcarbamyl PAF C-16, procured as a 10 mg/mL in ethanol |
| Penicillin-Streptomycin | Lonza | 17-602E | |
| Sodium Azide | Sigma | S2002 | |
| Tris Base | Sigma | B9754 | |
| Triton X-100 | Sigma | T8787 | |
| Tween 20 | Sigma | P9416 | |
| Vimentin antibody | Abcam | ab92547 | |
| α6-integrin antibody | Millipore | MAB1378 |
References
- Lacroix, M., Leclercq, G. Relevance of breast cancer cell lines as models for breast tumours: an update. Breast Cancer Research and Treatment. 83 (3), 249-289 (2004).
- Vargo-Gogola, T., Rosen, J. M. Modelling breast cancer: one size does not fit all. Nature Reviews Cancer. 7 (9), 659-672 (2007).
- Runswick, S. K., O’Hare, M. J., Jones, L., Streuli, C. H., Garrod, D. R. Desmosomal adhesion regulates epithelial morphogenesis and cell positioning. Nature Cell Biology. 3 (9), 823-830 (2001).
- Streuli, C. H., Bailey, N., Bissell, M. J. Control of mammary epithelial differentiation: basement membrane induces tissue-specific gene expression in the absence of cell-cell interaction and morphological polarity. Journal of Cell Biology. 115 (5), 1383-1395 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. Journal of Cell Biology. 129 (3), 591-603 (1995).
- Bissell, M. J., Kenny, P. A., Radisky, D. C. Microenvironmental regulators of tissue structure and function also regulate tumor induction and progression: the role of extracellular matrix and its degrading enzymes. Cold Spring Harbor Symposia on Quantitative Biology. 70, 343-356 (2005).
- Heinrich, E. L., et al. The inflammatory tumor microenvironment, epithelial mesenchymal transition and lung carcinogenesis. Cancer Microenvironment. 5 (1), 5-18 (2012).
- Gonda, T. A., Tu, S., Wang, T. C. Chronic inflammation, the tumor microenvironment and carcinogenesis. Cell Cycle. 8 (13), 2005-2013 (2009).
- Berdyshev, E. V., Schmid, P. C., Krebsbach, R. J., Schmid, H. H. Activation of PAF receptors results in enhanced synthesis of 2-arachidonoylglycerol (2-AG) in immune cells. The FASEB Journal. 15 (12), 2171-2178 (2001).
- Rola-Pleszczynski, M., Stankova, J. Cytokine gene regulation by PGE(2), LTB(4) and PAF. Mediators of Inflammation. 1 (2), 5-8 (1992).
- Bussolati, B., et al. PAF produced by human breast cancer cells promotes migration and proliferation of tumor cells and neo-angiogenesis. The American Journal of Pathology. 157 (5), 1713-1725 (2000).
- Chakravarty, V., et al. Prolonged exposure to platelet activating factor transforms breast epithelial cells. Frontiers in Genetics. 12, 634938 (2021).
- Chen, J., et al. Platelet-activating factor receptor-mediated PI3K/AKT activation contributes to the malignant development of esophageal squamous cell carcinoma. Oncogene. 34 (40), 5114-5127 (2015).
- Chen, J., et al. Feed-forward reciprocal activation of PAFR and STAT3 regulates epithelial-mesenchymal transition in non-small cell lung cancer. Cancer Research. 75 (19), 4198-4210 (2015).
- Vidi, P. A., Bissell, M. J., Lelievre, S. A. Three-dimensional culture of human breast epithelial cells: the how and the why. Methods in Molecular Biology. 945, 193-219 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105 (2), 223-235 (1989).
- Petersen, O. W., Ronnov-Jessen, L., Howlett, A. R., Bissell, M. J. Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells. Proceedings of the National Academy of Sciences. 89 (19), 9064-9068 (1992).
- Shaw, K. R., Wrobel, C. N., Brugge, J. S. Use of three-dimensional basement membrane cultures to model oncogene-induced changes in mammary epithelial morphogenesis. Journal of Mammary Gland Biology and Neoplasia. 9 (4), 297-310 (2004).
- Weaver, V. M., Fischer, A. H., Peterson, O. W., Bissell, M. J. The importance of the microenvironment in breast cancer progression: recapitulation of mammary tumorigenesis using a unique human mammary epithelial cell model and a three-dimensional culture assay. Biochemistry and Cell Biology. 74 (6), 833-851 (1996).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nature Methods. 4 (4), 359-365 (2007).
- Bodakuntla, S., Libi, A. V., Sural, S., Trivedi, P., Lahiri, M. N-nitroso-N-ethylurea activates DNA damage surveillance pathways and induces transformation in mammalian cells. BMC Cancer. 14, 287 (2014).
- Banerjee, A., et al. A rhodamine derivative as a "lock" and SCN− as a "key": visible light excitable SCN− sensing in living cells. Chemical Communications. 49 (25), 2527-2529 (2013).
- Ren, G., et al. Reduced basal nitric oxide production induces precancerous mammary lesions via ERBB2 and TGFbeta. Scientific Reports. 9 (1), 6688 (2019).
- Anandi, L., Chakravarty, V., Ashiq, K. A., Bodakuntla, S., Lahiri, M. DNA-dependent protein kinase plays a central role in transformation of breast epithelial cells following alkylation damage. Journal of Cell Science. 130 (21), 3749-3763 (2017).
- Sonnenberg, A., et al. Integrin alpha 6/beta 4 complex is located in hemidesmosomes, suggesting a major role in epidermal cell-basement membrane adhesion. Journal of Cell Biology. 113 (4), 907-917 (1991).
- Pignatelli, M., Cardillo, M. R., Hanby, A., Stamp, G. W. Integrins and their accessory adhesion molecules in mammary carcinomas: loss of polarization in poorly differentiated tumors. Human Pathology. 23 (10), 1159-1166 (1992).
- Natali, P. G., et al. Changes in expression of alpha 6/beta 4 integrin heterodimer in primary and metastatic breast cancer. British Journal of Cancer. 66 (2), 318-322 (1992).
- Davis, T. L., Cress, A. E., Dalkin, B. L., Nagle, R. B. Unique expression pattern of the alpha6beta4 integrin and laminin-5 in human prostate carcinoma. Prostate. 46 (3), 240-248 (2001).
- Liu, J. S., Farlow, J. T., Paulson, A. K., Labarge, M. A., Gartner, Z. J. Programmed cell-to-cell variability in Ras activity triggers emergent behaviors during mammary epithelial morphogenesis. Cell Reports. 2 (5), 1461-1470 (2012).
- Liu, C. Y., Lin, H. H., Tang, M. J., Wang, Y. K. Vimentin contributes to epithelial-mesenchymal transition cancer cell mechanics by mediating cytoskeletal organization and focal adhesion maturation. Oncotarget. 6 (18), 15966-15983 (2015).
- Kapalczynska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Schulze, A., Lehmann, K., Jefferies, H. B., McMahon, M., Downward, J. Analysis of the transcriptional program induced by Raf in epithelial cells. Genes & Development. 15 (8), 981-994 (2001).
- McCarthy, S. A., Samuels, M. L., Pritchard, C. A., Abraham, J. A., McMahon, M. Rapid induction of heparin-binding epidermal growth factor/diphtheria toxin receptor expression by Raf and Ras oncogenes. Genes & Development. 9 (16), 1953-1964 (1995).
- Willis, A., Jung, E. J., Wakefield, T., Chen, X. Mutant p53 exerts a dominant negative effect by preventing wild-type p53 from binding to the promoter of its target genes. Oncogene. 23 (13), 2330-2338 (2004).
- Haupt, S., Raghu, D., Haupt, Y. Mutant p53 drives cancer by subverting multiple tumor suppression pathways. Frontiers in Oncology. 6, 12 (2016).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6 (2018).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. ASSAY and Drug Development Technologies. 12 (4), 207-218 (2014).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Saraiva, D. P., Matias, A. T., Braga, S., Jacinto, A., Cabral, M. G. Establishment of a 3D co-culture with MDA-MB-231 breast cancer cell line and patient-derived immune cells for application in the development of immunotherapies. Frontiers in Oncology. 10, 1543 (2020).

