Фосфолипидный медиатор индуцированная трансформация в трехмерных культурах
Summary
Настоящий протокол описывает создание 3D-культур «сверху» нетрансформированной эпителиальной клеточной линии молочной железы MCF10A, которая была модифицирована для изучения трансформации, вызванной активирующим фактором тромбоцитов (PAF). Иммунофлуоресценция была использована для оценки трансформации и подробно обсуждается.
Abstract
Для изучения рака было разработано несколько моделей, таких как модели грызунов и установленные клеточные линии. Ценная информация о канцерогенезе была получена в результате исследований с использованием этих моделей. Клеточные линии обеспечили понимание дерегуляции молекулярной сигнализации, связанной с опухолевым генезом молочной железы, в то время как модели грызунов широко используются для изучения клеточных и молекулярных характеристик рака молочной железы in vivo. Создание 3D-культур эпителиальных и раковых клеток молочной железы помогает преодолеть разрыв между моделями in vivo и in vitro , имитируя условия in vivo in vitro. Эта модель может быть использована для понимания дерегуляции сложных молекулярных сигнальных событий и клеточных характеристик во время канцерогенеза молочной железы. Здесь система 3D-культур модифицируется для изучения фосфолипидной медиатор-индуцированной (активирующий фактор тромбоцитов, PAF) трансформации. Иммуномодуляторы и другие секретируемые молекулы играют важную роль в инициации и прогрессировании опухоли в молочной железе. В настоящем исследовании 3D-ацинарные культуры эпителиальных клеток молочной железы подвергаются воздействию проявленных характеристик трансформации PAF, таких как потеря полярности и измененные клеточные характеристики. Эта система 3D-культур поможет пролить свет на генетические и / или эпигенетические возмущения, вызванные различными мелкомолекулярными образованиями в микроокружении опухоли. Кроме того, эта система также обеспечит платформу для идентификации новых, а также известных генов, которые могут быть вовлечены в процесс трансформации.
Introduction
Для изучения прогрессирования рака доступно множество моделей, каждая из которых уникальна и представляет собой подтип этого сложного заболевания. Каждая модель предоставляет уникальную и ценную информацию о биологии рака и улучшает средства для имитации фактического состояния заболевания. Установленные клеточные линии, выращенные как монослой, предоставили ценную информацию о жизненно важных процессах in vitro, таких как пролиферация, инвазивность, миграция и апоптоз1. Хотя двумерная (2D) клеточная культура была традиционным инструментом для исследования реакции клеток млекопитающих на несколько возмущений окружающей среды, экстраполяция этих результатов для прогнозирования реакций на тканевом уровне не кажется достаточно убедительной. Основным ограничением 2D-культур является то, что создаваемая микросреда в значительной степени отличается от микросреды самой ткани молочной железы2. 2D культуре не хватает взаимодействия клеток с внеклеточным матриксом, что жизненно важно для роста любой ткани. Кроме того, силы растяжения, испытываемые клеткой в монослойных культурах, препятствуют полярности этих клеток, тем самым изменяя передачу сигналов и поведение клеток 3,4,5. Трехмерные (3D) системы культур открыли новый путь в области исследований рака с их способностью имитировать условия in vivo in vitro. Многие важные микроокружательные сигналы, которые теряются в 2D-культуре клеток, могут быть восстановлены с использованием 3D-культур богатого ламинином внеклеточного матрикса (lrECM)6.
Различные исследования выявили значение микроокружения опухоли в канцерогенезе 7,8. Факторы, связанные с воспалением, являются основной частью микросреды. Активирующий фактор тромбоцитов (PAF) является фосфолипидным медиатором, секретируемым различными иммунными клетками, который опосредует множественные иммунные реакции 9,10. Высокие уровни PAF секретируются различными клеточными линиями рака молочной железы и связаны с усиленной пролиферацией11. Исследования из нашей лаборатории показали, что длительное присутствие PAF в ацинарных культурах приводит к трансформации эпителиальных клеток молочной железы12. PAF активирует PAF-рецептор (PAFR), активируя сигнальную ось13 PI3K/Akt. Также сообщается, что PAFR связан с EMT, инвазией и метастазированием14.
Настоящий протокол демонстрирует модельную систему для изучения PAF-индуцированной трансформации с использованием 3D-культур эпителиальных клеток молочной железы, как было ранее описано Chakravarty et al.12. Эпителиальные клетки молочной железы, выращенные на внеклеточном матриксе (3D-культуры), имеют тенденцию образовывать поляризованные сфероиды, остановленные ростом. Они называются ацинами и очень напоминают ацины ткани молочной железы, наименьшую функциональную единицу молочной железы, in vivo15. Эти сфероиды (фиг.1А,В) состоят из монослоя плотно упакованных поляризованных эпителиальных клеток, окружающих полый просвет и прикрепленных к базальной мембране (фиг.1С). Этот процесс морфогенеза хорошо описан в литературе16. При посеве на lrECM клетки подвергаются делению и дифференцировке, образуя кластер клеток, которые затем поляризуются с 4-го дня. К 8-му дню ацины состоят из группы поляризованных клеток, которые находятся в прямом контакте с внеклеточным матриксом и скопления неполяризованных клеток, заключенных во внешние поляризованные клетки, без контакта с матрицей. Известно, что эти неполяризованные клетки подвергаются апоптозу на 12-й день культуры, образуя полый просвет. К 16-му дню формируется16 структур, остановленных ростом.
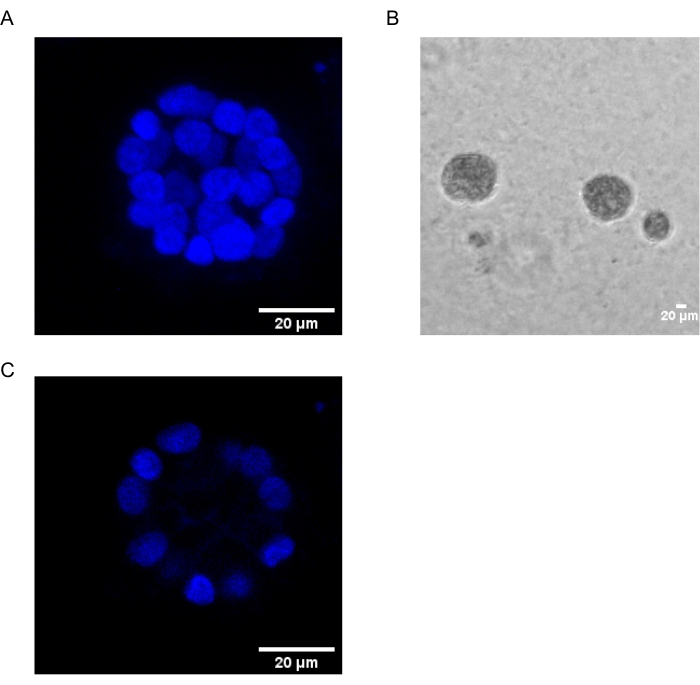
Рисунок 1: Ядра клеток в ацини, окрашенные ядерным пятном. (А) 3D конструкция ацини. (B) Фазоконтрастное изображение ацини MCF10A, выращенное на Matrigel в течение 20 дней. (C) Самая центральная секция показывает наличие полого просвета. Шкала = 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
В отличие от 2D-культур, ацинарные культуры помогают различать нормальные и трансформированные клетки через очевидные изменения морфологии. Нетрансформированные эпителиальные клетки молочной железы образуют ацинус с полым просветом, имитируя нормальные ацины молочной железы человека. Эти сфероиды при трансформации показывают нарушенную морфологию, характеризующуюся значительной потерей полярности (одним из признаков рака), отсутствием просвета или нарушением полого просвета (из-за уклонения от апоптоза), что может быть вызвано дерегуляцией различных генов 17,18,19,20 . Эти превращения могут быть изучены с использованием широко используемых методов, таких как иммунофлуоресценция. Таким образом, модель 3D-культуры клеток может функционировать как простой метод исследования процесса ацинарного морфогенеза молочной железы и канцерогенеза молочной железы. Создание системы 3D-культур для понимания эффекта медиатора фосфолипидов, PAF, поможет в высокопроизводительном доклиническом скрининге лекарств.
Эта работа адаптировала протокол 3D «на вершине» культуры 16,21 для изучения трансформации, вызванной PAF22. Фенотипические изменения, вызванные воздействием ацинумов на медиатор фосфолипидов, изучали с использованием иммунофлуоресценции. В исследовании использовались различные маркеры полярности и эпителиального перехода в мезенхимальный переход (ЭМТ) 12,16. В таблице 1 упоминается их нормальная локализация и ожидаемый фенотип при трансформации.
| Антитела | Знаки | Нормальная локализация | Трансформированный фенотип |
| α6-Интегрин | Базолатераль | Базальный со слабым боковым пятном | Сильное боковое / апикальное пятно |
| β-Катенин | Клеточно-клеточный переход | Базолатераль | Аномальная / ядерная или цитоплазматическая локализация |
| Виментин | ЭМТ | Отсутствующее/слабое присутствие | Ап-регулирование |
Таблица 1: Маркеры, использованные в исследовании. Используются различные маркеры с их локализацией при наличии и отсутствии лечения ПАФ.
Этот метод может быть наилучшим образом использован для изучения / скрининга правдоподобных лекарств и генов-мишеней для различных подтипов рака молочной железы. Это может обеспечить данные о реакции на лекарства ближе к сценарию in vivo , помогая в более быстрой и надежной разработке лекарств. Также эта система может быть использована для изучения молекулярной сигнализации, связанной с лекарственной реакцией и лекарственной устойчивостью.
Protocol
Representative Results
Discussion
Установленные модели на основе клеточных линий широко используются для изучения процесса канцерогенеза. Однослойные культуры клеток продолжают давать представление о различных молекулярных сигнальных путях, которые опосредуют характерные изменения в раковых клетках32….
Disclosures
The authors have nothing to disclose.
Acknowledgements
Мы благодарим Центр микроскопии IISER в Пуне за доступ к оборудованию и инфраструктуре и поддержку экспериментов. Это исследование было поддержано грантом Департамента биотехнологии (DBT), правительства Индии (BT/PR8699/MED/30/1018/2013), Совета по научным и инженерным исследованиям (SERB), правительства Индии (EMR/2016/001974) и частично финансированием IISER, Pune Core. A.K. финансировался стипендией CSIR-SRF, L.A. финансировался через стипендию DST-INSPIRE, V.C финансировался DBT (BT/PR8699/MED/30/1018/2013).
Materials
| 0.05% Trypsin EDTA | Invitrogen | 25300062 | |
| 16% paraformaldehyde | Alfa Aesar | AA433689M | |
| Anti Mouse Alexa Flour 488 | Invitrogen | A11029 | |
| Anti Rabbit Alexa Flour 488 | Invitrogen | A-11008 | |
| BSA | Sigma | A7030 | |
| Chamber Coverglass | Nunc | 155409 | |
| Cholera Toxin | Sigma | C8052-1MG | 1 mg/mL in dH2O |
| Confocal Microscope | Leica | Leica SP8 | |
| DMEM | Gibco | 11965126 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | E9644-0.2MG | 100 mg/mL in dH2O |
| F(ab’)2 fragment of antibody raised in goat against mouse antigen | Jackson Immunoresearch | 115-006-006 | |
| GM130 antibody | Abcam | ab52649 | |
| Goat Serum | Abcam | ab7481 | |
| Hoechst | Invitrogen | 33258 | |
| Horse Serum | Gibco | 16050122 | |
| Hydrocortisone | Sigma | H0888 | 1 mg/mL in ethanol |
| Image Processing Software | ImageJ | ||
| Insulin | Sigma | I1882 | 10 mg/mL stock dH2O |
| lrECM (Matrigel) | Corning | 356231 | |
| Mounting reagent (Slow fade Gold Anti-fade) | Invitrogen | S36937 | |
| Nuclear Stain (Hoechst) | Invitrogen | 33258 | |
| PAF | Cayman Chemicals | 91575-58-5 | Methylcarbamyl PAF C-16, procured as a 10 mg/mL in ethanol |
| Penicillin-Streptomycin | Lonza | 17-602E | |
| Sodium Azide | Sigma | S2002 | |
| Tris Base | Sigma | B9754 | |
| Triton X-100 | Sigma | T8787 | |
| Tween 20 | Sigma | P9416 | |
| Vimentin antibody | Abcam | ab92547 | |
| α6-integrin antibody | Millipore | MAB1378 |
References
- Lacroix, M., Leclercq, G. Relevance of breast cancer cell lines as models for breast tumours: an update. Breast Cancer Research and Treatment. 83 (3), 249-289 (2004).
- Vargo-Gogola, T., Rosen, J. M. Modelling breast cancer: one size does not fit all. Nature Reviews Cancer. 7 (9), 659-672 (2007).
- Runswick, S. K., O’Hare, M. J., Jones, L., Streuli, C. H., Garrod, D. R. Desmosomal adhesion regulates epithelial morphogenesis and cell positioning. Nature Cell Biology. 3 (9), 823-830 (2001).
- Streuli, C. H., Bailey, N., Bissell, M. J. Control of mammary epithelial differentiation: basement membrane induces tissue-specific gene expression in the absence of cell-cell interaction and morphological polarity. Journal of Cell Biology. 115 (5), 1383-1395 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. Journal of Cell Biology. 129 (3), 591-603 (1995).
- Bissell, M. J., Kenny, P. A., Radisky, D. C. Microenvironmental regulators of tissue structure and function also regulate tumor induction and progression: the role of extracellular matrix and its degrading enzymes. Cold Spring Harbor Symposia on Quantitative Biology. 70, 343-356 (2005).
- Heinrich, E. L., et al. The inflammatory tumor microenvironment, epithelial mesenchymal transition and lung carcinogenesis. Cancer Microenvironment. 5 (1), 5-18 (2012).
- Gonda, T. A., Tu, S., Wang, T. C. Chronic inflammation, the tumor microenvironment and carcinogenesis. Cell Cycle. 8 (13), 2005-2013 (2009).
- Berdyshev, E. V., Schmid, P. C., Krebsbach, R. J., Schmid, H. H. Activation of PAF receptors results in enhanced synthesis of 2-arachidonoylglycerol (2-AG) in immune cells. The FASEB Journal. 15 (12), 2171-2178 (2001).
- Rola-Pleszczynski, M., Stankova, J. Cytokine gene regulation by PGE(2), LTB(4) and PAF. Mediators of Inflammation. 1 (2), 5-8 (1992).
- Bussolati, B., et al. PAF produced by human breast cancer cells promotes migration and proliferation of tumor cells and neo-angiogenesis. The American Journal of Pathology. 157 (5), 1713-1725 (2000).
- Chakravarty, V., et al. Prolonged exposure to platelet activating factor transforms breast epithelial cells. Frontiers in Genetics. 12, 634938 (2021).
- Chen, J., et al. Platelet-activating factor receptor-mediated PI3K/AKT activation contributes to the malignant development of esophageal squamous cell carcinoma. Oncogene. 34 (40), 5114-5127 (2015).
- Chen, J., et al. Feed-forward reciprocal activation of PAFR and STAT3 regulates epithelial-mesenchymal transition in non-small cell lung cancer. Cancer Research. 75 (19), 4198-4210 (2015).
- Vidi, P. A., Bissell, M. J., Lelievre, S. A. Three-dimensional culture of human breast epithelial cells: the how and the why. Methods in Molecular Biology. 945, 193-219 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105 (2), 223-235 (1989).
- Petersen, O. W., Ronnov-Jessen, L., Howlett, A. R., Bissell, M. J. Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells. Proceedings of the National Academy of Sciences. 89 (19), 9064-9068 (1992).
- Shaw, K. R., Wrobel, C. N., Brugge, J. S. Use of three-dimensional basement membrane cultures to model oncogene-induced changes in mammary epithelial morphogenesis. Journal of Mammary Gland Biology and Neoplasia. 9 (4), 297-310 (2004).
- Weaver, V. M., Fischer, A. H., Peterson, O. W., Bissell, M. J. The importance of the microenvironment in breast cancer progression: recapitulation of mammary tumorigenesis using a unique human mammary epithelial cell model and a three-dimensional culture assay. Biochemistry and Cell Biology. 74 (6), 833-851 (1996).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nature Methods. 4 (4), 359-365 (2007).
- Bodakuntla, S., Libi, A. V., Sural, S., Trivedi, P., Lahiri, M. N-nitroso-N-ethylurea activates DNA damage surveillance pathways and induces transformation in mammalian cells. BMC Cancer. 14, 287 (2014).
- Banerjee, A., et al. A rhodamine derivative as a "lock" and SCN− as a "key": visible light excitable SCN− sensing in living cells. Chemical Communications. 49 (25), 2527-2529 (2013).
- Ren, G., et al. Reduced basal nitric oxide production induces precancerous mammary lesions via ERBB2 and TGFbeta. Scientific Reports. 9 (1), 6688 (2019).
- Anandi, L., Chakravarty, V., Ashiq, K. A., Bodakuntla, S., Lahiri, M. DNA-dependent protein kinase plays a central role in transformation of breast epithelial cells following alkylation damage. Journal of Cell Science. 130 (21), 3749-3763 (2017).
- Sonnenberg, A., et al. Integrin alpha 6/beta 4 complex is located in hemidesmosomes, suggesting a major role in epidermal cell-basement membrane adhesion. Journal of Cell Biology. 113 (4), 907-917 (1991).
- Pignatelli, M., Cardillo, M. R., Hanby, A., Stamp, G. W. Integrins and their accessory adhesion molecules in mammary carcinomas: loss of polarization in poorly differentiated tumors. Human Pathology. 23 (10), 1159-1166 (1992).
- Natali, P. G., et al. Changes in expression of alpha 6/beta 4 integrin heterodimer in primary and metastatic breast cancer. British Journal of Cancer. 66 (2), 318-322 (1992).
- Davis, T. L., Cress, A. E., Dalkin, B. L., Nagle, R. B. Unique expression pattern of the alpha6beta4 integrin and laminin-5 in human prostate carcinoma. Prostate. 46 (3), 240-248 (2001).
- Liu, J. S., Farlow, J. T., Paulson, A. K., Labarge, M. A., Gartner, Z. J. Programmed cell-to-cell variability in Ras activity triggers emergent behaviors during mammary epithelial morphogenesis. Cell Reports. 2 (5), 1461-1470 (2012).
- Liu, C. Y., Lin, H. H., Tang, M. J., Wang, Y. K. Vimentin contributes to epithelial-mesenchymal transition cancer cell mechanics by mediating cytoskeletal organization and focal adhesion maturation. Oncotarget. 6 (18), 15966-15983 (2015).
- Kapalczynska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Schulze, A., Lehmann, K., Jefferies, H. B., McMahon, M., Downward, J. Analysis of the transcriptional program induced by Raf in epithelial cells. Genes & Development. 15 (8), 981-994 (2001).
- McCarthy, S. A., Samuels, M. L., Pritchard, C. A., Abraham, J. A., McMahon, M. Rapid induction of heparin-binding epidermal growth factor/diphtheria toxin receptor expression by Raf and Ras oncogenes. Genes & Development. 9 (16), 1953-1964 (1995).
- Willis, A., Jung, E. J., Wakefield, T., Chen, X. Mutant p53 exerts a dominant negative effect by preventing wild-type p53 from binding to the promoter of its target genes. Oncogene. 23 (13), 2330-2338 (2004).
- Haupt, S., Raghu, D., Haupt, Y. Mutant p53 drives cancer by subverting multiple tumor suppression pathways. Frontiers in Oncology. 6, 12 (2016).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6 (2018).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. ASSAY and Drug Development Technologies. 12 (4), 207-218 (2014).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Saraiva, D. P., Matias, A. T., Braga, S., Jacinto, A., Cabral, M. G. Establishment of a 3D co-culture with MDA-MB-231 breast cancer cell line and patient-derived immune cells for application in the development of immunotherapies. Frontiers in Oncology. 10, 1543 (2020).

