Fosfolipidmediatörinducerad transformation i tredimensionella kulturer
Summary
Detta protokoll beskriver upprättandet av 3D “på toppen “ -kulturer av en icke-transformerad bröstepitelcelllinje, MCF10A, som har modifierats för att studera trombocytaktiveringsfaktor (PAF) inducerad transformation. Immunofluorescens har använts för att bedöma transformationen och diskuteras i detalj.
Abstract
Flera modeller har utvecklats för att studera cancer, till exempel gnagarmodeller och etablerade cellinjer. Värdefulla insikter om cancerframkallande ämnen har getts genom studier med hjälp av dessa modeller. Cellinjer har gett en förståelse för avregleringen av molekylär signalering i samband med brösttumörigenes, medan gnagarmodeller används i stor utsträckning för att studera cellulära och molekylära egenskaper hos bröstcancer in vivo. Upprättandet av 3D-kulturer av bröstepitel- och cancerceller hjälper till att överbrygga klyftan mellan in vivo- och in vitro-modeller genom att efterlikna in vivo-förhållandena in vitro. Denna modell kan användas för att förstå avregleringen av komplexa molekylära signalhändelser och de cellulära egenskaperna under bröstcancer. Här modifieras ett 3D-odlingssystem för att studera en fosfolipidmediatorinducerad (trombocytaktiveringsfaktor, PAF) transformation. Immunmodulatorer och andra utsöndrade molekyler spelar en viktig roll i tumörinitiering och progression i bröstet. I den aktuella studien utsätts 3D-acinarkulturer av bröstepitelceller för PAF uppvisade transformationsegenskaper såsom förlust av polaritet och förändrade cellulära egenskaper. Detta 3D-odlingssystem kommer att hjälpa till att belysa genetiska och / eller epigenetiska störningar inducerade av olika småmolekylära enheter i tumörmikromiljön. Dessutom kommer detta system också att tillhandahålla en plattform för identifiering av nya såväl som kända gener som kan vara involverade i omvandlingsprocessen.
Introduction
En myriad av modeller finns tillgängliga för att studera utvecklingen av cancer, var och en av dem är unik och representerar en subtyp av denna komplexa sjukdom. Varje modell ger unika och värdefulla insikter i cancerbiologi och har förbättrat medlen för att efterlikna det faktiska sjukdomstillståndet. Etablerade cellinjer som odlas som ett monolager har gett värdefulla insikter i viktiga processer in vitro, såsom spridning, invasivitet, migration och apoptos1. Även om tvådimensionell (2D) cellodling har varit det traditionella verktyget för att undersöka däggdjurscellernas svar på flera miljöstörningar, verkar extrapolering av dessa fynd för att förutsäga vävnadsnivåsvar inte tillräckligt övertygande. Den största begränsningen av 2D-kulturerna är att den skapade mikromiljön skiljer sig till stor del från bröstvävnaden i sig2. 2D-kulturen saknar interaktionen mellan cellerna och den extracellulära matrisen, vilket är avgörande för tillväxten av vilken vävnad som helst. Dragkrafter som upplevs av cellen i monolagerkulturer hindrar också polariteten hos dessa celler, vilket förändrar cellsignalering och beteende 3,4,5. Tredimensionella (3D) odlingssystem har öppnat en ny väg inom cancerforskningen med sin förmåga att efterlikna in vivo-förhållandena in vitro. Många viktiga mikromiljösignaler som går förlorade i 2D-cellodling kan återupprättas med hjälp av 3D-kulturer av lamininrik extracellulär matris (lrECM)6.
Olika studier har identifierat betydelsen av tumörmikromiljön vid cancerframkallande 7,8. Inflammationsassocierade faktorer är en stor del av mikromiljön. Trombocytaktiveringsfaktor (PAF) är en fosfolipidmediator som utsöndras av olika immunceller som förmedlar flera immunsvar 9,10. Höga nivåer av PAF utsöndras av olika bröstcancercellinjer och är förknippade med förbättrad proliferation11. Studier från vårt laboratorium har visat att den långvariga närvaron av PAF i acinarkulturer leder till omvandling av bröstepitelceller12. PAF aktiverar PAF-receptorn (PAFR) och aktiverar PI3K/Akt-signalaxeln13. PAFR rapporteras också vara associerad med EMT, invasion och metastasering14.
Detta protokoll visar ett modellsystem för att studera PAF-inducerad transformation, med hjälp av 3D-kulturer av bröstepitelceller, som tidigare har beskrivits av Chakravarty et al.12. Bröstepitelcellerna som odlas på den extracellulära matrisen (3D-kulturer) tenderar att bilda polariserade tillväxtarresterade sfäroider. Dessa kallas acini och liknar acini i bröstvävnad, den minsta funktionella enheten i bröstkörteln, in vivo15. Dessa sfäroider (figur 1A,B) består av ett monolager av tätt packade polariserade epitelceller som omger en ihålig lumen och är fästa vid källarmembranet (figur 1C). Denna process av morfogenes har beskrivits väl i litteratur16. När de seedas på lrECM genomgår cellerna delning och differentiering för att bilda ett kluster av celler, som sedan polariseras från dag 4 och framåt. Vid dag 8 består acini av en grupp polariserade celler som är i direkt kontakt med den extracellulära matrisen och ett kluster av opolariserade celler inneslutna i de yttre polariserade cellerna, utan kontakt med matrisen. Dessa opolariserade celler är kända för att genomgå apoptos vid dag 12 av kulturen och bildar en ihålig lumen. Vid dag 16 bildas tillväxtarresterade strukturer16.
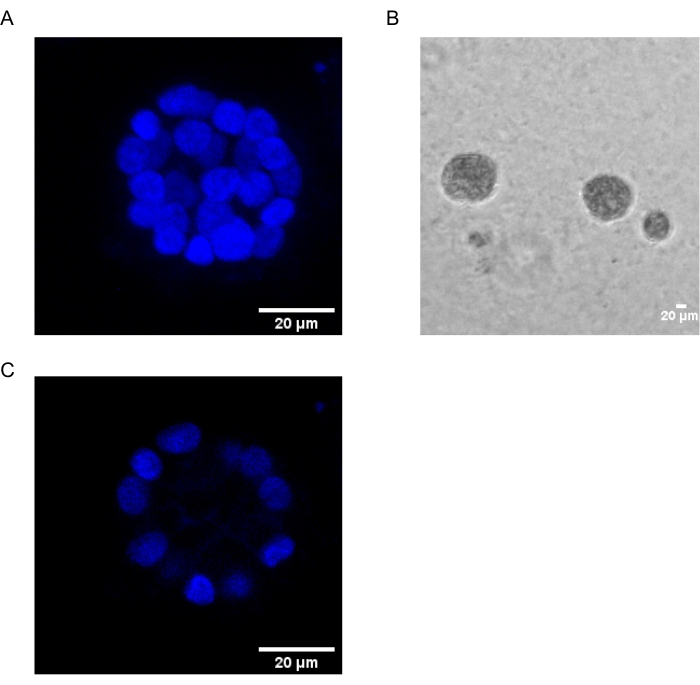
Figur 1: Kärnor av celler i acini färgade med en kärnfläck . (A) 3D-konstruktion av acini. (B) Faskontrastbild av MCF10A acini odlad på Matrigel i 20 dagar. (C) Den mittersta sektionen visar närvaron av en ihålig lumen. Skalstreck = 20 μm. Klicka här för att se en större version av denna figur.
Till skillnad från 2D-kulturer hjälper acinarkulturer att skilja normala och transformerade celler genom uppenbara morfologiska förändringar. Icke-transformerade bröstepitelceller bildar acini med en ihålig lumen som efterliknar den normala mänskliga bröstacini. Dessa sfäroider, vid transformation, visar en störd morfologi som kännetecknas av en stor förlust av polaritet (ett av kännetecknen för cancer), frånvaro av lumen eller störning av den ihåliga lumen (på grund av undvikande av apoptos) som kan induceras på grund av avreglering av olika gener17,18,19,20 . Dessa transformationer kan studeras med hjälp av vanliga tekniker såsom immunofluorescens. Således kan 3D-cellodlingsmodellen fungera som en enkel metod för att undersöka processen för bröstacinarmorfogenes och bröstcancer. Att etablera ett 3D-odlingssystem för att förstå effekten av en fosfolipidmediator, PAF, kommer att hjälpa till med preklinisk läkemedelsscreening med hög genomströmning.
Detta arbete har anpassat 3D ‘on top’ kulturprotokoll16,21 för att studera transformation inducerad av PAF 22. De fenotypiska förändringarna som inducerades av exponering av acini för fosfolipidmediatorn studerades med användning av immunofluorescens. Olika markörer för polaritet och epitelial till mesenkymal övergång (EMT)12,16 användes i studien. Tabell 1 nämner deras normala lokalisering och deras förväntade fenotyp vid transformation.
| Antikroppar | Markerar | Normal lokalisering | Transformerad fenotyp |
| α6-Integrin | Basolateral | Basal med svag lateral fläck | Stark lateral / apikal fläck |
| β-Catenin | Korsning mellan cell och cell | Basolateral | Onormal / nukleär eller cytoplasmatisk lokalisering |
| Vimentin | Emt | Frånvarande / svag närvaro | Uppreglering |
Tabell 1: Markörer som använts i studien. Olika markörer som används med deras lokalisering i närvaro och frånvaro av PAF-behandling.
Denna metod kan bäst användas för att studera / screena troliga läkemedel och målgener för olika bröstcancerundertyper. Detta kan ge en läkemedelsresponsdata närmare in vivo-scenariot , vilket hjälper till med snabbare och mer tillförlitlig läkemedelsutveckling. Detta system kan också användas för att studera molekylär signalering associerad med läkemedelssvar och läkemedelsresistens.
Protocol
Representative Results
Discussion
Etablerade cellinjebaserade modeller används ofta för att studera processen för cancerframkallande. Monolagerkulturer av celler fortsätter att ge insikter i de olika molekylära signalvägarna som förmedlar karakteristiska förändringar i cancerceller32. Studier av rollen av välkända onkogener som Ras, Myc och muterad p53 rapporterades först med monolagerkulturer som modellsystem33,34,35,36<…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi tackar IISER Pune Microscopy Facility för tillgång till utrustning och infrastruktur och stöd för experimenten. Denna studie stöddes av ett bidrag från Department of Biotechnology (DBT), Indiens regering (BT/PR8699/MED/30/1018/2013), Science and Engineering Research Board (SERB), Indiens regering (EMR/2016/001974) och delvis av IISER, Pune Core funding. A. K. finansierades av CSIR-SRF-stipendiet, LA finansierades genom DST-INSPIRE-stipendium, V.C finansierades av DBT (BT/PR8699/MED/30/1018/2013).
Materials
| 0.05% Trypsin EDTA | Invitrogen | 25300062 | |
| 16% paraformaldehyde | Alfa Aesar | AA433689M | |
| Anti Mouse Alexa Flour 488 | Invitrogen | A11029 | |
| Anti Rabbit Alexa Flour 488 | Invitrogen | A-11008 | |
| BSA | Sigma | A7030 | |
| Chamber Coverglass | Nunc | 155409 | |
| Cholera Toxin | Sigma | C8052-1MG | 1 mg/mL in dH2O |
| Confocal Microscope | Leica | Leica SP8 | |
| DMEM | Gibco | 11965126 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | E9644-0.2MG | 100 mg/mL in dH2O |
| F(ab’)2 fragment of antibody raised in goat against mouse antigen | Jackson Immunoresearch | 115-006-006 | |
| GM130 antibody | Abcam | ab52649 | |
| Goat Serum | Abcam | ab7481 | |
| Hoechst | Invitrogen | 33258 | |
| Horse Serum | Gibco | 16050122 | |
| Hydrocortisone | Sigma | H0888 | 1 mg/mL in ethanol |
| Image Processing Software | ImageJ | ||
| Insulin | Sigma | I1882 | 10 mg/mL stock dH2O |
| lrECM (Matrigel) | Corning | 356231 | |
| Mounting reagent (Slow fade Gold Anti-fade) | Invitrogen | S36937 | |
| Nuclear Stain (Hoechst) | Invitrogen | 33258 | |
| PAF | Cayman Chemicals | 91575-58-5 | Methylcarbamyl PAF C-16, procured as a 10 mg/mL in ethanol |
| Penicillin-Streptomycin | Lonza | 17-602E | |
| Sodium Azide | Sigma | S2002 | |
| Tris Base | Sigma | B9754 | |
| Triton X-100 | Sigma | T8787 | |
| Tween 20 | Sigma | P9416 | |
| Vimentin antibody | Abcam | ab92547 | |
| α6-integrin antibody | Millipore | MAB1378 |
References
- Lacroix, M., Leclercq, G. Relevance of breast cancer cell lines as models for breast tumours: an update. Breast Cancer Research and Treatment. 83 (3), 249-289 (2004).
- Vargo-Gogola, T., Rosen, J. M. Modelling breast cancer: one size does not fit all. Nature Reviews Cancer. 7 (9), 659-672 (2007).
- Runswick, S. K., O’Hare, M. J., Jones, L., Streuli, C. H., Garrod, D. R. Desmosomal adhesion regulates epithelial morphogenesis and cell positioning. Nature Cell Biology. 3 (9), 823-830 (2001).
- Streuli, C. H., Bailey, N., Bissell, M. J. Control of mammary epithelial differentiation: basement membrane induces tissue-specific gene expression in the absence of cell-cell interaction and morphological polarity. Journal of Cell Biology. 115 (5), 1383-1395 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. Journal of Cell Biology. 129 (3), 591-603 (1995).
- Bissell, M. J., Kenny, P. A., Radisky, D. C. Microenvironmental regulators of tissue structure and function also regulate tumor induction and progression: the role of extracellular matrix and its degrading enzymes. Cold Spring Harbor Symposia on Quantitative Biology. 70, 343-356 (2005).
- Heinrich, E. L., et al. The inflammatory tumor microenvironment, epithelial mesenchymal transition and lung carcinogenesis. Cancer Microenvironment. 5 (1), 5-18 (2012).
- Gonda, T. A., Tu, S., Wang, T. C. Chronic inflammation, the tumor microenvironment and carcinogenesis. Cell Cycle. 8 (13), 2005-2013 (2009).
- Berdyshev, E. V., Schmid, P. C., Krebsbach, R. J., Schmid, H. H. Activation of PAF receptors results in enhanced synthesis of 2-arachidonoylglycerol (2-AG) in immune cells. The FASEB Journal. 15 (12), 2171-2178 (2001).
- Rola-Pleszczynski, M., Stankova, J. Cytokine gene regulation by PGE(2), LTB(4) and PAF. Mediators of Inflammation. 1 (2), 5-8 (1992).
- Bussolati, B., et al. PAF produced by human breast cancer cells promotes migration and proliferation of tumor cells and neo-angiogenesis. The American Journal of Pathology. 157 (5), 1713-1725 (2000).
- Chakravarty, V., et al. Prolonged exposure to platelet activating factor transforms breast epithelial cells. Frontiers in Genetics. 12, 634938 (2021).
- Chen, J., et al. Platelet-activating factor receptor-mediated PI3K/AKT activation contributes to the malignant development of esophageal squamous cell carcinoma. Oncogene. 34 (40), 5114-5127 (2015).
- Chen, J., et al. Feed-forward reciprocal activation of PAFR and STAT3 regulates epithelial-mesenchymal transition in non-small cell lung cancer. Cancer Research. 75 (19), 4198-4210 (2015).
- Vidi, P. A., Bissell, M. J., Lelievre, S. A. Three-dimensional culture of human breast epithelial cells: the how and the why. Methods in Molecular Biology. 945, 193-219 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105 (2), 223-235 (1989).
- Petersen, O. W., Ronnov-Jessen, L., Howlett, A. R., Bissell, M. J. Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells. Proceedings of the National Academy of Sciences. 89 (19), 9064-9068 (1992).
- Shaw, K. R., Wrobel, C. N., Brugge, J. S. Use of three-dimensional basement membrane cultures to model oncogene-induced changes in mammary epithelial morphogenesis. Journal of Mammary Gland Biology and Neoplasia. 9 (4), 297-310 (2004).
- Weaver, V. M., Fischer, A. H., Peterson, O. W., Bissell, M. J. The importance of the microenvironment in breast cancer progression: recapitulation of mammary tumorigenesis using a unique human mammary epithelial cell model and a three-dimensional culture assay. Biochemistry and Cell Biology. 74 (6), 833-851 (1996).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nature Methods. 4 (4), 359-365 (2007).
- Bodakuntla, S., Libi, A. V., Sural, S., Trivedi, P., Lahiri, M. N-nitroso-N-ethylurea activates DNA damage surveillance pathways and induces transformation in mammalian cells. BMC Cancer. 14, 287 (2014).
- Banerjee, A., et al. A rhodamine derivative as a "lock" and SCN− as a "key": visible light excitable SCN− sensing in living cells. Chemical Communications. 49 (25), 2527-2529 (2013).
- Ren, G., et al. Reduced basal nitric oxide production induces precancerous mammary lesions via ERBB2 and TGFbeta. Scientific Reports. 9 (1), 6688 (2019).
- Anandi, L., Chakravarty, V., Ashiq, K. A., Bodakuntla, S., Lahiri, M. DNA-dependent protein kinase plays a central role in transformation of breast epithelial cells following alkylation damage. Journal of Cell Science. 130 (21), 3749-3763 (2017).
- Sonnenberg, A., et al. Integrin alpha 6/beta 4 complex is located in hemidesmosomes, suggesting a major role in epidermal cell-basement membrane adhesion. Journal of Cell Biology. 113 (4), 907-917 (1991).
- Pignatelli, M., Cardillo, M. R., Hanby, A., Stamp, G. W. Integrins and their accessory adhesion molecules in mammary carcinomas: loss of polarization in poorly differentiated tumors. Human Pathology. 23 (10), 1159-1166 (1992).
- Natali, P. G., et al. Changes in expression of alpha 6/beta 4 integrin heterodimer in primary and metastatic breast cancer. British Journal of Cancer. 66 (2), 318-322 (1992).
- Davis, T. L., Cress, A. E., Dalkin, B. L., Nagle, R. B. Unique expression pattern of the alpha6beta4 integrin and laminin-5 in human prostate carcinoma. Prostate. 46 (3), 240-248 (2001).
- Liu, J. S., Farlow, J. T., Paulson, A. K., Labarge, M. A., Gartner, Z. J. Programmed cell-to-cell variability in Ras activity triggers emergent behaviors during mammary epithelial morphogenesis. Cell Reports. 2 (5), 1461-1470 (2012).
- Liu, C. Y., Lin, H. H., Tang, M. J., Wang, Y. K. Vimentin contributes to epithelial-mesenchymal transition cancer cell mechanics by mediating cytoskeletal organization and focal adhesion maturation. Oncotarget. 6 (18), 15966-15983 (2015).
- Kapalczynska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Schulze, A., Lehmann, K., Jefferies, H. B., McMahon, M., Downward, J. Analysis of the transcriptional program induced by Raf in epithelial cells. Genes & Development. 15 (8), 981-994 (2001).
- McCarthy, S. A., Samuels, M. L., Pritchard, C. A., Abraham, J. A., McMahon, M. Rapid induction of heparin-binding epidermal growth factor/diphtheria toxin receptor expression by Raf and Ras oncogenes. Genes & Development. 9 (16), 1953-1964 (1995).
- Willis, A., Jung, E. J., Wakefield, T., Chen, X. Mutant p53 exerts a dominant negative effect by preventing wild-type p53 from binding to the promoter of its target genes. Oncogene. 23 (13), 2330-2338 (2004).
- Haupt, S., Raghu, D., Haupt, Y. Mutant p53 drives cancer by subverting multiple tumor suppression pathways. Frontiers in Oncology. 6, 12 (2016).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6 (2018).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. ASSAY and Drug Development Technologies. 12 (4), 207-218 (2014).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Saraiva, D. P., Matias, A. T., Braga, S., Jacinto, A., Cabral, M. G. Establishment of a 3D co-culture with MDA-MB-231 breast cancer cell line and patient-derived immune cells for application in the development of immunotherapies. Frontiers in Oncology. 10, 1543 (2020).

