면역 조직 화학 및 면역 세포 화학: 광학 현미경을 통한 조직 이미징
English
Share
Overview
출처: 마이클 S. 리1 과 토냐 J. 웹1
1 미생물학 및 면역학학과, 메릴랜드 의과 대학 및 말린과 스튜어트 그린바움 종합 암 센터, 볼티모어, 메릴랜드 21201
면역히스토화학(IHC) 및 면역세포화학(ICC)은 항체를 이용한 특정 항원들의 발현 및 국소화를 시각화하는 데 사용되는 기술이다. IHC의 첫번째 간행된 사용은 알버트 쿤스가 Pneumococcus에 감염된 마우스에서 조직 단면도에 있는 폐렴구균 항원의 존재를 구상하기 위하여 기술을 이용한 1941년에 이었습니다 (1). 이름, 면역 조직 화학, IHC에 사용되는 조직 섹션을 참조하여 항체 및 “히스토-“를 참조하여 뿌리 “면역-“에서 유래된다. 면역 세포화학의 뿌리 “사이토-“는 ICC와 IHC 의 주요 차이점을 강조합니다. IHC는 전체 조직의 섹션을 사용하는 반면, ICC는 조직에서 분리되거나 배양에서 자란 세포를 사용합니다. 사용된 샘플의 차이는 샘플 준비가 기술적으로 IHC와 ICC 간에 다르다는 것을 의미하지만, 그렇지 않으면 ICC와 IHC의 프로토콜은 동일하며 용어가 자주 상호 교환적으로 사용되는 것을 발견할 것입니다.
IHC와 ICC 모두에서, 각각 과산화제 또는 로다민과 같은 화학적 또는 형광 태그를 가진 항체는, 항원에 태그된 항체의 특정 결합을 통해 관심있는 어떤 항원든물의 분포를 시각화하기 위하여 이용된다. IHC의 경우, 조직의 얇은 조각은 염색되기 전에 조직의 구조를 유지하기 위해 슬라이드에 고정되어 전체 조직의 맥락에서 항원의 시각화를 허용한다(도 1). ICC의 경우, 세포는 염색되기 전에 슬라이드에 고르게 분포되어 개별 세포 내에서 항원 분포의 시각화를 허용하지만 특정 조직의 구조 내에는 허용되지 않습니다. 두 프로토콜 간의 유사성으로 인해 이 프로토콜은 IHC에 중점을 두어 IHC와 관련된 샘플 준비의 추가 복잡성을 해결합니다.
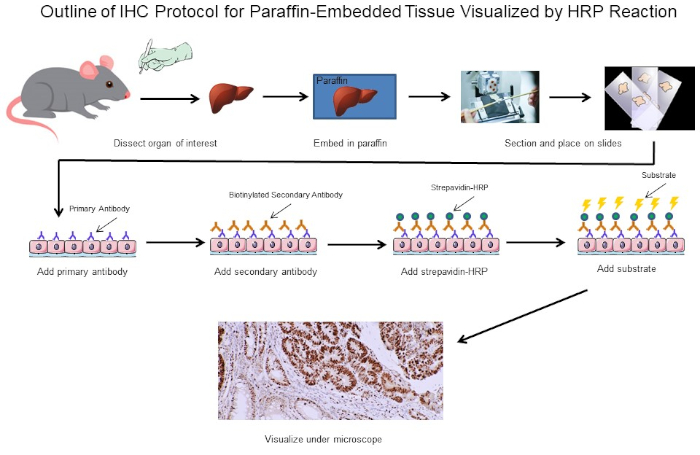
그림 1: IHC 프로토콜의 개요입니다. 마우스에서 해부된 파라핀 임베디드 조직을 위한 IHC 프로토콜의 시각적 윤곽선입니다. 이 프로토콜은 생체 분해된 이차 항체 및 스트레파비딘-HRP를 사용하여 항체 결합의 위치를 시각화합니다. 형광 태그 항체와 같은 다른 옵션도 가능합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
IHC를 수행할 때 첫 번째 주요 결정은 염색 과정 전반에 걸쳐 조직의 구조를 유지하기 위해 조직 섹션을 준비하는 방법입니다. 두 가지 주요 선택은 파라핀 임베디드 조직의 포르말린 고정 섹션 또는 냉동 조직의 신선한 부분입니다. 어떤 다운스트림 분석이 수행될지에 따라 사용할 방법에 대한 간단한 대답은 없습니다. 파라핀 임베디드 조직의 포르말린 고정은 일반적으로 IHC 외부의 후속 분석약에 대한 단백질 기능을 보존할 수 있는 신선한 조직을 동결하는 동안 최적의 이미징을 위한 조직 형태를 더 잘 보존하는 것으로 생각됩니다. 또한, 신선한 냉동 조직 섹션은 유전자 발현 분석(2)에 더 적합한 것으로 나타났다. 세 번째 고려 사항은 관심있는 항원용 항체가 고정 또는 냉동 조직 섹션에 적합한지 여부이며, 일부 항체는 특정 유형의 단면에만 최적화되어 있고 다른 사람을 위해 작동하지 않을 수 있기 때문에. 마지막으로, 신선한 냉동 샘플을 -80°C로 유지해야 하고 고정 된 섹션이 실온에서 훨씬 더 오래 보관 할 수 있지만 1 년 이상 지속되지 않을 수 있기 때문에 조직 섹션을 저장하는 데 얼마나 걸리는지 결정해야합니다. 이들은 파라핀 임베디드 조직의 포르말린 고정 섹션 또는 냉동 조직의 신선한 부분을 사용할지 여부를 결정하기위한 주요 고려 사항 중 일부입니다. 궁극적으로, 하나는 충분 한 조직이 있는 경우, 그것은 단지 둘 다의 일부를 가지고 하는 것이 가장 좋을 수 있습니다.
본 실험에서, 우리는 림프종 발달의 자발적인 마우스 모델에서 확대된 비장에서 사이클린 D1 발현이 증가했는지 여부를 결정하기 위해 착수했다. 비장 조직 샘플은 림프종을 가지고 있지 않은 야생 형 마우스, 트랜스 제닉 마우스 또는 자발적으로 림프종을 개발한 형질 전환 마우스로부터 먼저 분리되었습니다. 비장 조직 샘플은 파라포름알데히드에 고정되었고, 파라핀에 내장되어, 절제되고, 마우스 항시클린 D1 1차 항체를 이용하여 염색하고, 말 항마우스 이차 항체를 거쳐 3,3-디아미노벤지딘(DAB)을 사용하여 개발하였다. 그 후 해리스 헤마톡슬린 솔루션에 섹션이 반소된 다음 섹션은 20배 배율로 이미지화되었습니다.
시약
파라핀 임베디드 섹션
- 4% 파라포름알데히드 (PFA)
- 에탄올 (무수성 변성, 조직학 등급 100%, 95%, 80%, 75%, 50%). 이중 증류수(ddH2O)를 사용하여 100% 스톡에서 희석할 수 있습니다.
- 자일렌 (동음이의)
- IHC 호환 유리 슬라이드는 조직 섹션이 전체 절차에 걸쳐 부착 된 상태로 유지되도록합니다. IHC 호환 유리 슬라이드는 특수 코팅을 가지고 있으며 여러 소매 업체에서 쉽게 사용할 수 있습니다. ICC를 수행하는 경우 챔버 슬라이드를 사용합니다. 챔버 슬라이드는 세포가 슬라이드에 부착하고 적절한 합류에 도달 할 때까지 챔버에서 세포를 시드하고 인큐베이터에 배치 할 수 있도록, 챔버를 제거하고 염색은 IHC와 같은 방식으로 진행 할 수 있습니다.
- 파라핀
- 과산화수소 0.3% (H 2 O2)/메탄올:준비하려면 1mL 30% H2O2 ~ 99mL 메탄올을 추가합니다. -20°C에 보관
- 항원 검색 버퍼: IHC 구연산 버퍼 pH 6.0
신선한 냉동 섹션
- 최적의 절삭 온도(10월) 포함 화합물
- 최적의 고정: -20°C로 냉각된 PFA 또는 아세톤 4%
얼룩
- 버퍼 차단: 사용자가 결정해야 합니다. 한 가지 예는 1X PBS로 희석된 말 혈청입니다.
- 희석 된 1 차 항체 : 제조 업체 사양 참조
- 희석 된 바이오티니드 이차 항체 : 제조업체 사양 참조
- 희석 된 아비딘 – 고추냉이 Peroxidase (HRP): 과산화제 시각화에 대해서만. 제조업체 사양을 참조하십시오.
- DAB 또는 다른 호환 기판
- 카운터스테인(선택 사항)
- 에탄올 (무수성 변성, 조직학 등급 100% 및 95%)
- 자일렌 (동음이의)
- 오가노/리모네 산
Procedure
Results
IHC and ICC have a vast range of applications. For example, one use of IHC is to examine the expression of oncogenes in spontaneous mouse models of tumor development. In Figure 2, we set out to determine if cyclin D1 expression was increased in enlarged spleens in a spontaneous mouse model of lymphoma development. Splenic tissue samples were fixed in paraformaldehyde, embedded in paraffin, sectioned, stained using an anti-cyclin D1 antibody (diluted 1:200 in blocking buffer), and then the sections were imaged at 20X magnification. Cyclin D1 expressing cells are indicated by the reddish-brown color against the blue tissue background. These results suggest that cyclin D1 expression was increased in enlarged spleens, indicating a correlation between cancer development and cyclin D1 expression in this model.
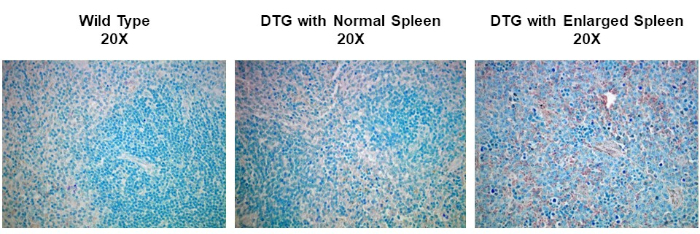
Figure 2: Splenic Cyclin D1 Expression in a Spontaneous Double Transgenic (DTG) Mouse Model of Lymphoma. An image of splenic tissue stained with an anti-Cyclin D1 primary antibody, counterstained with methyl green, and visualized using a biotinylated secondary antibody and ABC reagent activated with DAB substrate. The reddish-brown color represents locations where the antibody has bound indicating the presence of Cyclin D1 expressing tumor cells within the structure of splenic tissue that has been counterstained blue. Please click here to view a larger version of this figure.
Applications and Summary
Immunohistochemistry (IHC) and immunocytochemistry (ICC) are techniques used to visualize the expression and localization of specific antigens using antibodies. Tissues are first cut into thin sections that maintain the tissue morphology and placed on a slide. The antibodies are then added and will bind the antigen of interest and are equipped with a specific tag that allows them to be visualized under a microscope. Thus, through this basic concept, the distribution of antigens in the context of tissue structure can be visualized and studied. However, while the overarching concept is basic, there are multiple different approaches and variations that have been developed that increase both the complexity and usefulness of these techniques. This paper has covered the basic concept of IHC and ICC, the main decisions that need to be considered when using these techniques, and a detailed step-by-step protocol. The images produced by IHC and ICC are generally the final product and can be published as is to highlight obvious differences in amounts or distribution of staining between different conditions.
References
- Coons, A. H. Creech, H. J., Jones, N. and Berliner, E. The Demonstration of Pneumococcal Antigen in Tissues by the Use of Fluorescent Antibody, The Journal of Immunology, 45 (3), 159-170 (1942).
- Ripoli, F. L., Mohr, A., Hammer, S. C., Willenbrock, S., Hewicker-Trautwein, M., Hennecke, S., Escobar, H. M. and Nolte, I. A comparison of fresh frozen vs. Formalin-fixed, paraffin-embedded specimens of canine mammary tumors via branched-DNA assay. International Journal of Molecular Sciences, 17 (5) (2016).
Transcript
Immunocytochemistry and immunohistochemistry are staining methods for a protein of interest in cultured cells and tissues, respectively. The basic principle of both related techniques involves using specific antibodies tagged with a detection system to identify and visualize the protein and determine its location within the cells and tissues, as well as the relative levels. The process in either experiment begins with sample preparation.
For immunocyctochemistry, which specifically visualizes protein or antigen locations in cells, this involves three steps. The first step is plating, which entails culturing the cells in growth media on a cover slip or slide, typically, in the wells of a culture plate. This is followed by fixation, where a precipitating or crosslinking agent like paraformaldehyde is added to the cells to preserve the structural integrity of the proteins and prevent enzyme activity from degrading them. The last step is permeabilization, which involves adding a detergent to make the cell membranes permeable for the staining.
In the counterpart method, immunohistochemistry, proteins or antigens are visualized in tissues and sample preparation has five steps. First, the whole tissue is subjected to fixation, usually with paraformaldehyde. This is followed by embedding of the tissue in a block of paraffin, and then sectioning of this block using a machine called a microtome to cut the tissue into thin slices which can be placed onto slides. Next, the slides are subjected to deparaffinization, or removal of the paraffin from around the tissue slice. Then, an optional antigen retrieval step can be performed. This can either be done using heat or enzymes to unmask epitopes that were cross-linked during fixation making them available for antibody binding. After the appropriate sample preparation, a target-specific primary antibody is added to the cell or tissue sample. This primary antibody should bind to the protein of interest. Next, a secondary antibody is added, which detects and binds to the primary antibody. This secondary antibody is conjugated to, or can bind to, an enzyme called HRP. When its specific substrate, DAB, is added, HRP converts this to an insoluble, brown precipitate. This brown stain marks the location of the target protein. The slides are also stained with hematoxylin, which labels the nuclei in blue and provides a spatial reference point for determining subcellular localization. After that, mounting media is added to the slide, followed by a cover slip in order to seal and preserve the stained sample. Finally, the slides can be imaged on a light microscope.
In this video, you will observe the sample preparation technique for plated cells and tissue sections, followed by immunostaining of the tissue sections.
First, the cells of interest need to be seated onto coverslips. To do this, working in a tissue culture hood, place individual coverslips into the wells of a 24-well plate. Then, close the sash and turn on the UV light to sterilize the coverslips for at least 15 minutes. Next, turn off the UV light. To lift the cells of interest from a confluent 10-centimeter dish, aspirate the media, wash briefly with PBS, and add trypsin to the cells for 2 minutes. Then, tap the side of the plate to ensure the cells have detached and neutralize the trypsin with media. Next, add 0. 5 mL of the cell suspension into each well, making sure to cover the coverslips. Place the plate into a humidified CO2 incubator and allow the cells to grow at 37 degrees celsius until they are 50-70% confluent.
Once the cells reach the optimal confluency, aspirate the culture medium from each well, and then fix the cells by incubating them in . 5 mL of 4% paraformaldehyde diluted in 1X PBS for 20 minutes at room temperature. After removing the fixative, rinse the cells be adding 1 mL of 1X PBS over each coverslip. Immediately aspirate the PBS, then repeat the rinse 2 more times for a total of 3 washes.
Now, permeablize the cells by adding 0.5 mL of 0.1% Triton X-100 in 1X PBS to each well. Leave the plate at room temperature for 15 minutes. Aspirate off the permeabilization buffer and then rinse the cells by adding 1 mL of 1X PBS into each well. Immediately aspirate off the PBS and repeat the rinse 2 more times for a total of 3 washes. Now that the cells on the coverslips are fixed and permeabilized, proceed to the staining procedure demonstrated for the following immunohistochemistry example with the exception that the incubations should be performed within the wells of the 24-well plate rather than directly on a tissue section slide.
To begin, obtain prepared, formalin-fixed, paraffin-embedded tissue sections. Deparaffinize the slides by placing them into a slide rack and then completely immersing them into 250 mL of 100% xylene. Allow the slides to incubate for 5 minutes in the xylene. Then, remove the slides from the container, wipe them off with a paper towel, and place them into a new xylene bath in a fresh container for a further 5 minutes.
Next, rehydrate the sections in a series of graded ethanol solutions starting with 100% ethanol for 3 minutes. Wipe off the slide rack with a paper towel and transfer the slides to a new container of 100% ethanol for another 3 minutes. Continue this cycle of washing, drying with a paper towel, and transferring the slides to a new bath following the indicated concentrations of ethanol for the specified time. After the final ethanol wash, wipe off the rack with a paper towel and incubate the slides in 100 mL of .3% hydrogen peroxide for 30 minutes at room temperature in order to block any endogenous peroxidase activity. Wash the slides in 250 mL of 1X PBS for 5 minutes. Repeat this wash in a container of fresh 1X PBS for an additional 5 minutes.
Next, perform antigen retrieval by immersing the slides in 250 mL of IHC citrate buffer at pH 6.0 and boiling them for 20 minutes. Then, proceed to the staining protocol.
To begin the staining process for IHC, circle the sections with a hydrophobic pen to identify the minimal area that the buffer needs to cover. Then, use a pipette to place 100 microliters of blocking buffer, which in this experiment is horse serum diluted in 1X PBS, over the section. Incubate the slides for 1 hour at room temperature. Following this, remove the blocking buffer using a pipette.
Next, dilute the primary antibody and blocking buffer at a 1:100 dilution by adding 990 microliters of horse serum diluted in 1X PBS into a 1. 5 mL Eppendorf tube, followed by 10 microliters of the primary antibody. Add 100 microliters of the diluted primary antibody to each section, and incubate the slides for 30 minutes at room temperature. When the timer sounds, drain the primary antibody off each slide, and then wash them in 250 mL of 1X PBS for 5 minutes. Repeat this wash once more using fresh 1X PBS.
While the slides are washing in 1X PBS, dilute the secondary antibody to a 1:200 dilution by adding 995 microliters of blocking buffer to a 1.5 mL tube followed by 5 microliters of the secondary antibody, which in this case is biotinylated horse anti-mouse IGG. Add 100 microliters of the diluted secondary antibody to each section, and then incubate the slides for 30 minutes at room temperature. After 30 minutes, remove the secondary antibody by draining it off the sections, then wash the slides in 250 mL of 1X PBS for 5 minutes. Repeat this wash using fresh 1X PBS.
Now, add 100 microliters of avidin-biotin complex reagent, and incubate the sections in the dark for 30 minutes at room temperature. Next, wash the slides by immersing them in 250 mL of 1X PBS for 5 minutes. Similar to previous wash steps, repeat this wash one more time using fresh 1X PBS. Next, develop the slides by incubating the sections in 100 microliters of DAB for up to 5 minutes. Stop the development by immersing the sections in 250 mL of distilled water for 5 minutes.
Now, slides can be counterstained, if desired. To do this, briefly dip the slides in 250 mL of Harris Hematoxylin Solution. Rinse off the counterstain by washing the slides in 250 mL of distilled water for 5 minutes. Repeat this wash 1 more time using fresh distilled water. Next, dehydrate the sections. To do this, first incubate the slides in 95% ethanol for 5 minutes. Blot the slides on a paper towel, and transfer them to a new container of fresh 95% ethanol for another 5 minutes. Continue the cycle of washing, blotting with a paper towel, and transferring the slides to a new bath, following the indicated solutions for 5 minutes each.
After the final incubation, blot the slides with a paper towel, then add a drop of mounting media, such as Organo-Limonene Mount, to the slides. Now, place a coverslip over the sections, taking care not to trap air bubbles. The slides are now ready to be observed under a microscope for analysis.
To observe the stained sections, use a standard light microscope to visualize the stain, and a digital camera to capture the image. In this particular example of IHC, spleen tissues from wild type and spontaneous, double-transgenic, or DTG mice, are compared for studying Dyclin D1 expression in lymphoma. The tissues were paraffin-embedded, sectioned, and stained with anticyclin D1 antibody, and imaged at 20X magnification. Cyclin D1 expressing cells are indicated by the reddish-brown color against the blue tissue background. Comparing the staining intensities among the images from the various mice, the non-enlarged spleens have relatively low amounts of Cyclin D1 expression irrespective of the mouse genotype. In contrast, the enlarged spleen from the DTG mouse, shows increased reddish-brown staining indicating a correlation between cancer development and Cyclin D1 expression in this mouse model.
