مدفوعة خفيفة الأنزيمية نزع الكربوكسيل
Summary
نحن تصف بروتوكول للجيل المحفزة خفيفة من بيروكسيد الهيدروجين – عامل مساعد للتحولات الأكسدة.
Abstract
إنزيم أكسدة-اختزال تنتمي إلى الانزيمات الصناعية الأكثر تطبيقها. ومع ذلك، فإنها تحتاج الإلكترونات الخارجية التي إمدادات غالبا ما تكون مكلفة وصعبة. إعادة تدوير NADH الجهات المانحة الإلكترون أو NADPH يتطلب استخدام الانزيمات إضافية وركائز فداء. ومن المثير للاهتمام، عدة إنزيم أكسدة-اختزال تقبل بيروكسيد الهيدروجين متبرع الإلكترون. في حين يجري غير مكلفة، وهذا كاشف غالبا ما يقلل من الاستقرار من الإنزيمات. والحل لهذه المشكلة هو الجيل الموقع من العامل المساعد في. على امدادات مستمرة من العامل المساعد في تركيز منخفض يدفع رد الفعل دون المساس الاستقرار الانزيم. توضح هذه الورقة طريقة لضوء المحفز في مجال توليد الموقعي من بيروكسيد الهيدروجين مع مثال كربوكسيل الأحماض الدهنية التي تعتمد على الهيم OleT JE. تم اكتشاف الأحماض الدهنية كربوكسيل OleT JE بسبب قدرتها الفريدة على إنتاج سلسلة طويلة-1-الألكينات من الأحماض الدهنية، والأنزيمية غير معروف حتى الآنرد فعل. وتستخدم على نطاق واسع 1-الألكينات المضافة لصناعة المواد البلاستيكية ومواد التشحيم. وقد تبين OleT JE لقبول الإلكترونات من بيروكسيد الهيدروجين لنزع الكربوكسيل التأكسدي. بينما إضافة الهيدروجين بيروكسيد الأضرار الانزيم والنتائج في العائدات المنخفضة، في جيل الموقع من العامل المساعد تلتف هذه المشكلة. ويبين النظام photobiocatalytic مزايا واضحة بشأن نشاط انزيم والعائد، مما أدى إلى نظام بسيط وفعال لنزع الكربوكسيل الأحماض الدهنية.
Introduction
تغير المناخ واستنزاف المنظور من الموارد المتجددة يشكل تهديدا خطيرا لمجتمعنا. في هذا السياق، يمثل انزيم الحفز إمكانية تزال غير مستغلة بالكامل لتنمية مستدامة و'خضرة' الكيمياء 1. إنزيم أكسدة-اختزال لديها القدرة على تحفيز إدخال وتعديل المجموعات الوظيفية في ظل ظروف ردود الفعل خفيفة وتنتمي إلى البيولوجية الحفازة أهم 2. تتطلب معظم التحولات الأكسدة توريد الخارجية من العوامل المساعدة مثل NAD (P) H. طبقت أساليب لتجديد العامل المساعد في نطاق صناعي. ومع ذلك، فإنها لا تزال تؤدي إلى تكاليف عملية عالية، مما يحد من تطبيقها في معظمها إلى منتجات عالية القيمة. ومن المثير للاهتمام، والعديد من مستخلصات 3،4 وmonooxygenases P450 5 تقبل الإلكترونات من بيروكسيد الهيدروجين عن طريق ما يسمى تحويلة بيروكسيد. بينما H 2 O 2 هي رخيصة المشارك كاشف، فإنه يقال harmfالمجاهدين للعديد من الإنزيمات. وثابت في تشكيل الموقعي تركيزات منخفضة من بيروكسيد الهيدروجين هو نهج عملي لحملة رد الفعل دون أن ينال من الاستقرار التشغيلي للإنزيم.
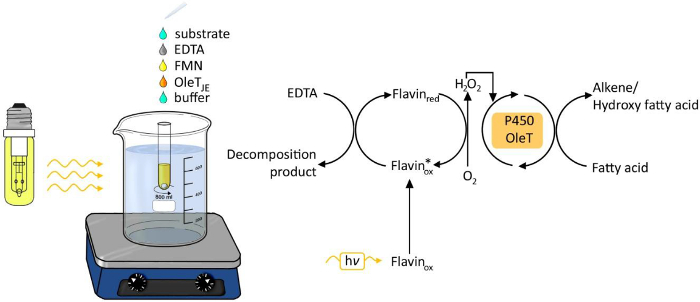
الشكل 1. التجريبية مجموعة المتابعة لنزع الكربوكسيل photobiocatalytic من الأحماض الدهنية التي كتبها OleT JE. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
استخدام الضوء كمصدر للطاقة لعمليات كيميائية وبيولوجية تم باهتمام متزايد في السنوات الأخيرة 6. وقد برز جيل ضوء يحركها من بيروكسيد الهيدروجين باعتباره طريقة سهلة وقوية لتزويد بيروكسيد الهيدروجين لتحولات الأكسدة (الشكل 1). وضوئي مثل فلافين الأدينين مونonucleotide (FMN) يسمح للالحد من الأوكسجين الجزيئي لبيروكسيد الهيدروجين، والتي يتم بعد ذلك استخدام العامل المساعد للتفاعل الإنزيمي oxyfunctionalization. الجهات المانحة الإلكترون الممكنة ثنائي أمين الإيثيلين رباعي حمض الخل (EDTA)، أسكوربات أو formiate غير مكلفة. طريقة قابلة للتطبيق بشكل عام لH 2 O 2 الانزيمات معتمد على، بما في ذلك مستخلصات 3،4 وmonooxygenases P450 5.
لقد حققت مؤخرا تطبيق كربوكسيل البكتيرية رواية (7) لتحويل الدهون الطبيعية في الأوليفينات 8. وهذا سيكون طريقا المستدام لتركيب المواد الكيميائية منصة تستخدم على نطاق واسع من مصدر الحيوي القائم. وكربوكسيل OleT JE من البكتيريا Jeotgalicoccus س إيجابية الجرام. يحفز نزع الكربوكسيل التأكسدي من الأحماض الدهنية ويشكل 1-الألكينات عن المنتجات. يرتبط OleT JE ارتباطا وثيقا monooxygenases P450 البكتيرية ويحتاج الإلكترونات ومدمج بيروكسيد الهيدروجين للتفاعل.
للأسف، أدت إضافة H 2 O 2 إلى حل الركيزة والانزيم في التحويلات منخفضة واستنساخ سوء النتائج، ويفترض بسبب تأثير ضار من بيروكسيد الهيدروجين على استقرار OleT JE. جيل من البروتين الانصهار مع NADPH اختزال RhFred إجراء نزع الكربوكسيل تعتمد على NADPH ممكن. 9 ومع ذلك، فإن ارتفاع أسعار NADPH والإمكانيات المحدودة الحالية لتجديد فعالة من حيث التكلفة دفعنا للتحقيق المانحين الإلكترون أرخص. مستوحاة من تشابه OleT JE مع monooxygenases P450، كنا الجيل المحفزة خفيفة من H 2 O 2. كنا سعداء للحصول على تحويلات عالية (تصل إلى> 95٪) باستخدام مقتطفات خالية من الخلايا أو حلول الانزيم النقاء.
مع المثال من الأحماض الدهنية نزع الكربوكسيل، نقدم بروتوكول عام لانزيمات يحركها الضوءآتيك الأكسدة التحولات باستخدام FMN كما ضوئي والهيدروجين بيروكسيد كما العامل المساعد. وتشمل طرق عرض إنتاج الإنزيم في الخلية المؤتلف من E. القولونية، وتنقية للانزيم، وتطبيق لتركيب 1-الألكينات وتحليل نواتج التفاعل.
Protocol
Representative Results
Discussion
الجيل مدفوعة خفيفة من بيروكسيد الهيدروجين يمكن تطبيقها لتحولات نطاق الأكسدة، بما في ذلك peroxygenases 3، chloroperoxidases 10 و P450 monooxygenases 5. وهو نهج سهل وعملي. وعلى المدى الطويل، واستخدام الضوء المرئي يفتح منظور للاستفادة من أشعة الشمس لمدة التحولات الكيميائية، وهو بديل مستدام لردود الفعل الغنية بالطاقة.
والطريقة تنطبق مع انزيم النقي أو مع استخراج خالية من الخلايا. في حين أن هذا الأخير يتطلب أقل تكلفة والعمل، وتجدر الإشارة إلى أن الجزيئات الصغيرة في استخراج النفط الخام قد تتداخل مع تحويل ضوء المحفز. نهج عملي لإزالة هذه المكونات الصغيرة مع micromembrane (أي عن طريق الطرد المركزي في وحدة تصفية الطرد المركزي أو عن طريق غسيل الكلى). تركيز جزيء ضوء حصاد FMN يحدد تركيز بيروكسيد الهيدروجين. اعتمادا على AFFINIتاي من مؤكسدة مختزلة، وهذا التركيز هو الحاسم في النشاط الأنزيمي. عامل آخر مهم هو تركيز الذبيحه EDTA المانحة الإلكترون. المعلمة الأكثر أهمية، ومع ذلك، هو الاستقرار التشغيلي ونشاط الإنزيم.
وolefinization من الأحماض الدهنية غير رد فعل أنيقة لتحويل الأحماض الدهنية الحيوية ومقرها في الأوليفينات التي تنتمي إلى السلع الرئيسية للصناعات الكيماوية. يمكن أن يتم biocatalytic نزع الكربوكسيل يحركها الضوء في درجة حرارة الغرفة وفي محايد الرقم الهيدروجيني، والذي يوفر مزايا واضحة من حيث الاستدامة.
وتشير النتائج التي توصلنا إليها في الجيل الموقعي من بيروكسيد الهيدروجين هو استراتيجية لتزويد العامل المساعد دون المساس الاستقرار الإنزيم، مما أدى إلى تحويل عالية. الأساليب الحالية لتجديد العامل المساعد استخدام المنتجات الزراعية أو المواد الكيميائية القائمة على البنزين. ردود الفعل يقودها ضوء آخذة في الظهور كبديل المتجددة. مستقبلسيخصص الأبحاث إلى طرق لإحلال EDTA كاشف الأضاحي من قبل جزيئات أرخص ولتقليل كمية من جزيء FMN ضوء حصاد.
Disclosures
The authors have nothing to disclose.
Acknowledgements
R.K. and F.H. are grateful for the EU-commision for financial support within the Marie-Sklodowska ITN Biocascades (Nr. 634200).
Materials
| Chemicals | |||
| Ampicillin | Sigma Aldrich | 69-52-3 | |
| Bradford reagent | Roth | K015.1 | |
| BSA | Sigma Aldrich | 90604-29-8 | |
| DMSO | Sigma Aldrich | 67-68-5 | |
| Ethyl acetate | Fisher Chemical | 141-78-6 | |
| Ethylenediaminetetraacetic acid (EDTA) | Roth | 8043.1 | |
| Riboflavin 5-monophosphate sodium salt hydrate | Sigma Aldrich | 130-40-5 | |
| Hydrochlorid acid 37% | Sigma Aldrich | 7647-01-0 | |
| Hydrogen peroxide 30% | Sigma Aldrich | 7722-84-1 | |
| δ-Amino levulinic acid | Sigma Aldrich | 5451-09-2 | |
| N-Methyl-N-(Trimethylsilyl)trifluoro acetamide (MSTFA) | Sigma Aldrich | 24589-78-4 | |
| Myristic acid >99% | Sigma Aldrich | 208-875-2 | |
| Imidazole | Sigma Aldrich | 288-32-4 | |
| Sodium chloride | Fisher Chemical | 7647-14-5 | |
| Stearic acid >99% | Sigma Aldrich | 57-11-4 | |
| Tetracycline | Sigma Aldrich | 60-54-8 | |
| Tergitol | Sigma Aldrich | MFCD01779855 | |
| Tris(hydroxymethyl)-aminomethan | Sigma Aldrich | 77-86-1 | |
| Name | Company | Catalog Number | Comments |
| Device | |||
| Incubator shaker | G-25CK | New Brunswick Scientific | |
| Ecotron | Infors HT | ||
| Centrifugation | Labofuge 400R | Heraeus | |
| RC 5B Plus | Sorvall | ||
| Fresco 17 | Thermo Scientific | ||
| Centrifugation rotors | SS34 | Sorvall | |
| SLA | Sorvall | ||
| Clean bench | Envirco | Ceag Schirp Reinraum technik | |
| Column GC-FID | CP-Sil 5CB (30 m x 0.25 mmx 0.25 µm) | Agilent Technologies | |
| Column GC-MS | FactorFour Capillary Coloumn (VF-5 ms + 5 m EZ Guard) | Varian | |
| GC-FID | GC-2010 plus | Shimadzu | |
| GC-MS | IST-40 | Varian | |
| Magnetic stirrer | RCT classic | IKA | |
| pH meter | SevenEasy | Mettler toledo | |
| Sonicator | Branson Sonifier 250 | Branson | |
| Spectral photometer | FLUOstar Omega | BMG Labtech | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Affinity chromatography column | His Pur Ni-NTA spin column | Thermo Scientific | |
| Centricon | Vivaspin turbo 15 | VWR International | |
| Microtiter plates | 96 Well Multiply®PCR Plates | Sarstedt |
References
- Kourist, R., Domìnguez de Marìa, P., Miyamoto, K. Biocatalytic strategies for the asymmetric synthesis of profens – recent trends and developments. Green Chem. , 2607-2618 (2011).
- Holtmann, D., Fraaije, M. W., Arends, I. W., Opperman, D. J., Hollmann, F. The taming of oxygen: biocatalytic oxyfunctionalisations. Chemical Comm. 50, 13180-13200 (2014).
- Churakova, E., et al. Specific photobiocatalytic oxyfunctionalization reactions. Ang. Chem. In. Ed. 123, 10904-10907 (2011).
- Hollmann, F., Arends, I., Buehler, K. Biocatalytic Redox Reactions for Organic Synthesis: Nonconventional Regeneration Methods. ChemCatChem. 2, 762-782 (2010).
- Girhard, M., Kunigk, E., Tihovsky, S., Shumyantseva, V. V., Urlacher, V. B. Light-driven biocatalysis with cytochrome P450 peroxygenases. Biotechnol. Appl. Biochem. 60, 111-118 (2013).
- Bartsch, M., et al. Photosynthetic production of enantioselective biocatalysts. Microb. Cell. Fact. 14, 53 (2015).
- Rude, M. A., et al. Terminal olefin (1-alkene) biosynthesis by a novel P450 fatty acid decarboxylase from Jeotgalicoccus species. Appl. Environ. Microbiol. 77, 1718-1727 (2011).
- Zachos, I., et al. Photobiocatalytic decarboxylation for olefin synthesis. Chem. Comm. 51, 1918-1921 (2015).
- Liu, Y., et al. Hydrogen peroxide-independent production of α-alkenes by OleTJE P450 fatty acid decarboxylase. Biotechnol. Biofuels. 7, 28 (2014).
- Perez, D. I., Grau, M. M., Arends, I. W., Hollmann, F. Visible light-driven and chloroperoxidase-catalyzed oxygenation reactions. Chem. Comm. 40 (44), 6848-6850 (2009).

