אור מונחה אנזימתי Decarboxylation
Summary
אנו מתארים פרוטוקול עבור דור האור היה זרז של מי חמצן – גורם-שותף עבור טרנספורמציות חמצונים.
Abstract
Oxidoreductases שייך האנזימים התעשייתיים ביותר להחיל. אף על פי כן, הם צריכים אלקטרונים חיצוניים אשר מספק בדרך כלל יקר ומאתגר. מחזור של NADH תורם אלקטרונים או NADPH מחייב השימוש של אנזימים נוספים מצעי הקרבה. מעניין, כמה oxidoreductases לקבל חמצן כתורם אלקטרונים. בעת היותו זול, מגיב זה לעתים קרובות מקטין את היציבות של אנזימים. פתרון לבעיה זו הוא הדור באתרו של הפקטור. האספקה הרציפה של הפקטור בריכוז נמוך שמניעה את התגובה מבלי לפגוע ביציבות אנזים. מסמך זה מדגים שיטה לייצור האור-catalyzed באתרו של מי חמצן עם הדוגמא של decarboxylase חומצת שומן תלוי heme OleT י"א. Decarboxylase חומצות שומן OleT JE התגלה בשל היכולת הייחודית שלנו להפיק 1-אלקנים ארוכי שרשרת מחומצות שומן, אנזימטי עד כה לא ידועתְגוּבָה. 1-אלקנים משמשים תוספים נרחבים plasticizers וחומרי סיכה. OleT JE הוכח לקבל אלקטרונים מן מי חמצן עבור decarboxylation חמצוני. בעוד תוספת של נזקים מי חמצן האנזים וכתוצאה מכך תשואות נמוכות, בדור באתרו של פקטור עוקף את הבעיה הזאת. מערכת photobiocatalytic תערוכות יתרונות ברורים לגבי פעילות אנזים ואת התשואה, וכתוצאה מכך מערכת פשוטה ויעילה עבור decarboxylation חומצות שומן.
Introduction
השינוי באקלים ואת הדלדול הנראה לעין של משאבים מתחדשים מהווים איום רציני על החברה שלנו. בהקשר זה, קטליזה אנזים מייצג פוטנציאל עדיין לא מנוצל במלואו לפיתוח בר קיימא "ירוקה" כימית 1. Oxidoreductases יש את היכולת לזרז את כניסתה ושינוי של קבוצות פונקציונליות בתנאי תגובות עדינים שייכים biocatalysts החשוב ביותר 2. רוב טרנספורמציות החיזור דורשות האספקה החיצונית של קו-פקטורים כגון NAD (P) H. שיטות התחדשות פקטור יושמו בקנה מידה תעשייתי. עם זאת, הם עדיין לגרום עלויות גבוהות תהליך, אשר מגבילות את בקשתם בעיקר למוצרים בעלי ערך גבוה. מעניין, כמה peroxidases 3,4 ו monooxygenases P450 5 לקבל אלקטרונים מן מי חמצן דרך המחלף מי שנקרא. בעוד H 2 O 2 הוא שיתוף מגיב זול, זה הוא מדווח harmful עבור אנזימים רבים. יציב במבנה באתרו ריכוזים נמוכים של של מי חמצן הוא גישה מעשית לנהוג התגובה מבלי לפגוע היציבות התפעולית של אנזים.
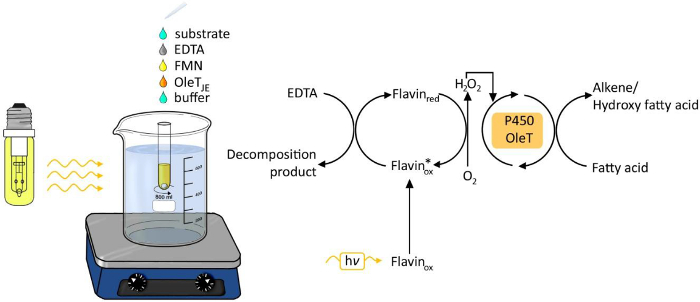
איור 1. ניסיוני הגדרה של decarboxylation photobiocatalytic חומצות שומן על ידי OleT JE. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
השימוש באור כמקור אנרגיה עבור תהליכים כימיים וביולוגיים כבר מושך תשומת לב גוברת בשנים האחרונות 6. אור מונחה הדור של מי חמצן התפתח שיטה קלה חזקה כדי לספק חמצן עבור טרנספורמציות חיזור (איור 1). Photocatalyst כגון פלבין אדנין mononucleotide (FMN) מאפשרת הסרה של חמצן מולקולרי למי חמצן, אשר לאחר מכן משמש פקטור עבור התגובה oxyfunctionalization האנזימטית. תורם אלקטרונים אפשריים הם חומצת ethylenediaminetetraacetic (EDTA), ascorbate או formiate הזול. השיטה ישימה בדרך כלל H 2 O 2 אנזימים תלויים, כולל peroxidases 3,4 ו P450 monooxygenases 5.
חקרנו לאחרונה היישום של decarboxylase חיידקי הרומן 7 עבור הטרנספורמציה של שומנים טבעיים לתוך אולפינים 8. זה יהיה מסלול קיימא לסינתזה של כימיקלי פלטפורמה בשימוש נרחב ממקור ביו מבוסס. Decarboxylase OleT JE מן sp Jeotgalicoccus חיידק חיובי גרם. מזרז את חמצוני decarboxylation של חומצות שומן ויוצר 1-אלקנים כמוצרים. OleT JE קשורה קשר הדוק monooxygenases P450 חיידקים ועליו אלקטרוני from מי חמצן עבור התגובה.
למרבה הצער, תוספת של H 2 O 2 פתרון של מצע אנזים שהסתיימה בהמרות נמוכות שחזור עניים של התוצאות, ככל הנראה עקב השפעה מזיקה של מי חמצן על יציבות OleT י"א. דור של חלבון היתוך עם רדוקטאז NADPH RhFred עשה NADPH התלוי decarboxylation אפשרי. 9 עם זאת, המחיר הגבוה של NADPH והאפשרויות המוגבלות עבור התחדשות וחסכונית מתבקשים לנו לחקור תורמי אלקטרונים זולים. בהשראת הדמיון של OleT JE עם monooxygenases P450, השתמשנו דור אור היה הזרז של H 2 O 2. שמחנו לקבל המרות גבוהות (עד> 95%) באמצעות תמציות תא חינם או פתרונות אנזים מטוהרים.
עם הדוגמא של decarboxylation חומצות שומן, אנו מציגים פרוטוקול כללי enzym מונחים-אורטרנספורמציות חיזור atic באמצעות FMN כמו מי photocatalyst ומימן כמו-פקטור. השיטות שהוצגו כוללים את הייצור של האנזים בתא רקומביננטי של E. coli, טיהור של האנזים, היישום לסינתזה של 1-אלקנים ועל הניתוח של תוצרי התגובה.
Protocol
Representative Results
Discussion
דור מונחים-האור של מי חמצן יכול להיות מיושם עבור טרנספורמציות חיזור טווח, כולל peroxygenases 3, chloroperoxidases 10 ו P450 monooxygenases 5. זוהי גישה קלה מבחינה מעשית. בטווח הארוך, את השימוש של אור הנראה פותח המבט לנצל את אור שמש טרנספורמציות כימיות, המהווה חלופה בת קיימא לתגובות אנרגיה עשירה.
השיטה ישימה עם אנזים מטוהר או עם תמצית תא ללא. בעוד שהאחרון דורש פחות עלות ועבודה, יש לציין כי מולקולות קטנות בקטע הגולמי עלולות להפריע המרה היה זרז האור. גישה מעשית היא להסיר רכיבים קטנים אלה עם micromembrane (כלומר, על ידי צנטריפוגה ביחידה מסננת צנטריפוגלי או על ידי דיאליזה). ריכוז של המולקולה אור-קציר FMN קובע את הריכוז של מי חמצן. בהתאם affinity של oxidoreductase, ריכוז זה יש משקל מכריע הפעילות האנזימטית. גורם חשוב נוסף הוא הריכוז של EDTA תורם אלקטרון ההקרבה. הפרמטר החשוב ביותר, לעומת זאת, הוא היציבות התפעולית הפעילות של האנזים.
Olefinization של חומצות שומן הוא תגובה אלגנטית עבור ההמרה של חומצות שומן ביו המבוסס לתוך אולפינים ששייכים הסחורות הגדולות לתעשייה הכימית. Decarboxylation biocatalytic מונחה האור יכול להתבצע בטמפרטורת החדר ב- pH נייטרלי, אשר מציעה יתרונות ברורים במונחים של אחריות סביבתית.
התוצאות שלנו מראות כי בדור באתרו של מי חמצן היא אסטרטגיה לספק את הפקטור מבלי לפגוע ביציבות אנזים, אשר מוביל להמרה גבוהה. שיטות הווה להתחדשות פקטור להשתמש במוצרים חקלאיים או כימיקלים מבוססי נפט. אור מונע תגובות הם מתעוררים כמו אלטרנטיבה מתחדשת. עתידמחקר יוקדש שיטות ההחלפה של EDTA מגיב ההקרבה ידי מולקולות זולות כדי להפחית את הכמות של FMN המולקולה-קציר אור.
Disclosures
The authors have nothing to disclose.
Acknowledgements
R.K. and F.H. are grateful for the EU-commision for financial support within the Marie-Sklodowska ITN Biocascades (Nr. 634200).
Materials
| Chemicals | |||
| Ampicillin | Sigma Aldrich | 69-52-3 | |
| Bradford reagent | Roth | K015.1 | |
| BSA | Sigma Aldrich | 90604-29-8 | |
| DMSO | Sigma Aldrich | 67-68-5 | |
| Ethyl acetate | Fisher Chemical | 141-78-6 | |
| Ethylenediaminetetraacetic acid (EDTA) | Roth | 8043.1 | |
| Riboflavin 5-monophosphate sodium salt hydrate | Sigma Aldrich | 130-40-5 | |
| Hydrochlorid acid 37% | Sigma Aldrich | 7647-01-0 | |
| Hydrogen peroxide 30% | Sigma Aldrich | 7722-84-1 | |
| δ-Amino levulinic acid | Sigma Aldrich | 5451-09-2 | |
| N-Methyl-N-(Trimethylsilyl)trifluoro acetamide (MSTFA) | Sigma Aldrich | 24589-78-4 | |
| Myristic acid >99% | Sigma Aldrich | 208-875-2 | |
| Imidazole | Sigma Aldrich | 288-32-4 | |
| Sodium chloride | Fisher Chemical | 7647-14-5 | |
| Stearic acid >99% | Sigma Aldrich | 57-11-4 | |
| Tetracycline | Sigma Aldrich | 60-54-8 | |
| Tergitol | Sigma Aldrich | MFCD01779855 | |
| Tris(hydroxymethyl)-aminomethan | Sigma Aldrich | 77-86-1 | |
| Name | Company | Catalog Number | Comments |
| Device | |||
| Incubator shaker | G-25CK | New Brunswick Scientific | |
| Ecotron | Infors HT | ||
| Centrifugation | Labofuge 400R | Heraeus | |
| RC 5B Plus | Sorvall | ||
| Fresco 17 | Thermo Scientific | ||
| Centrifugation rotors | SS34 | Sorvall | |
| SLA | Sorvall | ||
| Clean bench | Envirco | Ceag Schirp Reinraum technik | |
| Column GC-FID | CP-Sil 5CB (30 m x 0.25 mmx 0.25 µm) | Agilent Technologies | |
| Column GC-MS | FactorFour Capillary Coloumn (VF-5 ms + 5 m EZ Guard) | Varian | |
| GC-FID | GC-2010 plus | Shimadzu | |
| GC-MS | IST-40 | Varian | |
| Magnetic stirrer | RCT classic | IKA | |
| pH meter | SevenEasy | Mettler toledo | |
| Sonicator | Branson Sonifier 250 | Branson | |
| Spectral photometer | FLUOstar Omega | BMG Labtech | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Affinity chromatography column | His Pur Ni-NTA spin column | Thermo Scientific | |
| Centricon | Vivaspin turbo 15 | VWR International | |
| Microtiter plates | 96 Well Multiply®PCR Plates | Sarstedt |
References
- Kourist, R., Domìnguez de Marìa, P., Miyamoto, K. Biocatalytic strategies for the asymmetric synthesis of profens – recent trends and developments. Green Chem. , 2607-2618 (2011).
- Holtmann, D., Fraaije, M. W., Arends, I. W., Opperman, D. J., Hollmann, F. The taming of oxygen: biocatalytic oxyfunctionalisations. Chemical Comm. 50, 13180-13200 (2014).
- Churakova, E., et al. Specific photobiocatalytic oxyfunctionalization reactions. Ang. Chem. In. Ed. 123, 10904-10907 (2011).
- Hollmann, F., Arends, I., Buehler, K. Biocatalytic Redox Reactions for Organic Synthesis: Nonconventional Regeneration Methods. ChemCatChem. 2, 762-782 (2010).
- Girhard, M., Kunigk, E., Tihovsky, S., Shumyantseva, V. V., Urlacher, V. B. Light-driven biocatalysis with cytochrome P450 peroxygenases. Biotechnol. Appl. Biochem. 60, 111-118 (2013).
- Bartsch, M., et al. Photosynthetic production of enantioselective biocatalysts. Microb. Cell. Fact. 14, 53 (2015).
- Rude, M. A., et al. Terminal olefin (1-alkene) biosynthesis by a novel P450 fatty acid decarboxylase from Jeotgalicoccus species. Appl. Environ. Microbiol. 77, 1718-1727 (2011).
- Zachos, I., et al. Photobiocatalytic decarboxylation for olefin synthesis. Chem. Comm. 51, 1918-1921 (2015).
- Liu, Y., et al. Hydrogen peroxide-independent production of α-alkenes by OleTJE P450 fatty acid decarboxylase. Biotechnol. Biofuels. 7, 28 (2014).
- Perez, D. I., Grau, M. M., Arends, I. W., Hollmann, F. Visible light-driven and chloroperoxidase-catalyzed oxygenation reactions. Chem. Comm. 40 (44), 6848-6850 (2009).

