Light-driven Enzymatische Decarboxylatie
Summary
We beschrijven een protocol voor het licht-gekatalyseerde vorming van waterstofperoxide – een cofactor voor oxidatieve transformaties.
Abstract
Oxidoreductases behoren tot de meest toegepaste industriële enzymen. Toch moeten ze externe elektronen waarvan de levering is vaak kostbaar en uitdagend. Recycling van de elektronendonoren NADH of NADPH vereist het gebruik van andere enzymen en substraten offer. Interessant meerdere oxidoreductasen accepteren waterstofperoxide als elektronendonor. Terwijl ze goedkoop, dit reagens verlaagt vaak de stabiliteit van enzymen. Een oplossing voor dit probleem is de in situ vorming van de cofactor. De continue toevoer van de cofactor bij lage concentratie drijft de reactie zonder afbreuk enzymestabiliteit. Dit demonstreert een werkwijze voor het licht-gekatalyseerde in situ productie van waterstofperoxide met het voorbeeld van het heem-afhankelijke vetzuur decarboxylase olet JE. Het vetzuur decarboxylase olet JE ontdekt dankzij de unieke mogelijkheid om lange-keten 1-alkenen uit vetzuren, een ongekende enzymatische producerenreactie. 1-alkenen verspreide additieven voor smeermiddelen en weekmakers. Olet JE is aangetoond dat elektronen van waterstofperoxide aanvaarden de oxidatieve decarboxylering. Terwijl toevoeging van waterstofperoxide schade het enzym en resulteert in lage opbrengsten, in situ vorming van de cofactor omzeilt dit probleem. Het photobiocatalytic systeem toont duidelijke voordelen op het gebied enzymactiviteit en opbrengst, waardoor een eenvoudig en efficiënt systeem voor het vetzuur decarboxylering.
Introduction
De klimaatverandering en de te verwachten uitputting van hernieuwbare bronnen vormt een ernstige bedreiging voor onze samenleving. In deze context, enzym katalyse is een nog niet ten volle benut potentieel voor de ontwikkeling van een duurzame en 'groener' chemie 1. Oxidoreductasen hebben de capaciteit om de invoering en wijziging van functionele groepen onder milde omstandigheden reacties katalyseren en behoren tot de belangrijkste biokatalysatoren 2. Meest redox transformaties vereisen de toevoer van externe co- factoren zoals NAD (P) H. Methoden voor cofactorregeneratiesysteem zijn toegepast op industriële schaal. Echter, ze nog steeds leiden tot hoge proceskosten, die hun verzoek meestal beperkt tot hoogwaardige producten. Interessant verschillende peroxidasen 3,4 en P450 monooxygenases 5 accepteren elektronen van waterstofperoxide via de zogenaamde peroxide shunt. Terwijl H 2 O 2 is een goedkope co-reagens, is naar verluidt harmful voor veel enzymen. Een gestage in situ vorming lage concentraties waterstofperoxide een mogelijke aanpak om de reactie te rijden zonder dat de operationele stabiliteit van het enzym.
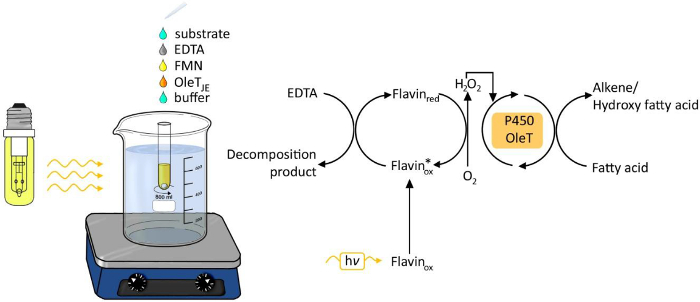
Figuur 1. Experimentele set-up van de photobiocatalytic decarboxylering van vetzuren door olet JE. Klik hier om een grotere versie van deze figuur te bekijken.
De toepassing van licht als energiebron voor chemische en biologische processen is toenemende interesse in de afgelopen jaren 6. Licht gedreven generatie waterstofperoxide ontstaan als een eenvoudige en robuuste methode waterstofperoxide redox transformaties (figuur 1) te leveren. Een fotokatalysator zoals flavine adenine maandagonucleotide (FMN) kan de reductie van moleculaire zuurstof tot waterstofperoxide, dat vervolgens wordt gebruikt als cofactor voor de enzymatische reactie oxyfunctionalization. Mogelijke elektronendonoren zijn ethyleendiaminetetraazijnzuur (EDTA), ascorbaat of goedkope formiaat. De werkwijze is algemeen toepasbaar voor H 2 O 2 afhankelijke enzymen, waaronder peroxidasen 3,4 en P450 monooxygenases 5.
We hebben onlangs onderzocht de toepassing van een nieuwe bacteriële decarboxylase 7 voor de omzetting van natuurlijke vetten tot 8 olefinen. Dit zou een duurzame route voor de synthese van veel gebruikte platform chemische stoffen uit een bio-based bron. De decarboxylase Olet JE van het gram-positieve bacterie Jeotgalicoccus sp. katalyseert de oxidatieve decarboxylering van vetzuren en vormt 1-alkenen als producten. Olet JE is nauw verwant aan bacteriële P450 monooxygenases en dient elektronen from waterstofperoxide voor de reactie.
Helaas, toevoeging van H 2 O 2 aan een oplossing van substraat en enzym resulteerde in lage omzettingen en een slechte reproduceerbaarheid van de resultaten, vermoedelijk als gevolg van een schadelijke werking van waterstofperoxide op de stabiliteit van olet JE. Genereren van een fusie-eiwit met de NADPH-reductase RhFred maakte een NADPH-afhankelijke decarboxylering mogelijk. 9 echter de hoge prijs van NADPH en de huidige beperkte mogelijkheden voor een kostenefficiënte regeneratie bracht ons ertoe goedkopere elektronendonoren onderzoeken. Geïnspireerd door de gelijkenis van Olet JE met P450 monooxygenases, gebruikten we de licht-gekatalyseerde generatie van H 2 O 2. We waren blij om hoge omzettingen te verkrijgen (tot> 95%) met behulp van celvrije extracten of gezuiverde enzym oplossingen.
Met het voorbeeld van vetzuur decarboxylering presenteren we een algemeen protocol voor licht gestuurde enzymatic redox transformaties met behulp van FMN als fotokatalysator en waterstofperoxide als cofactor. De gepresenteerde werkwijzen omvatten de productie van het enzym in recombinante cel van E. coli, zuivering van het enzym, het verzoek voor de synthese van 1-alkenen en de analyse van de reactieproducten.
Protocol
Representative Results
Discussion
De light-driven generatie van waterstofperoxide kan worden toegepast voor een reeks redox transformaties, waaronder peroxygenases 3, chloroperoxidases 10 en P450 monooxygenases 5. Het is een eenvoudig en uitvoerbaar aanpak. Op lange termijn is het gebruik van zichtbaar licht opent het perspectief zonlicht chemische transformaties, die een duurzaam alternatief voor energierijk reacties gebruiken.
De methode is toepasbaar met gezuiverd enzym of met celvrij extract. Terwijl de laatste lagere kosten en werk vereist, moet worden opgemerkt dat kleine moleculen in het ruwe extract kan interfereren met het licht gekatalyseerde omzetting. Een praktisch bruikbare aanpak is om deze kleine onderdelen verwijderen met een micromembraan (dat wil zeggen, door centrifugeren in een centrifugaal filter eenheid of door dialyse). De concentratie van de licht-harvesting molecule FMN bepaalt de concentratie van het waterstofperoxide. Afhankelijk van de Affinity van het oxidoreductase, deze concentratie is bepalend voor de enzymatische activiteit. Een andere belangrijke factor is de concentratie van het te offeren elektronendonor EDTA. De belangrijkste parameter is echter de operationele stabiliteit en activiteit van het enzym.
De olefinization van vetzuren is een elegante reactie voor de omzetting van bio-based vetzuren in alkenen die behoren tot de belangrijkste grondstoffen voor de chemische industrie. Het licht aangedreven biokatalytische decarboxylering kan worden uitgevoerd bij kamertemperatuur en bij een neutrale pH-waarde, die in het gebied van duurzaamheid duidelijke voordelen biedt worden uitgevoerd.
Onze resultaten tonen aan dat in situ vorming van waterstof peroxide is een strategie om de cofactor te leveren zonder afbreuk enzymstabiliteit, wat leidt tot een hoge conversie. Present methoden voor cofactorregeneratiesysteem gebruiken landbouwproducten of benzine gebaseerde chemicaliën. Light-driven reacties zijn in opkomst als duurzame alternatief. Toekomstonderzoek zal worden gewijd aan methoden voor de vervanging van het offer reagens EDTA door goedkopere moleculen en het bedrag van de licht-harvesting molecule FMN verminderen.
Disclosures
The authors have nothing to disclose.
Acknowledgements
R.K. and F.H. are grateful for the EU-commision for financial support within the Marie-Sklodowska ITN Biocascades (Nr. 634200).
Materials
| Chemicals | |||
| Ampicillin | Sigma Aldrich | 69-52-3 | |
| Bradford reagent | Roth | K015.1 | |
| BSA | Sigma Aldrich | 90604-29-8 | |
| DMSO | Sigma Aldrich | 67-68-5 | |
| Ethyl acetate | Fisher Chemical | 141-78-6 | |
| Ethylenediaminetetraacetic acid (EDTA) | Roth | 8043.1 | |
| Riboflavin 5-monophosphate sodium salt hydrate | Sigma Aldrich | 130-40-5 | |
| Hydrochlorid acid 37% | Sigma Aldrich | 7647-01-0 | |
| Hydrogen peroxide 30% | Sigma Aldrich | 7722-84-1 | |
| δ-Amino levulinic acid | Sigma Aldrich | 5451-09-2 | |
| N-Methyl-N-(Trimethylsilyl)trifluoro acetamide (MSTFA) | Sigma Aldrich | 24589-78-4 | |
| Myristic acid >99% | Sigma Aldrich | 208-875-2 | |
| Imidazole | Sigma Aldrich | 288-32-4 | |
| Sodium chloride | Fisher Chemical | 7647-14-5 | |
| Stearic acid >99% | Sigma Aldrich | 57-11-4 | |
| Tetracycline | Sigma Aldrich | 60-54-8 | |
| Tergitol | Sigma Aldrich | MFCD01779855 | |
| Tris(hydroxymethyl)-aminomethan | Sigma Aldrich | 77-86-1 | |
| Name | Company | Catalog Number | Comments |
| Device | |||
| Incubator shaker | G-25CK | New Brunswick Scientific | |
| Ecotron | Infors HT | ||
| Centrifugation | Labofuge 400R | Heraeus | |
| RC 5B Plus | Sorvall | ||
| Fresco 17 | Thermo Scientific | ||
| Centrifugation rotors | SS34 | Sorvall | |
| SLA | Sorvall | ||
| Clean bench | Envirco | Ceag Schirp Reinraum technik | |
| Column GC-FID | CP-Sil 5CB (30 m x 0.25 mmx 0.25 µm) | Agilent Technologies | |
| Column GC-MS | FactorFour Capillary Coloumn (VF-5 ms + 5 m EZ Guard) | Varian | |
| GC-FID | GC-2010 plus | Shimadzu | |
| GC-MS | IST-40 | Varian | |
| Magnetic stirrer | RCT classic | IKA | |
| pH meter | SevenEasy | Mettler toledo | |
| Sonicator | Branson Sonifier 250 | Branson | |
| Spectral photometer | FLUOstar Omega | BMG Labtech | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Affinity chromatography column | His Pur Ni-NTA spin column | Thermo Scientific | |
| Centricon | Vivaspin turbo 15 | VWR International | |
| Microtiter plates | 96 Well Multiply®PCR Plates | Sarstedt |
References
- Kourist, R., Domìnguez de Marìa, P., Miyamoto, K. Biocatalytic strategies for the asymmetric synthesis of profens – recent trends and developments. Green Chem. , 2607-2618 (2011).
- Holtmann, D., Fraaije, M. W., Arends, I. W., Opperman, D. J., Hollmann, F. The taming of oxygen: biocatalytic oxyfunctionalisations. Chemical Comm. 50, 13180-13200 (2014).
- Churakova, E., et al. Specific photobiocatalytic oxyfunctionalization reactions. Ang. Chem. In. Ed. 123, 10904-10907 (2011).
- Hollmann, F., Arends, I., Buehler, K. Biocatalytic Redox Reactions for Organic Synthesis: Nonconventional Regeneration Methods. ChemCatChem. 2, 762-782 (2010).
- Girhard, M., Kunigk, E., Tihovsky, S., Shumyantseva, V. V., Urlacher, V. B. Light-driven biocatalysis with cytochrome P450 peroxygenases. Biotechnol. Appl. Biochem. 60, 111-118 (2013).
- Bartsch, M., et al. Photosynthetic production of enantioselective biocatalysts. Microb. Cell. Fact. 14, 53 (2015).
- Rude, M. A., et al. Terminal olefin (1-alkene) biosynthesis by a novel P450 fatty acid decarboxylase from Jeotgalicoccus species. Appl. Environ. Microbiol. 77, 1718-1727 (2011).
- Zachos, I., et al. Photobiocatalytic decarboxylation for olefin synthesis. Chem. Comm. 51, 1918-1921 (2015).
- Liu, Y., et al. Hydrogen peroxide-independent production of α-alkenes by OleTJE P450 fatty acid decarboxylase. Biotechnol. Biofuels. 7, 28 (2014).
- Perez, D. I., Grau, M. M., Arends, I. W., Hollmann, F. Visible light-driven and chloroperoxidase-catalyzed oxygenation reactions. Chem. Comm. 40 (44), 6848-6850 (2009).

