Summary
Nós descrevemos um protocolo para a geração de luz catalisada de peróxido de hidrogênio – um co-fator para transformações oxidativas.
Abstract
Oxirredutases pertencem às enzimas industriais mais-aplicadas. No entanto, eles precisam de elétrons externos cujo fornecimento é muitas vezes caro e desafiador. Reciclagem do NADH ou NADPH doadores de electrões requer a utilização de outros enzimas e substratos sacrificiais. Curiosamente, vários Oxirredutases aceitar peróxido de hidrogénio como doador de elétrons. Apesar de ser pouco dispendioso, este reagente, muitas vezes reduz a estabilidade das enzimas. Uma solução para este problema é a geração in situ do cofactor. O fornecimento contínuo da co-factor, a baixa concentração conduz a reacção sem prejudicar a estabilidade da enzima. Este trabalho demonstra um método para a luz catalisada por geração in situ de peróxido de hidrogénio com o exemplo da descarboxilase de ácido gordo dependente do heme OLET JE. O descarboxilase do ácido graxo OLET JE foi descoberto devido à sua capacidade única de produzir de cadeia longa 1-alcenos de ácidos graxos, uma enzimática até então desconhecidoreação. 1-alcenos são aditivos amplamente utilizado para plastificantes e lubrificantes. OLET JE foi mostrado para aceitar electrões a partir de peróxido de hidrogénio para a descarboxilação oxidativa. Embora a adição de peróxido de hidrogênio danos a enzima e resulta em rendimentos baixos, a geração in situ do cofator contorna este problema. O sistema photobiocatalytic mostra vantagens claras sobre a actividade da enzima e o rendimento, o que resulta em um sistema simples e eficiente para a descarboxilação de ácido gordo.
Introduction
A mudança climática eo esgotamento previsível dos recursos renováveis constitui uma ameaça grave para a nossa sociedade. Neste contexto, catálise enzimática representa um potencial ainda não plenamente exploradas para o desenvolvimento de sustentável e mais "verde" química 1. Oxidorredutases tem a capacidade de catalisar a introdução e a modificação de grupos funcionais sob condições de reacção suaves e pertencem às mais importantes biocatalisadores 2. A maioria das transformações redox requer o fornecimento de externa de co-factores, tais como o NAD (P) H. Métodos para a regeneração do cofactor foram aplicadas em escala industrial. No entanto, eles ainda resultar em elevados custos de processo, o que limita a sua aplicação principalmente para produtos de alto valor. Curiosamente, várias peroxidases 3,4 e P450 monooxigenases 5 aceitar electrões a partir de peróxido de hidrogénio por meio do assim chamado peróxido de derivação. Enquanto H 2 O 2 é um co-reagente mais barato, que é declaradamente inseUL para muitas enzimas. A constante formação in situ de baixas concentrações de peróxido de hidrogénio é uma abordagem viável para conduzir a reacção, sem prejudicar a estabilidade operacional da enzima.
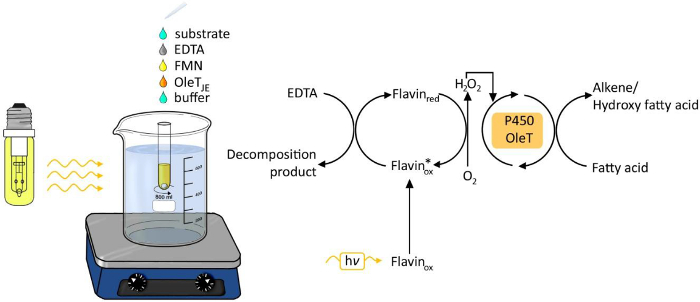
Figura 1. Experimental set-up do decarboxylation photobiocatalytic de ácidos graxos por OLET JE. Por favor clique aqui para ver uma versão maior desta figura.
O uso da luz como fonte de energia para processos químicos e biológicos tem vindo a receber cada vez mais atenção nos últimos anos 6. Geração de luz dirigido de peróxido de hidrogénio tem surgido como um método fácil e robusto para fornecer peróxido de hidrogénio para transformações redox (Figura 1). Um fotocatalisador tais como flavina adenina seg.onucleotide (FMN) permite a redução de oxigénio molecular em peróxido de hidrogénio, o qual é então utilizado como co-factor para a reacção enzimática oxyfunctionalization. Os doadores de electrões possíveis são o ácido etilenodiaminotetracético (EDTA), ácido ascórbico ou o formiato de baixo custo. O método é geralmente aplicável para a H 2 O 2 enzimas dependentes, incluindo as peroxidases 3,4 e P450 monooxigenases 5.
Nós temos investigado recentemente a aplicação de um novo descarboxilase bacteriana 7 para a transformação de gorduras naturais em olefinas 8. Esta seria uma rota sustentável para a síntese de produtos químicos de plataformas amplamente utilizado a partir de uma fonte de base biológica. O descarboxilase OLET JE a partir da bactéria Jeotgalicoccus sp gram-positiva. catalisa a descarboxilação oxidativa de ácidos gordos e forma 1-alcenos como produtos. OLET JE está intimamente relacionado com monooxigenases P450 bacterianas e precisa de elétrons fperóxido de hidrogénio ROM para a reacção.
Infelizmente, a adição de H 2 O 2 a uma solução de substrato e enzima resultou em conversões baixas e uma fraca reprodutibilidade dos resultados, presumivelmente devido a um efeito prejudicial de peróxido de hidrogénio sobre a estabilidade do OLET JE. Geração de uma proteína de fusão com a NADPH-reductase RhFred fez uma descarboxilação dependente de NADPH possível. 9 No entanto, o alto preço do NADPH e as actuais possibilidades limitadas de uma regeneração econômica nos levou a investigar doadores de elétrons mais baratos. Inspirado pela semelhança de OLET JE com monooxigenases P450, utilizou-se a geração de luz catalisada de H 2 O 2. Tivemos o prazer de obter altas conversões (até> 95%), utilizando extratos de células livres ou soluções enzimáticas purificadas.
Com o exemplo de descarboxilação de ácidos graxos, apresentamos um protocolo geral para enzym-driven luztransformações redox atic usando FMN como fotocatalisador e peróxido de hidrogênio como co-fator. Os métodos apresentados incluem a produção da enzima recombinante em células de E. coli, a purificação da enzima, a aplicação para a síntese de 1-alcenos e a análise dos produtos de reacção.
Protocol
Representative Results
Discussion
A geração de luz-driven de peróxido de hidrogênio pode ser aplicado para uma gama redox transformações, incluindo peroxygenases 3, chloroperoxidases 10 e P450 monooxigenases 5. É uma abordagem fácil e praticável. No longo prazo, o uso de luz visível abre a perspectiva de se utilizar a luz solar para as transformações químicas, que é uma alternativa sustentável para reacções ricos em energia.
O método é aplicável com enzima purificada ou com extracto isento de células. Enquanto o último requer menos trabalho e de custos, deve notar-se que pequenas moléculas no extracto em bruto pode interferir com a conversão de luz catalisada. Uma abordagem possível é para remover estes componentes pequenos com um microfiltrantes (isto é, por centrifugação numa unidade de filtração centrífuga ou por diálise). A concentração da molécula decolheita FMN determina a concentração do peróxido de hidrogénio. Dependendo da AffiniTy da oxidorredutase, esta concentração é decisiva para a actividade enzimática. Outro factor importante é a concentração do doador de electrões EDTA sacrificial. O parâmetro mais importante, no entanto, é a estabilidade operacional e a actividade da enzima.
O olefinization de ácidos gordos é uma reacção elegante para a conversão dos ácidos gordos bio-baseados em olefinas que pertencem aos principais produtos para a indústria química. A descarboxilação biocatalítica-driven luz pode ser levada a cabo a temperatura ambiente e a um pH neutro, o que oferece vantagens evidentes em termos de sustentabilidade.
Os nossos resultados mostram que a geração in situ de peróxido de hidrogénio é uma estratégia para fornecer o cofactor sem prejudicar a estabilidade da enzima, conduzindo a uma conversão elevada. Os métodos atuais para a regeneração cofator usar produtos agrícolas ou produtos químicos à base de gasolina. reações luz-driven estão surgindo como alternativa renovável. Futuroinvestigação será dedicada a métodos para a substituição do reagente EDTA sacrificial por moléculas mais baratos e para reduzir a quantidade de luz-colheita molécula FMN.
Disclosures
The authors have nothing to disclose.
Acknowledgements
R.K. and F.H. are grateful for the EU-commision for financial support within the Marie-Sklodowska ITN Biocascades (Nr. 634200).
Materials
| Chemicals | |||
| Ampicillin | Sigma Aldrich | 69-52-3 | |
| Bradford reagent | Roth | K015.1 | |
| BSA | Sigma Aldrich | 90604-29-8 | |
| DMSO | Sigma Aldrich | 67-68-5 | |
| Ethyl acetate | Fisher Chemical | 141-78-6 | |
| Ethylenediaminetetraacetic acid (EDTA) | Roth | 8043.1 | |
| Riboflavin 5-monophosphate sodium salt hydrate | Sigma Aldrich | 130-40-5 | |
| Hydrochlorid acid 37% | Sigma Aldrich | 7647-01-0 | |
| Hydrogen peroxide 30% | Sigma Aldrich | 7722-84-1 | |
| δ-Amino levulinic acid | Sigma Aldrich | 5451-09-2 | |
| N-Methyl-N-(Trimethylsilyl)trifluoro acetamide (MSTFA) | Sigma Aldrich | 24589-78-4 | |
| Myristic acid >99% | Sigma Aldrich | 208-875-2 | |
| Imidazole | Sigma Aldrich | 288-32-4 | |
| Sodium chloride | Fisher Chemical | 7647-14-5 | |
| Stearic acid >99% | Sigma Aldrich | 57-11-4 | |
| Tetracycline | Sigma Aldrich | 60-54-8 | |
| Tergitol | Sigma Aldrich | MFCD01779855 | |
| Tris(hydroxymethyl)-aminomethan | Sigma Aldrich | 77-86-1 | |
| Name | Company | Catalog Number | Comments |
| Device | |||
| Incubator shaker | G-25CK | New Brunswick Scientific | |
| Ecotron | Infors HT | ||
| Centrifugation | Labofuge 400R | Heraeus | |
| RC 5B Plus | Sorvall | ||
| Fresco 17 | Thermo Scientific | ||
| Centrifugation rotors | SS34 | Sorvall | |
| SLA | Sorvall | ||
| Clean bench | Envirco | Ceag Schirp Reinraum technik | |
| Column GC-FID | CP-Sil 5CB (30 m x 0.25 mmx 0.25 µm) | Agilent Technologies | |
| Column GC-MS | FactorFour Capillary Coloumn (VF-5 ms + 5 m EZ Guard) | Varian | |
| GC-FID | GC-2010 plus | Shimadzu | |
| GC-MS | IST-40 | Varian | |
| Magnetic stirrer | RCT classic | IKA | |
| pH meter | SevenEasy | Mettler toledo | |
| Sonicator | Branson Sonifier 250 | Branson | |
| Spectral photometer | FLUOstar Omega | BMG Labtech | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Affinity chromatography column | His Pur Ni-NTA spin column | Thermo Scientific | |
| Centricon | Vivaspin turbo 15 | VWR International | |
| Microtiter plates | 96 Well Multiply®PCR Plates | Sarstedt |
References
- Kourist, R., Domìnguez de Marìa, P., Miyamoto, K. Biocatalytic strategies for the asymmetric synthesis of profens – recent trends and developments. Green Chem. , 2607-2618 (2011).
- Holtmann, D., Fraaije, M. W., Arends, I. W., Opperman, D. J., Hollmann, F. The taming of oxygen: biocatalytic oxyfunctionalisations. Chemical Comm. 50, 13180-13200 (2014).
- Churakova, E., et al. Specific photobiocatalytic oxyfunctionalization reactions. Ang. Chem. In. Ed. 123, 10904-10907 (2011).
- Hollmann, F., Arends, I., Buehler, K. Biocatalytic Redox Reactions for Organic Synthesis: Nonconventional Regeneration Methods. ChemCatChem. 2, 762-782 (2010).
- Girhard, M., Kunigk, E., Tihovsky, S., Shumyantseva, V. V., Urlacher, V. B. Light-driven biocatalysis with cytochrome P450 peroxygenases. Biotechnol. Appl. Biochem. 60, 111-118 (2013).
- Bartsch, M., et al. Photosynthetic production of enantioselective biocatalysts. Microb. Cell. Fact. 14, 53 (2015).
- Rude, M. A., et al. Terminal olefin (1-alkene) biosynthesis by a novel P450 fatty acid decarboxylase from Jeotgalicoccus species. Appl. Environ. Microbiol. 77, 1718-1727 (2011).
- Zachos, I., et al. Photobiocatalytic decarboxylation for olefin synthesis. Chem. Comm. 51, 1918-1921 (2015).
- Liu, Y., et al. Hydrogen peroxide-independent production of α-alkenes by OleTJE P450 fatty acid decarboxylase. Biotechnol. Biofuels. 7, 28 (2014).
- Perez, D. I., Grau, M. M., Arends, I. W., Hollmann, F. Visible light-driven and chloroperoxidase-catalyzed oxygenation reactions. Chem. Comm. 40 (44), 6848-6850 (2009).

