Un laser rapide Probing Méthode Facilite la détermination non-invasive et sans contact des feuilles Propriétés thermiques
Summary
A method was developed to determine the specific heat capacity and thermal conductivity of leaf tissue by non-invasive, contact-free near infrared laser probing, which requires less than 1 min per sample.
Abstract
Les plantes peuvent produire des substances précieuses telles que des métabolites secondaires et de protéines recombinantes. La purification de ce dernier à partir de la biomasse végétale peut être rationalisé par traitement thermique (blanchissement). Dispositif de blanchiment peut être conçu plus précisément si les propriétés thermiques des feuilles sont connues en détail, à savoir la capacité de chaleur spécifique et de la conductivité thermique. La mesure de ces propriétés est de temps et de main-d'œuvre, et nécessite généralement des méthodes invasives qui entrent en contact avec l'échantillon directement. Cela peut réduire le rendement du produit et peut être incompatible avec les exigences de confinement, par exemple, dans le cadre de bonnes pratiques de fabrication. Pour répondre à ces questions, une méthode non-invasive, sans contact a été développé qui détermine la capacité thermique spécifique et la conductivité thermique d'une feuille de la plante intacte en une minute environ. Le procédé implique l'application d'une courte impulsion laser d'une longueur et d'une intensité définie à une petite zone de laExtrait de feuilles, ce qui provoque une augmentation de la température qui est mesurée au moyen d'un capteur proche infrarouge. L'augmentation de température est associée à des propriétés connues de la feuille (épaisseur et densité) afin de déterminer la capacité calorifique spécifique. La conductivité thermique est alors calculée en fonction du profil de la baisse de température ultérieure, en rayonnement thermique et le transfert de chaleur par convection en compte. Les calculs associés et les aspects critiques de la manipulation des échantillons sont discutés.
Introduction
Le traitement à grande échelle de matériaux biologiques nécessite souvent des étapes de traitement thermique telles que la pasteurisation. L'équipement pour de tels procédés peuvent être conçus plus précisément si les propriétés thermiques des matériaux biologiques sont bien caractérisés, y compris la capacité de chaleur spécifique (c p, s) et la conductivité thermique (λ). Ces paramètres peuvent être déterminés facilement pour les liquides, les suspensions et les homogénats par calorimétrie 1. Cependant, ces paramètres de mesure dans des échantillons solides peuvent être de main – d'œuvre, et nécessite souvent un contact direct avec l'échantillon ou même sa destruction 2. Par exemple, les techniques photothermiques exigent un contact direct entre l'échantillon et le détecteur 3. De telles limitations sont acceptables au cours de la transformation des aliments, mais sont incompatibles avec les processus fortement réglementés tels que la production de protéines biopharmaceutiques dans les plantes dans le cadre de bonnes pratiques de fabrication 4. jen un tel contexte, répété (par exemple, hebdomadaire) la surveillance des propriétés thermiques peut être nécessaire pendant une période de croissance de sept semaines pour les plantes individuelles comme un outil de contrôle de la qualité. Si un tel contrôle, il faudrait consommer une feuille et pour chaque mesure, il n'y aurait pas laissé la biomasse pour traiter au moment de la récolte.
En outre, en utilisant uniquement des pièces de feuilles à la place causerait blessant à l'usine et augmenter le risque de nécrose ou une infection pathogène, ce qui diminue encore le rendement du procédé. La probabilité d'une infection par un pathogène peut également augmenter si une méthode par contact direct avec l'échantillon serait utilisé, ce qui induit le risque que tout un lot de plantes peuvent être infectés par le contact avec un dispositif de capteur contaminé. Aspects similaires doivent être considérés pour la surveillance des plantes souligne comme la sécheresse, par exemple, dans un contexte écophysiologique. Par exemple, la perte d'eau est souvent suivie par un changement de la biomasse fraîche, ce qui nécessite une tre invasiveatment des plantes visées par l' enquête 5, par exemple, une feuille de dissection. Au lieu de cela, la détermination de la capacité thermique spécifique, qui dépend de la teneur en eau d'un échantillon, d'une manière non invasive comme décrit ici, peut être utilisé comme paramètre de substitution pour l'état d'hydratation des plantes. Dans les deux scénarios (production pharmaceutique et écophysiologie), les contraintes artificielles induites par des techniques de mesure destructrices ou invasives seraient nuisibles car ils peuvent fausser les données expérimentales. Méthodes flash Par conséquent, précédemment rapportés 6 ou le placement d'échantillons entre les plaques d' argent 7 ne sont pas adaptés pour de tels procédés et expériences , soit parce qu'ils nécessitent un contact direct avec l'échantillon ou sont destructrices. Les paramètres c p, s et λ doivent être déterminées afin de concevoir l'équipement de traitement pour une étape de blanchiment qui peut simplifier la purification du produit et de réduire ainsi les coûts de fabrication 8-10. Les deux cp, s et λ peuvent maintenant être déterminées rapidement par sans contact proche infrarouge non-destructif (NIR) laser de sondage d'une manière cohérente et reproductible 11 et cette nouvelle méthode seront expliquées en détail ci – dessous. Les résultats obtenus par cette méthode ont été utilisés avec succès pour simuler le transfert de chaleur dans les feuilles de tabac 12, ce qui permet la conception d' un équipement de traitement approprié et la sélection des paramètres correspondant tel que la température de blanchissement.
La méthode est facile à mettre en place (Figure 1) et comporte deux phases, la mesure et l' analyse, dont chacune comprend deux étapes principales. Dans la phase de mesure, un échantillon de la feuille est d'abord chauffée localement par une courte impulsion laser et la température maximale de l'échantillon est enregistrée. Le profil de température de l'échantillon est ensuite enregistrée pendant une durée de 50 s. Dans la phase d'analyse, les propriétés telles que la densité des feuilles (facilement et précisément déterminées par Measurem pycnométriqueent) sont combinés avec la température maximale de l' échantillon pour calculer c p, s. Dans la deuxième étape, le profil de température de la feuille est utilisée comme entrée pour une équation d'équilibre d'énergie, en prenant la conduction, la convection et le rayonnement en compte, pour le calcul de λ.
Des instructions détaillées étape par étape sont fournies dans la section de protocole, l'expansion sur le contenu de la vidéo qui l'accompagne. Mesures typiques sont ensuite présentés dans la section des résultats. Enfin, les avantages et les limites de la méthode sont mis en évidence dans la section de discussion ainsi que des améliorations potentielles et d'autres applications.
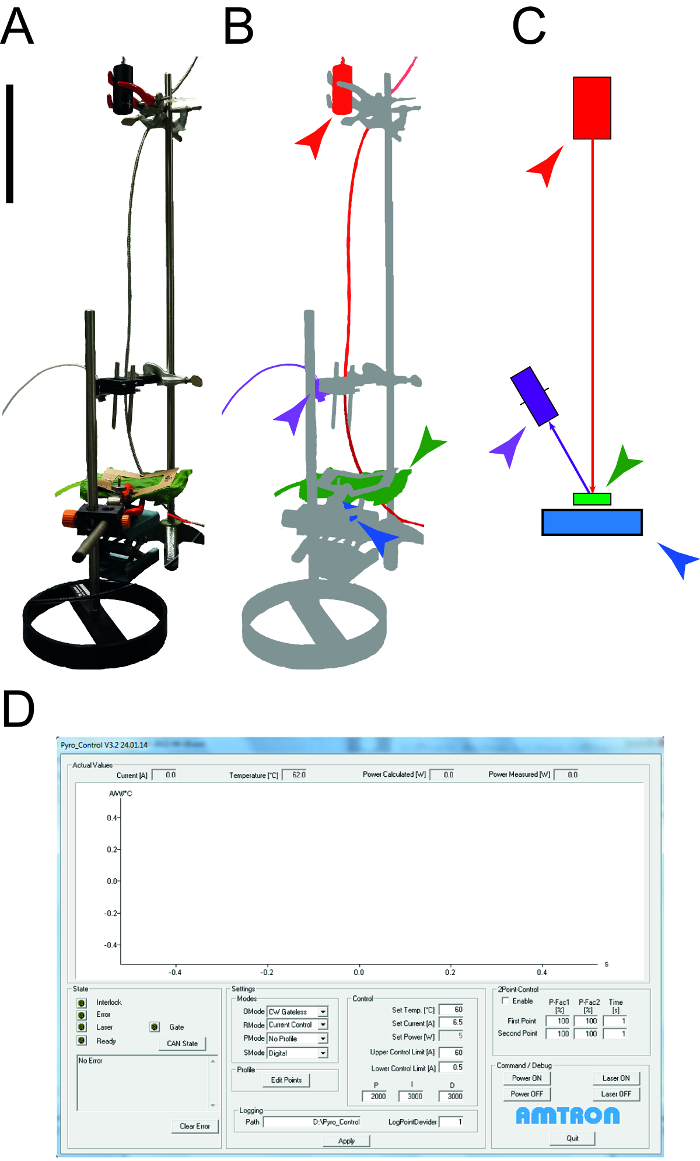
Figure 1: Appareil utilisé pour déterminer les propriétés thermiques des feuilles. A. Photographie de l'appareil de mesure utilisé pour déterminer la capacité de chaleur spécifique et de la conductivité thermique leaves. Les périphériques (ordinateurs, oscilloscope) ne sont pas représentés. B. Représentation schématique de l'appareil de mesure. Le laser et l'équipement connecté sont surlignés en rouge, le détecteur NIR pour la mesure de température est affichée en violet, l'échantillon des feuilles est vert et le capteur de puissance de photodiode est bleu. C. Dessin des éléments de la configuration de mesure avec le même code couleur que dans B. La barre de taille indique 0,1 m. D. Capture d'écran illustrant les éléments typiques du logiciel de contrôle de laser. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Protocol
Representative Results
Discussion
La méthode de mesure non destructive sans contact décrite ci – dessus peut être utilisé pour déterminer c p, s et ʎ d'une manière simultanée et reproductible. Le calcul de ʎ en particulier dépend de plusieurs paramètres qui sont sensibles aux erreurs. Néanmoins, l'effet de ces erreurs est soit linéaire ou sous-proportionnelle, et le coefficient de variation pour tous les paramètres a été trouvée être inférieure à 10%. Même si la méthode peut donc être considérée comme…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
The authors are grateful to Dr. Thomas Rademacher and Ibrahim Al Amedi for cultivating the plants used in this study. We would like to thank Dr. Richard M. Twyman for his assistance with editing the manuscript. This work was in part funded by the European Research Council Advanced Grant “Future-Pharma”, proposal number 269110, the Fraunhofer Zukunftsstiftung (Future Foundation), the Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 1" tube | Thorlabs | SM1L10E | Tube for fiber holder |
| Agarose | Sigma Aldrich | A0701 | Agarose |
| Bi-Convex lense f=25.4 | Thorlabs | LB1761 | Lense |
| Digital Handheld Optical Power and Energy Meter Console | Thorlabs | PM100D | Console for thermal surface absorber sensor |
| Digital Phosphor Oscilloscope | Tektronix | DPO7104 | Oscilloscope |
| DMR light microscope | Leica | n.a. | Light microscope |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-2 | Pycnometer |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Fiber holder | Thorlabs | Fiber holder | |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Infrared Detector Optris CT | Optris | OPTCTLT15 | Infrared detector |
| Infrared Detector Software Compact Connect | Optris | n.a. | Control software for infrared detector |
| Lambda 1050 UV/Vis spectrophotometer | PerkinElmer | L1050 | UV/VIS Spectrophotometer |
| Laser 400μm, 1550nm Conduction Cooled Single Bar Fiber Coupled Module | DILAS | M1F-SS2.1 | Laser |
| Laser cover | Amtron | LM200 | Laser Cover |
| Laser Driver | Amtron | CS 408 | Laser Driver |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Photodiode sensor | Thorlabs | PDA20H-EC | Power sensor for transmission measurements |
| Precision weight Ohaus Analytical Plus | Ohaus | 80251552 | Precision weight |
| Sample frame | Fraunhofer ILT | n.a. | Fixation of the leaf sample |
| Software Pyro Control | Amtron | n.a. | Laser Power Control Software |
| Stainless-steel-holder | n.a. | n.a. | Holder for measurement set-up |
| Teflon plates 2cm | Fraunhofer ILT | n.a. | Teflon attenuation |
| Thermal surface absorber Power sensor | Thorlabs | S314C | Sensor for laser power measurements |
| Vibratome | Leica | 1491200S001 | Vibratome |
| Zoc/Pro 6.51 | EmTec Innovative Software | n.a. | Laser Control Software |
Referenzen
- Wilhelm, E. . Heat Capacities: Liquids, Solutions and Vapours. , 516 (2010).
- Costa, J. M., Grant, O. M., Chaves, M. M. Thermography to explore plant-environment interactions. J. Exp. Bot. 64, 3937-3949 (2013).
- Jayalakshmy, M. S., Philip, J. Thermophysical Properties of Plant Leaves and Their Influence on the Environment Temperature. International Journal of Thermophysics. 31, 2295-2304 (2010).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Schuster, A. C., et al. Effectiveness of cuticular transpiration barriers in a desert plant at controlling water loss at high temperatures. AoB PLANTS. 8, (2016).
- Parker, W. J., Jenkins, R. J., Abbott, G. L., Butler, C. P. Flash Method of Determining Thermal Diffusivity, Heat Capacity, and Thermal Conductivity. J Appl Phys. 32, 1679-1684 (1961).
- Hays, R. L. The thermal conductivity of leaves. Planta. 125, 281-287 (1975).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Hubbuch, J., Fischer, R. Blanching intact leaves or heat precipitation in an agitated vessel or heat exchanger removes host cell proteins from tobacco extracts. J. Vis. Exp. , (2015).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Buyel, J. F., Gruchow, H. M., Tödter, N., Wehner, M. Determination of the thermal properties of leaves by non-invasive contact free laser probing. J. Biotechnol. 217, 100-108 (2016).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Hedlund, H., Johansson, P. Heat capacity of birch determined by calorimetry: implications for the state of water in plants. Thermochim Acta. 349, 79-88 (2000).
- Chandrakanthi, M., Mehrotra, A. K., Hettiaratchi, J. P. A. Thermal conductivity of leaf compost used in biofilters: An experimental and theoretical investigation. Environ. Pollut. 136, 167-174 (2005).
- Larcher, W. . Physiological Plant Ecology: Ecophysiology and Stress Physiology of Functional Groups. , (2003).
- Cowen, R. A gamma-ray burst’s enduring fireball. Science News. 152, 197 (1997).
- Jones, H. G., et al. Thermal infrared imaging of crop canopies for the remote diagnosis and quantification of plant responses to water stress in the field. Funct. Plant Biol. 36, 978-989 (2009).
- Defraeye, T., Verboven, P., Ho, Q. T., Nicolai, B. Convective heat and mass exchange predictions at leaf surfaces: Applications, methods and perspectives. Comput. Electron. Agric. 96, 180-201 (2013).
- Arndt, S. K., Irawan, A., Sanders, G. J. Apoplastic water fraction and rehydration techniques introduce significant errors in measurements of relative water content and osmotic potential in plant leaves. Physiol. Plant. 155, 355-368 (2015).
- Jones, H. G., Schofield, P. Thermal and other remote sensing of plant stress. General and Applied Plant Physiology. 34, 19-32 (2008).
- Jones, H. G., Archer, N., Rotenberg, E., Casa, R. Radiation measurement for plant ecophysiology. J. Exp. Bot. 54, 879-889 (2003).
- Dupont, C., Chiriac, R., Gauthier, G., Toche, F. Heat capacity measurements of various biomass types and pyrolysis residues. Fuel. 115, 644-651 (2014).
- Chaerle, L., et al. Multi-sensor plant imaging: Towards the development of a stress-catalogue. Biotechnol. J. 4, 1152-1167 (2009).
- Hackl, H., Baresel, J. P., Mistele, B., Hu, Y., Schmidhalter, U. A Comparison of Plant Temperatures as Measured by Thermal Imaging and Infrared Thermometry. J. Agron. Crop. Sci. , 415-429 (2012).
- Yuan, L., et al. Spectral analysis of winter wheat leaves for detection and differentiation of diseases and insects. Field Crops Res. 156, 199-207 (2014).

