Un laser Rapid Probing Metodo Facilita la determinazione non invasiva e senza contatto di Leaf Proprietà termiche
Summary
A method was developed to determine the specific heat capacity and thermal conductivity of leaf tissue by non-invasive, contact-free near infrared laser probing, which requires less than 1 min per sample.
Abstract
Le piante possono produrre sostanze preziose come metaboliti secondari e proteine ricombinanti. La purificazione di questo dalla biomassa vegetale può essere semplificato mediante trattamento termico (scottatura). Apparecchiatura scottatura può essere progettato con maggiore precisione se le proprietà termiche delle foglie sono noti in dettaglio, cioè, il calore specifico e la conducibilità termica. La misurazione di queste proprietà è in termini di tempo e manodopera, e di solito richiede metodi invasivi che contattano direttamente il campione. Ciò può ridurre la resa del prodotto e può essere incompatibile con i requisiti di contenimento, ad esempio, nel contesto di buona fabbricazione. Per affrontare questi problemi, un non-invasiva, metodo senza contatto è stato sviluppato che determina la capacità termica specifica e conducibilità termica di un foglio della pianta intatta in circa un minuto. Il metodo prevede l'applicazione di un breve impulso laser di lunghezza e di intensità definito ad una piccola area dellacampioni di foglie, causando un aumento della temperatura che viene misurata utilizzando un sensore infrarosso vicino. L'aumento di temperatura è combinato con note proprietà foglia (spessore e densità) per determinare la capacità termica specifica. La conducibilità termica viene poi calcolato sulla base del profilo del calo di temperatura successiva, prendendo radiazione termica e scambio termico convettivo in considerazione. I calcoli associati e gli aspetti critici della manipolazione del campione sono discussi.
Introduction
La lavorazione su larga scala di materiali biologici spesso richiede fasi di trattamento termico come pastorizzazione. L'attrezzatura per tali processi può essere progettato con maggiore precisione se le proprietà termiche dei materiali biologici sono ben caratterizzati, compresa la capacità di calore specifico (c p, s) e la conducibilità termica (λ). Questi parametri possono essere determinati facilmente per liquidi, sospensioni e omogenati mediante calorimetria 1. Tuttavia, la misurazione di tali parametri in campioni solidi può essere laborioso e spesso richiede il contatto diretto con il campione o addirittura la distruzione 2. Ad esempio, tecniche fototermiche richiedono un contatto diretto tra il campione e rivelatore 3. Tali limitazioni sono accettabili durante la lavorazione, ma sono incompatibili con processi altamente regolati come la produzione di proteine biofarmaceutiche nelle piante nel contesto della pratica buona fabbricazione 4. ion tale contesto, ripetuto (per es, settimanale) il monitoraggio delle proprietà termiche può essere richiesto nel corso di un periodo di crescita di sette settimane per impianti individuali come uno strumento di controllo della qualità. Se un tale monitoraggio richiederebbe e consumare una foglia per ogni misura, non ci sarebbe biomassa sinistra per elaborare al momento del raccolto.
Inoltre, utilizzando solo parti foglia invece causerebbe ferendo alla pianta ed aumentare il rischio di necrosi o infezione patogeno, ancora diminuendo la resa del processo. La probabilità di infezione patogeno può anche aumentare se sarebbe utilizzato un metodo con contatto diretto al campione, inducendo il rischio che un intero lotto di piante possono essere infettati attraverso il contatto con un dispositivo sensore contaminato. Aspetti simili devono essere considerati per il monitoraggio della pianta sottolinea come la siccità, ad esempio, in un contesto ecofisiologica. Ad esempio, la perdita di acqua è spesso controllata da un cambiamento nella biomassa fresca, che richiede un tre invasivaatment degli impianti oggetto di indagine 5, ad esempio, dissezione una foglia. Invece, determinare la capacità termica specifica, che dipende dal contenuto di acqua di un campione, in modo non invasivo come descritto qui, può essere utilizzato come parametro surrogato per lo stato di idratazione delle piante. In entrambi i casi (produzione farmaceutica e ecofisiologia), sollecitazioni artificiali indotti da tecniche di misurazione distruttive o invasive sarebbe deleterio quanto possono falsare i dati sperimentali. Metodi istantanei Pertanto, precedentemente riportati 6 o il posizionamento dei campioni tra le piastre 7 argento sono inadatti per tali processi ed esperimenti perché o richiedono un contatto diretto con il campione o sono distruttive. I parametri c p, s e λ devono essere determinati al fine di progettare apparecchiature di processo per un passo sbollentare in grado di semplificare la purificazione dei prodotti e ridurre i costi di produzione 8-10 così. entrambi cp, s e λ possono ora essere rapidamente determinati da non distruttivo vicino infrarosso (NIR) laser senza contatto sondare in modo coerente e riproducibile 11 e questo nuovo metodo saranno spiegate in dettaglio di seguito. I risultati ottenuti con questo metodo sono stati usati con successo per simulare il trasferimento di calore in foglie di tabacco 12, consentendo la progettazione di apparecchiature per il trattamento appropriato e la selezione dei parametri corrispondenti quali la temperatura scottatura.
Il metodo è facile da configurare (Figura 1) e presenta due fasi, misurazione e analisi, ciascuna delle quali comprende due fasi principali. Nella fase di misurazione, un campione foglia viene prima riscaldato localmente con un breve impulso laser e la temperatura massima campione viene registrato. Il profilo di temperatura del campione viene quindi registrato per una durata di 50 s. Nella fase di analisi, proprietà foglia come densità (facilmente e accuratamente determinate da measurem picnometricoent) sono combinati con la temperatura massima del campione per calcolare c p, s. Nella seconda fase, il profilo di temperatura del foglio è usato come ingresso per un equazione di bilancio energetico, tenendo conduzione, convezione ed irraggiamento in considerazione, per calcolare λ.
Dettagliate istruzioni passo-passo sono forniti nella sezione del protocollo, ampliando il contenuto del video di accompagnamento. Misure tipiche vengono quindi visualizzati nella sezione risultati. Infine, i vantaggi ei limiti del metodo sono evidenziati nella sezione di discussione insieme con i potenziali miglioramenti e ulteriori applicazioni.
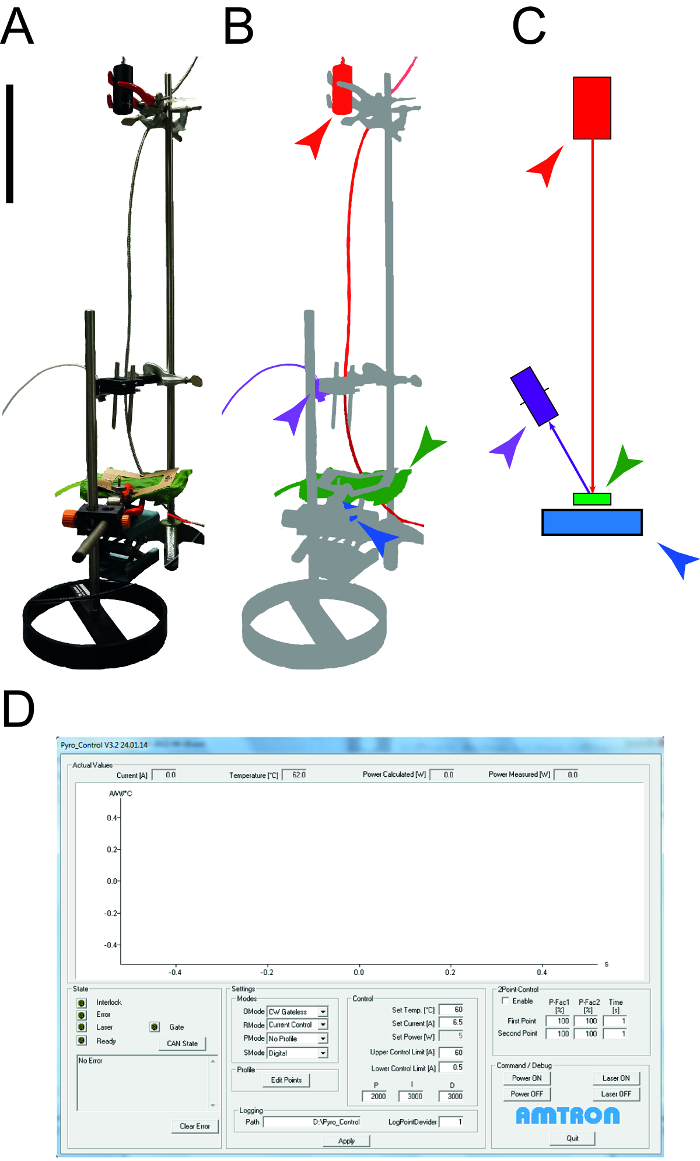
Figura 1: La strumentazione utilizzata per determinare le proprietà termiche del foglio. A. Fotografico dell'apparecchiatura di misurazione utilizzato per determinare il calore specifico e la conduttività termica di leAves. I dispositivi periferici (computer, oscilloscopio) non sono presentati. B. Rappresentazione schematica del dispositivo di misurazione. Il laser e apparecchiature collegate sono evidenziati in rosso, il rivelatore NIR per misurare la temperatura è mostrato in viola, il campione foglia è verde e il sensore di potenza fotodiodo è blu. C. Disegno degli elementi del sistema di misura con lo stesso codice di colore come in B. La barra indica dimensioni 0,1 m. D. Schermata che illustra gli elementi tipici del software di controllo laser. Clicca qui per vedere una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Il metodo di misura non distruttiva senza contatto sopra descritto può essere utilizzato per determinare c p, s e ʎ in modo simultaneo e riproducibile. Il calcolo dei ʎ in particolare dipende da diversi parametri che sono sensibili agli errori. Tuttavia, l'impatto di questi errori era lineare o sub-proporzionale, e il coefficiente di variazione per tutti i parametri è risultato essere inferiore al 10%. Anche se il metodo può quindi essere considerata robusta, alcuni miglioramenti tecnici pos…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
The authors are grateful to Dr. Thomas Rademacher and Ibrahim Al Amedi for cultivating the plants used in this study. We would like to thank Dr. Richard M. Twyman for his assistance with editing the manuscript. This work was in part funded by the European Research Council Advanced Grant “Future-Pharma”, proposal number 269110, the Fraunhofer Zukunftsstiftung (Future Foundation), the Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 1" tube | Thorlabs | SM1L10E | Tube for fiber holder |
| Agarose | Sigma Aldrich | A0701 | Agarose |
| Bi-Convex lense f=25.4 | Thorlabs | LB1761 | Lense |
| Digital Handheld Optical Power and Energy Meter Console | Thorlabs | PM100D | Console for thermal surface absorber sensor |
| Digital Phosphor Oscilloscope | Tektronix | DPO7104 | Oscilloscope |
| DMR light microscope | Leica | n.a. | Light microscope |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-2 | Pycnometer |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Fiber holder | Thorlabs | Fiber holder | |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Infrared Detector Optris CT | Optris | OPTCTLT15 | Infrared detector |
| Infrared Detector Software Compact Connect | Optris | n.a. | Control software for infrared detector |
| Lambda 1050 UV/Vis spectrophotometer | PerkinElmer | L1050 | UV/VIS Spectrophotometer |
| Laser 400μm, 1550nm Conduction Cooled Single Bar Fiber Coupled Module | DILAS | M1F-SS2.1 | Laser |
| Laser cover | Amtron | LM200 | Laser Cover |
| Laser Driver | Amtron | CS 408 | Laser Driver |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Photodiode sensor | Thorlabs | PDA20H-EC | Power sensor for transmission measurements |
| Precision weight Ohaus Analytical Plus | Ohaus | 80251552 | Precision weight |
| Sample frame | Fraunhofer ILT | n.a. | Fixation of the leaf sample |
| Software Pyro Control | Amtron | n.a. | Laser Power Control Software |
| Stainless-steel-holder | n.a. | n.a. | Holder for measurement set-up |
| Teflon plates 2cm | Fraunhofer ILT | n.a. | Teflon attenuation |
| Thermal surface absorber Power sensor | Thorlabs | S314C | Sensor for laser power measurements |
| Vibratome | Leica | 1491200S001 | Vibratome |
| Zoc/Pro 6.51 | EmTec Innovative Software | n.a. | Laser Control Software |
Referenzen
- Wilhelm, E. . Heat Capacities: Liquids, Solutions and Vapours. , 516 (2010).
- Costa, J. M., Grant, O. M., Chaves, M. M. Thermography to explore plant-environment interactions. J. Exp. Bot. 64, 3937-3949 (2013).
- Jayalakshmy, M. S., Philip, J. Thermophysical Properties of Plant Leaves and Their Influence on the Environment Temperature. International Journal of Thermophysics. 31, 2295-2304 (2010).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Schuster, A. C., et al. Effectiveness of cuticular transpiration barriers in a desert plant at controlling water loss at high temperatures. AoB PLANTS. 8, (2016).
- Parker, W. J., Jenkins, R. J., Abbott, G. L., Butler, C. P. Flash Method of Determining Thermal Diffusivity, Heat Capacity, and Thermal Conductivity. J Appl Phys. 32, 1679-1684 (1961).
- Hays, R. L. The thermal conductivity of leaves. Planta. 125, 281-287 (1975).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Hubbuch, J., Fischer, R. Blanching intact leaves or heat precipitation in an agitated vessel or heat exchanger removes host cell proteins from tobacco extracts. J. Vis. Exp. , (2015).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Buyel, J. F., Gruchow, H. M., Tödter, N., Wehner, M. Determination of the thermal properties of leaves by non-invasive contact free laser probing. J. Biotechnol. 217, 100-108 (2016).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Hedlund, H., Johansson, P. Heat capacity of birch determined by calorimetry: implications for the state of water in plants. Thermochim Acta. 349, 79-88 (2000).
- Chandrakanthi, M., Mehrotra, A. K., Hettiaratchi, J. P. A. Thermal conductivity of leaf compost used in biofilters: An experimental and theoretical investigation. Environ. Pollut. 136, 167-174 (2005).
- Larcher, W. . Physiological Plant Ecology: Ecophysiology and Stress Physiology of Functional Groups. , (2003).
- Cowen, R. A gamma-ray burst’s enduring fireball. Science News. 152, 197 (1997).
- Jones, H. G., et al. Thermal infrared imaging of crop canopies for the remote diagnosis and quantification of plant responses to water stress in the field. Funct. Plant Biol. 36, 978-989 (2009).
- Defraeye, T., Verboven, P., Ho, Q. T., Nicolai, B. Convective heat and mass exchange predictions at leaf surfaces: Applications, methods and perspectives. Comput. Electron. Agric. 96, 180-201 (2013).
- Arndt, S. K., Irawan, A., Sanders, G. J. Apoplastic water fraction and rehydration techniques introduce significant errors in measurements of relative water content and osmotic potential in plant leaves. Physiol. Plant. 155, 355-368 (2015).
- Jones, H. G., Schofield, P. Thermal and other remote sensing of plant stress. General and Applied Plant Physiology. 34, 19-32 (2008).
- Jones, H. G., Archer, N., Rotenberg, E., Casa, R. Radiation measurement for plant ecophysiology. J. Exp. Bot. 54, 879-889 (2003).
- Dupont, C., Chiriac, R., Gauthier, G., Toche, F. Heat capacity measurements of various biomass types and pyrolysis residues. Fuel. 115, 644-651 (2014).
- Chaerle, L., et al. Multi-sensor plant imaging: Towards the development of a stress-catalogue. Biotechnol. J. 4, 1152-1167 (2009).
- Hackl, H., Baresel, J. P., Mistele, B., Hu, Y., Schmidhalter, U. A Comparison of Plant Temperatures as Measured by Thermal Imaging and Infrared Thermometry. J. Agron. Crop. Sci. , 415-429 (2012).
- Yuan, L., et al. Spectral analysis of winter wheat leaves for detection and differentiation of diseases and insects. Field Crops Res. 156, 199-207 (2014).

