Bir Rapid Lazer Yöntemi Yaprak Termal Özelliklerinin non-invazif ve İletişim serbest Tayini kolaylaştırır Probing
Summary
A method was developed to determine the specific heat capacity and thermal conductivity of leaf tissue by non-invasive, contact-free near infrared laser probing, which requires less than 1 min per sample.
Abstract
Bitkiler gibi sekonder metabolitler ve rekombinant proteinler gibi değerli maddeler üretebilir. Bitki biyokütleden ikinci arıtma ısıl işlem (beyazlaşma) tarafından modernize edilebilir. Yaprakları termal özellikleri detaylı örneğin, özgül ısı kapasitesi ve ısı iletkenlik bilinen durumunda bir beyazlatma cihazı daha kesin tasarlanabilir. Bu özelliklerin ölçümü, zaman alıcı ve emek yoğundur ve genellikle doğrudan numune ile temas yöntemlere gerek duyar. Bu ürün verimini azaltabilir ve iyi imalat uygulamaları çerçevesinde, örneğin çevreleme gereksinimleri ile uyumsuz olabilir. Bu sorunları gidermek için, bir non-invaziv, temassız yöntem yaklaşık bir dakika içinde özgül ısı kapasitesi ve sağlam bir bitki yaprağının ısı iletkenliği belirler geliştirildi. yöntem, küçük bir alanda tanımlanmış uzunluğu ve bir yoğunluk kısa lazer palsının uygulanmasını içeriryakın kızılötesi sensör kullanılarak ölçüldüğü bir sıcaklık artışına neden yaprak örneği. Sıcaklık artışı, belirli bir ısı kapasitesini belirlemek için, bilinen yaprak özellikleri (kalınlık ve yoğunluğu) ile birleştirilir. ısıl iletkenlik sonra termal radyasyon ve dikkate konvektif ısı transferini alarak, daha sonraki sıcaklık düşüş profiline göre hesaplanır. ilişkili hesaplamalar ve numune işleme kritik yönleri tartışılmıştır.
Introduction
Biyolojik materyalin büyük ölçekli işlemler genellikle pastörizasyon gibi ısı işlemi adımları gerektirir. Biyolojik materyalin termal özellikleri, iyi karakterize edilmiştir bu tür işlemler için donatım özgül ısı kapasitesi (CP, s) ve ısı iletkenliği (λ) de dahil olmak üzere, daha kesin olarak tasarlanabilir. Bu parametreler kalorimetrisi 1 ile sıvılar, süspansiyonlar ve homojenatlar kolayca belirlenebilir. Bununla birlikte, katı numunelerde ölçüm gibi parametreler emek yoğun olabilir ve genellikle numune ya da imha 2 ile doğrudan temas gerektirir. Örneğin, fototermal teknikleri Numune ve dedektör 3 arasında doğrudan teması gerektirmektedir. Bu tür sınırlamalar gıda işlenmesi sırasında kabul edilebilir, ancak bu tür iyi imalat uygulamaları 4 bağlamında bitkilerde biyofarmasötik proteinlerin üretimi gibi son derece ile düzenlenen süreçler ile uyumlu değildir. benn böyle bir bağlam, termal özelliklerinin tekrarlanan (örneğin, haftalık) izleme kalite kontrol aracı olarak bireysel bitkiler için yedi haftalık büyüme döneminde gerekli olabilir. Böyle bir izleme gerektirir ve her ölçüm için bir yaprak tüketmek istiyorsanız, hasat zamanında işlemek için sol hiçbir biyokütle olmazdı.
Ayrıca, bitki yaralama sebep ve tekrar işlem verimi azalan, nekroz ya da patojen enfeksiyon riskini artıracak yerine tek yaprak parçalarını kullanarak. örnek doğrudan temas için bir yöntem kullanılacak olması halinde, patojen enfeksiyonu olasılığı da bitkilerin bütün parti kirlenmiş bir sensör cihazı ile temas yoluyla enfekte olabilir riskini uyarılması, artabilir. Benzer yönleri bitkinin izlenmesi bir ecophysiological bağlamda, örneğin kuraklık gibi vurgular için dikkate alınmalıdır. Örneğin su kaybı sıklıkla invazif tre gerektiren yeni biyokütle bir değişimi ile izlenirBir yaprak diseksiyon gibi soruşturma 5, altında bitkilerin, ait kısmi. Bunun yerine, tarif edildiği üzere non-invazif şekilde, bir numunenin su içeriğine bağlıdır özgül ısı kapasitesi, belirleyici, bitki hidrasyon durumu için bir vekil bir parametre olarak kullanılabilir. Onlar deneysel verileri bozabilir olarak iki senaryo (ilaç üretim ve ekofizyoloji) ise, yıkıcı veya invaziv ölçüm teknikleri ile oluşturulan yapay stresler zararlı olacaktır. Bunlar ya örnek doğrudan temas gerektiren veya tahrip edici nedenle, daha önce rapor flaş yöntemleri 6 ya da gümüş plakalar 7 arasında örneklerin yerleştirilmesi bu işlemler ve deneyler için uygun değildir. Parametreler c p, s ve λ üretim maliyetlerini 8-10 azaltmak ve böylece ürün arınma basitleştirmek ve bir beyazlaşma adım için proses ekipmanları tasarlamak amacıyla tespit edilmelidir. Her iki CıP, S ve λ hemen hızlı bir şekilde tutarlı ve tekrarlanabilir bir şekilde 11 tarama temassız tahribatsız yakın kızıl ötesi (NIR) lazer ile tespit edilebilir ve bu yeni yöntem, aşağıda daha ayrıntılı olarak açıklanacaktır. Tütün uygun işlem ekipman tasarımı ve haşlama sıcaklığı gibi parametrelerin uygun seçimi izin 12 bırakır, bu yöntem ile elde edilen sonuçlar başarılı ısı transferini simüle etmek için kullanıldı.
Yöntem (Şekil 1) kurmak kolaydır ve iki büyük adımlardan oluşur, her biri iki faz, ölçüm ve analiz sahiptir. Ölçüm aşamasında, yaprak numunesi önce yerel kısa lazer darbesi tarafından ısıtılır ve maksimum numune sıcaklık kaydedilir. Numunenin sıcaklığı profili daha sonra 50 sn'lik bir süre için kaydedilmektedir. Analiz aşamasında, yoğunluk gibi yaprak özellikleri (kolayca ve doğru Piknometrik measurem tarafından belirlenirENT), S CP hesaplamak için maksimum örnekleme sıcaklığı ile birleştirilir. İkinci aşamada, yaprak sıcaklık profili l hesaplamak için, dikkate iletim, konveksiyon ve radyasyon alarak, bir enerji dengesi denklemi için girdi olarak kullanılır.
Detaylı adım adım talimatlar beraberindeki video içeriğine genişleyen, protokol bölümünde verilmiştir. Tipik ölçümler daha sonra sonuçlar bölümünde gösterilmiştir. Son olarak, yöntemin yararları ve sınırlılıkları potansiyel iyileştirmeler ve ileri uygulamaları ile birlikte tartışma bölümünde vurgulanır.
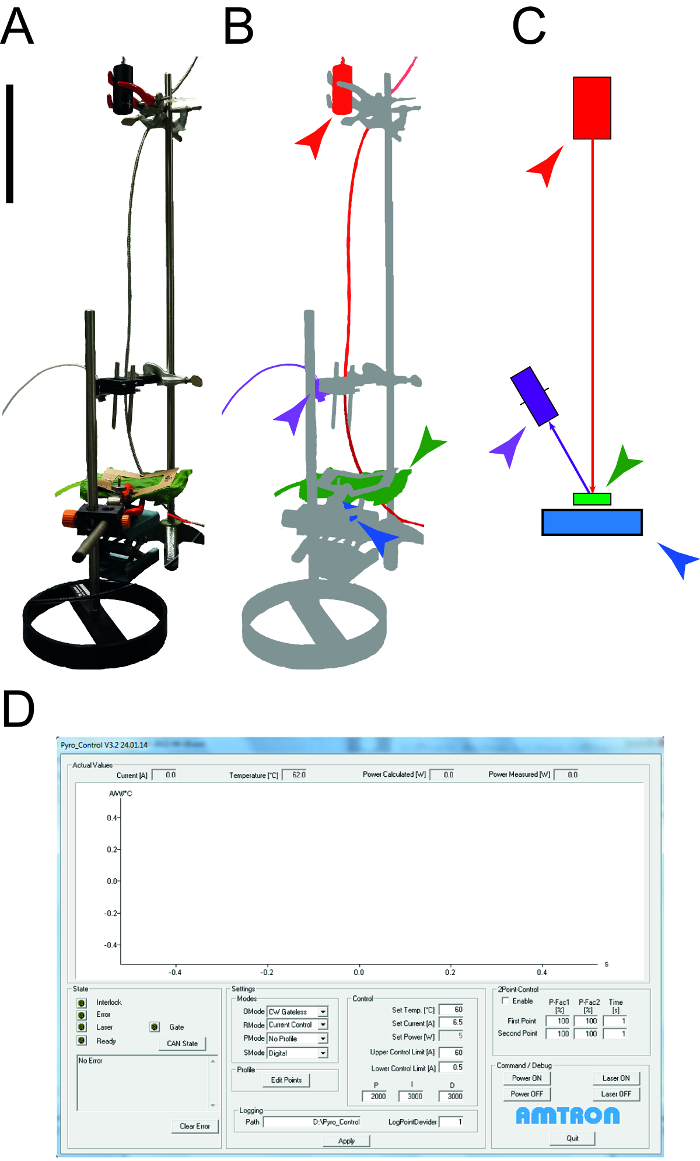
Şekil 1: yaprak termal özelliklerini belirlemek için kullanılan aparat. Bir. Ölçüm cihazının Fotoğraf özgül ısı kapasitesi ve le ısı iletkenliğini belirlemek için kullanılıraves. çevresel cihazlar (bilgisayarlar, osiloskop) gösterilmemiştir. B. Ölçüm cihazının şematik temsili. Lazer ve bağlı ekipmanları kırmızı vurgulanır, sıcaklık ölçümü için NUR dedektör mor gösterilir, yaprak örneği yeşil ve fotodiyot güç sensörü mavidir. Cı. B. aynı renk kodu ile ölçüm kurulum elemanlarının çizimi boyutu çubuğu 0.1 m gösterir. D. Ekran, lazer kontrol yazılımı tipik öğeleri gösteren. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Protocol
Representative Results
Discussion
Yukarıda açıklanan temas gerektirmeyen, yıkıcı olmayan, ölçüm yöntemi bir eş zamanlı ve tekrarlanabilir bir şekilde Cı P, S ve ʎ belirlemek için kullanılabilir. Özellikle ʎ hesaplanması hatalarına hassas olan çeşitli parametrelere bağlıdır. Bununla birlikte, bu hataların etkisi doğrusal ya da alt orantılıdır ve tüm parametreler için varyasyon katsayısı için, 10% 'den daha az olduğu tespit edilmiştir oldu. Dolayısıyla bu yöntem, sağlam olarak kabul edilebi…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
The authors are grateful to Dr. Thomas Rademacher and Ibrahim Al Amedi for cultivating the plants used in this study. We would like to thank Dr. Richard M. Twyman for his assistance with editing the manuscript. This work was in part funded by the European Research Council Advanced Grant “Future-Pharma”, proposal number 269110, the Fraunhofer Zukunftsstiftung (Future Foundation), the Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 1" tube | Thorlabs | SM1L10E | Tube for fiber holder |
| Agarose | Sigma Aldrich | A0701 | Agarose |
| Bi-Convex lense f=25.4 | Thorlabs | LB1761 | Lense |
| Digital Handheld Optical Power and Energy Meter Console | Thorlabs | PM100D | Console for thermal surface absorber sensor |
| Digital Phosphor Oscilloscope | Tektronix | DPO7104 | Oscilloscope |
| DMR light microscope | Leica | n.a. | Light microscope |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-2 | Pycnometer |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Fiber holder | Thorlabs | Fiber holder | |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Infrared Detector Optris CT | Optris | OPTCTLT15 | Infrared detector |
| Infrared Detector Software Compact Connect | Optris | n.a. | Control software for infrared detector |
| Lambda 1050 UV/Vis spectrophotometer | PerkinElmer | L1050 | UV/VIS Spectrophotometer |
| Laser 400μm, 1550nm Conduction Cooled Single Bar Fiber Coupled Module | DILAS | M1F-SS2.1 | Laser |
| Laser cover | Amtron | LM200 | Laser Cover |
| Laser Driver | Amtron | CS 408 | Laser Driver |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Photodiode sensor | Thorlabs | PDA20H-EC | Power sensor for transmission measurements |
| Precision weight Ohaus Analytical Plus | Ohaus | 80251552 | Precision weight |
| Sample frame | Fraunhofer ILT | n.a. | Fixation of the leaf sample |
| Software Pyro Control | Amtron | n.a. | Laser Power Control Software |
| Stainless-steel-holder | n.a. | n.a. | Holder for measurement set-up |
| Teflon plates 2cm | Fraunhofer ILT | n.a. | Teflon attenuation |
| Thermal surface absorber Power sensor | Thorlabs | S314C | Sensor for laser power measurements |
| Vibratome | Leica | 1491200S001 | Vibratome |
| Zoc/Pro 6.51 | EmTec Innovative Software | n.a. | Laser Control Software |
Referenzen
- Wilhelm, E. . Heat Capacities: Liquids, Solutions and Vapours. , 516 (2010).
- Costa, J. M., Grant, O. M., Chaves, M. M. Thermography to explore plant-environment interactions. J. Exp. Bot. 64, 3937-3949 (2013).
- Jayalakshmy, M. S., Philip, J. Thermophysical Properties of Plant Leaves and Their Influence on the Environment Temperature. International Journal of Thermophysics. 31, 2295-2304 (2010).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Schuster, A. C., et al. Effectiveness of cuticular transpiration barriers in a desert plant at controlling water loss at high temperatures. AoB PLANTS. 8, (2016).
- Parker, W. J., Jenkins, R. J., Abbott, G. L., Butler, C. P. Flash Method of Determining Thermal Diffusivity, Heat Capacity, and Thermal Conductivity. J Appl Phys. 32, 1679-1684 (1961).
- Hays, R. L. The thermal conductivity of leaves. Planta. 125, 281-287 (1975).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Hubbuch, J., Fischer, R. Blanching intact leaves or heat precipitation in an agitated vessel or heat exchanger removes host cell proteins from tobacco extracts. J. Vis. Exp. , (2015).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Buyel, J. F., Gruchow, H. M., Tödter, N., Wehner, M. Determination of the thermal properties of leaves by non-invasive contact free laser probing. J. Biotechnol. 217, 100-108 (2016).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Hedlund, H., Johansson, P. Heat capacity of birch determined by calorimetry: implications for the state of water in plants. Thermochim Acta. 349, 79-88 (2000).
- Chandrakanthi, M., Mehrotra, A. K., Hettiaratchi, J. P. A. Thermal conductivity of leaf compost used in biofilters: An experimental and theoretical investigation. Environ. Pollut. 136, 167-174 (2005).
- Larcher, W. . Physiological Plant Ecology: Ecophysiology and Stress Physiology of Functional Groups. , (2003).
- Cowen, R. A gamma-ray burst’s enduring fireball. Science News. 152, 197 (1997).
- Jones, H. G., et al. Thermal infrared imaging of crop canopies for the remote diagnosis and quantification of plant responses to water stress in the field. Funct. Plant Biol. 36, 978-989 (2009).
- Defraeye, T., Verboven, P., Ho, Q. T., Nicolai, B. Convective heat and mass exchange predictions at leaf surfaces: Applications, methods and perspectives. Comput. Electron. Agric. 96, 180-201 (2013).
- Arndt, S. K., Irawan, A., Sanders, G. J. Apoplastic water fraction and rehydration techniques introduce significant errors in measurements of relative water content and osmotic potential in plant leaves. Physiol. Plant. 155, 355-368 (2015).
- Jones, H. G., Schofield, P. Thermal and other remote sensing of plant stress. General and Applied Plant Physiology. 34, 19-32 (2008).
- Jones, H. G., Archer, N., Rotenberg, E., Casa, R. Radiation measurement for plant ecophysiology. J. Exp. Bot. 54, 879-889 (2003).
- Dupont, C., Chiriac, R., Gauthier, G., Toche, F. Heat capacity measurements of various biomass types and pyrolysis residues. Fuel. 115, 644-651 (2014).
- Chaerle, L., et al. Multi-sensor plant imaging: Towards the development of a stress-catalogue. Biotechnol. J. 4, 1152-1167 (2009).
- Hackl, H., Baresel, J. P., Mistele, B., Hu, Y., Schmidhalter, U. A Comparison of Plant Temperatures as Measured by Thermal Imaging and Infrared Thermometry. J. Agron. Crop. Sci. , 415-429 (2012).
- Yuan, L., et al. Spectral analysis of winter wheat leaves for detection and differentiation of diseases and insects. Field Crops Res. 156, 199-207 (2014).

