迅速なレーザー法は葉熱特性の非侵襲的および非接触決意を容易にプロービング
Summary
A method was developed to determine the specific heat capacity and thermal conductivity of leaf tissue by non-invasive, contact-free near infrared laser probing, which requires less than 1 min per sample.
Abstract
植物は、このような二次代謝産物および組換えタンパク質などの価値のある物質を生成することができます。植物バイオマスからの後者の精製は、熱処理(ブランチング)することによって合理化することができます。葉の熱特性を詳細、 すなわち 、特定の熱容量と熱伝導性で知られている場合、ブランチング装置は、より正確に設計することができます。これらの特性の測定には時間がかかり、労働集約的であり、通常は直接試料に接触侵襲的な方法を必要とします。これは、製品の歩留まりを低下させることができるとのGMPの文脈における封じ込めの要件、 例えば、と互換性がない可能性があります。これらの問題に対処するために、非侵襲性、非接触方法は、約1分での比熱容量と無傷植物の葉の熱伝導率を決定することを開発しました。この方法は、小領域に定義された長さおよび強度の短レーザーパルスの適用を含みます近赤外センサーを用いて測定される温度上昇を引き起こす葉サンプル。温度上昇は、比熱容量を決定するために、既知の葉の特性(厚さ及び密度)と組み合わされます。熱伝導率は、アカウントに熱放射および対流熱伝達を取って、その後の温度低下のプロファイルに基づいて算出されます。関連する計算とサンプルの取り扱いの重要な側面が議論されています。
Introduction
生物材料の大規模な処理は、しばしば、殺菌などの熱処理工程を必要とします。生物学的材料の熱的特性がよく特徴付けられている場合、そのようなプロセスのための装置は、比熱容量(C P、S)及び熱伝導率(λ)を含む、より正確に設計することができます。これらのパラメータは、熱量測定1により、液体、懸濁液およびホモジネートのために容易に決定することができます。しかし、固体試料にこのようなパラメータを測定することは、労働集約的であることができ、多くの場合、サンプルあるいはその破壊2との直接接触を必要とします。例えば、光熱技術は、サンプルと検出器3との間の直接的な接触を必要とします。このような制限は、食品加工の際に許容されるが、このような適正製造基準4の文脈における植物中のバイオ医薬品タンパク質の産生などの高度に規制プロセスと互換性がありません。私nはそのような状況では、熱的特性の繰り返し( 例えば、毎週)監視は、品質管理ツールとして、個々の植物のための7週間の成長期間中に必要とされ得ます。このような監視が必要と各測定のための葉を消費してしまう場合は、収穫の時に処理するために残されたバイオマスはないだろう。
さらに、植物に負傷の原因となり、再度、プロセス歩留まりを減少、壊死または病原体感染の危険を増大させるだけではなく葉の部分を使用して。試料に直接接触と方法が使用される場合、病原体感染の可能性はまた、植物のバッチ全体が汚染され、センサ装置との接触によって感染することができるリスクを誘導する、増大させることができます。同様の側面は生態生理学的文脈で、 例えば 、干ばつなどの植物ストレスの監視のために考慮しなければなりません。例えば、水の損失は、多くの場合、侵襲的TREを必要とする新鮮なバイオマスの変化によって監視されます例えば 、調査5、下の植物のatment、葉を解剖。代わりに、ここで説明するように、非侵襲的に、サンプルの含水量に依存する比熱容量を決定する、植物の水和状態の代理パラメータとして使用することができます。彼らは実験データを歪曲することができますように、両方のシナリオ(医薬品製造および生態生理学)では、破壊的または侵襲的な測定技術により誘導される人工的なストレスは有害であろう。それらのいずれかがサンプルに直接接触することを必要とするか、または破壊的であるため、そのため、以前に報告されたフラッシュ・メソッド6または銀のプレート7との間のサンプルの配置は、このようなプロセスや実験に適していません。パラメータCはP、S及びλは、生成物の精製を単純化し、製造コスト8-10を低減することができるブランチング工程のための処理装置を設計するために決定されなければなりません。どちらもCP、S及びλは、現在急速に一貫して再現可能な方法11でプロービング非接触、非破壊近赤外(NIR)レーザーによって決定することができ、この新しい方法は、以下に詳細に説明します。この方法で得られた結果を正常タバコにおける熱伝達は、適切な処理装置の設計や、ブランチング温度、対応するパラメータの選択を可能にする、12を出るシミュレートするために使用されました。
この方法は、( 図1)を設定することが容易であり、2つの主要な工程を含む、それぞれが2段階、測定、解析を、持っています。測定段階では、葉のサンプルを、最初に局所的に短いレーザーパルスによって加熱され、最大試料温度が記録されます。試料の温度プロファイルは、その後、50秒の持続時間のために記録されています。分析フェーズでは、密度など葉特性が(容易にかつ正確にpycnometric measuremによって決定しますENT)、Sを C pを計算するために、最大試料温度と組み合わされます。第2のステップでは、葉の温度プロファイルは、λを計算するために、アカウントに伝導、対流および放射しながら、エネルギー平衡方程式の入力として使用されます。
詳細な手順は、添付のビデオの内容に拡大し、プロトコルのセクションで提供されています。典型的な測定は、結果セクションに表示されます。最後に、この方法の利点と制限は、潜在的な改良と、さらにアプリケーションと一緒にディスカッションセクションで強調表示されます。
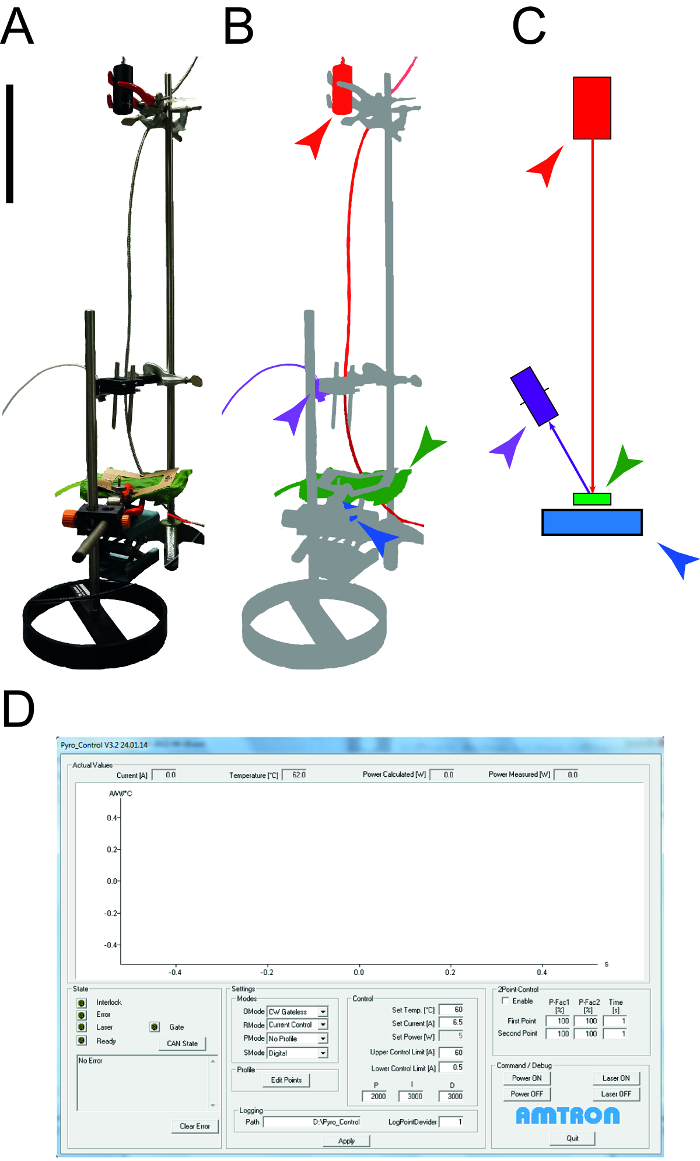
図1:葉の熱的特性を決定するために使用される装置。 。比熱容量ルの熱伝導率を決定するために使用される測定装置の写真鳥類。周辺機器(コンピュータ、オシロスコープ)が示されていません。 B。測定装置の概略図。レーザーおよび接続された機器は赤色で強調表示され、温度測定用のNIR検出器は紫色で示されている、葉のサンプルは緑であり、フォトダイオードパワーセンサは青です。 C。 B.と同じカラーコード付き測定セットアップの要素の描画サイズのバーが0.1メートルを示しています。 D。レーザ制御ソフトウェアの典型的な要素を示すスクリーンショット。 この図の拡大版をご覧になるにはこちらをクリックしてください。
Protocol
Representative Results
Discussion
上述した非接触、非破壊測定方法は、同時かつ再現可能な方法でのC、P、S及びʎを決定することができます。特にʎの計算はエラーに敏感であるいくつかのパラメータに依存します。それにもかかわらず、これらの誤差の影響は、線形またはサブ比例のいずれかであり、すべてのパラメータの変動係数は10%未満であることが見出されました。この方法は、このようにロバスト?…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
The authors are grateful to Dr. Thomas Rademacher and Ibrahim Al Amedi for cultivating the plants used in this study. We would like to thank Dr. Richard M. Twyman for his assistance with editing the manuscript. This work was in part funded by the European Research Council Advanced Grant “Future-Pharma”, proposal number 269110, the Fraunhofer Zukunftsstiftung (Future Foundation), the Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 1" tube | Thorlabs | SM1L10E | Tube for fiber holder |
| Agarose | Sigma Aldrich | A0701 | Agarose |
| Bi-Convex lense f=25.4 | Thorlabs | LB1761 | Lense |
| Digital Handheld Optical Power and Energy Meter Console | Thorlabs | PM100D | Console for thermal surface absorber sensor |
| Digital Phosphor Oscilloscope | Tektronix | DPO7104 | Oscilloscope |
| DMR light microscope | Leica | n.a. | Light microscope |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-2 | Pycnometer |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Fiber holder | Thorlabs | Fiber holder | |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Infrared Detector Optris CT | Optris | OPTCTLT15 | Infrared detector |
| Infrared Detector Software Compact Connect | Optris | n.a. | Control software for infrared detector |
| Lambda 1050 UV/Vis spectrophotometer | PerkinElmer | L1050 | UV/VIS Spectrophotometer |
| Laser 400μm, 1550nm Conduction Cooled Single Bar Fiber Coupled Module | DILAS | M1F-SS2.1 | Laser |
| Laser cover | Amtron | LM200 | Laser Cover |
| Laser Driver | Amtron | CS 408 | Laser Driver |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Photodiode sensor | Thorlabs | PDA20H-EC | Power sensor for transmission measurements |
| Precision weight Ohaus Analytical Plus | Ohaus | 80251552 | Precision weight |
| Sample frame | Fraunhofer ILT | n.a. | Fixation of the leaf sample |
| Software Pyro Control | Amtron | n.a. | Laser Power Control Software |
| Stainless-steel-holder | n.a. | n.a. | Holder for measurement set-up |
| Teflon plates 2cm | Fraunhofer ILT | n.a. | Teflon attenuation |
| Thermal surface absorber Power sensor | Thorlabs | S314C | Sensor for laser power measurements |
| Vibratome | Leica | 1491200S001 | Vibratome |
| Zoc/Pro 6.51 | EmTec Innovative Software | n.a. | Laser Control Software |
Referenzen
- Wilhelm, E. . Heat Capacities: Liquids, Solutions and Vapours. , 516 (2010).
- Costa, J. M., Grant, O. M., Chaves, M. M. Thermography to explore plant-environment interactions. J. Exp. Bot. 64, 3937-3949 (2013).
- Jayalakshmy, M. S., Philip, J. Thermophysical Properties of Plant Leaves and Their Influence on the Environment Temperature. International Journal of Thermophysics. 31, 2295-2304 (2010).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Schuster, A. C., et al. Effectiveness of cuticular transpiration barriers in a desert plant at controlling water loss at high temperatures. AoB PLANTS. 8, (2016).
- Parker, W. J., Jenkins, R. J., Abbott, G. L., Butler, C. P. Flash Method of Determining Thermal Diffusivity, Heat Capacity, and Thermal Conductivity. J Appl Phys. 32, 1679-1684 (1961).
- Hays, R. L. The thermal conductivity of leaves. Planta. 125, 281-287 (1975).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Hubbuch, J., Fischer, R. Blanching intact leaves or heat precipitation in an agitated vessel or heat exchanger removes host cell proteins from tobacco extracts. J. Vis. Exp. , (2015).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Buyel, J. F., Gruchow, H. M., Tödter, N., Wehner, M. Determination of the thermal properties of leaves by non-invasive contact free laser probing. J. Biotechnol. 217, 100-108 (2016).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Hedlund, H., Johansson, P. Heat capacity of birch determined by calorimetry: implications for the state of water in plants. Thermochim Acta. 349, 79-88 (2000).
- Chandrakanthi, M., Mehrotra, A. K., Hettiaratchi, J. P. A. Thermal conductivity of leaf compost used in biofilters: An experimental and theoretical investigation. Environ. Pollut. 136, 167-174 (2005).
- Larcher, W. . Physiological Plant Ecology: Ecophysiology and Stress Physiology of Functional Groups. , (2003).
- Cowen, R. A gamma-ray burst’s enduring fireball. Science News. 152, 197 (1997).
- Jones, H. G., et al. Thermal infrared imaging of crop canopies for the remote diagnosis and quantification of plant responses to water stress in the field. Funct. Plant Biol. 36, 978-989 (2009).
- Defraeye, T., Verboven, P., Ho, Q. T., Nicolai, B. Convective heat and mass exchange predictions at leaf surfaces: Applications, methods and perspectives. Comput. Electron. Agric. 96, 180-201 (2013).
- Arndt, S. K., Irawan, A., Sanders, G. J. Apoplastic water fraction and rehydration techniques introduce significant errors in measurements of relative water content and osmotic potential in plant leaves. Physiol. Plant. 155, 355-368 (2015).
- Jones, H. G., Schofield, P. Thermal and other remote sensing of plant stress. General and Applied Plant Physiology. 34, 19-32 (2008).
- Jones, H. G., Archer, N., Rotenberg, E., Casa, R. Radiation measurement for plant ecophysiology. J. Exp. Bot. 54, 879-889 (2003).
- Dupont, C., Chiriac, R., Gauthier, G., Toche, F. Heat capacity measurements of various biomass types and pyrolysis residues. Fuel. 115, 644-651 (2014).
- Chaerle, L., et al. Multi-sensor plant imaging: Towards the development of a stress-catalogue. Biotechnol. J. 4, 1152-1167 (2009).
- Hackl, H., Baresel, J. P., Mistele, B., Hu, Y., Schmidhalter, U. A Comparison of Plant Temperatures as Measured by Thermal Imaging and Infrared Thermometry. J. Agron. Crop. Sci. , 415-429 (2012).
- Yuan, L., et al. Spectral analysis of winter wheat leaves for detection and differentiation of diseases and insects. Field Crops Res. 156, 199-207 (2014).

