Ein Rapid-Laser Probing Verfahren erleichtert die Nicht-invasive und berührungslose Bestimmung der Blatt Thermische Eigenschaften
Summary
A method was developed to determine the specific heat capacity and thermal conductivity of leaf tissue by non-invasive, contact-free near infrared laser probing, which requires less than 1 min per sample.
Abstract
Pflanzen können wertvolle Substanzen wie sekundäre Stoffwechselprodukte und rekombinante Proteine produzieren. Die Reinigung des letzteren aus pflanzlicher Biomasse kann durch Wärmebehandlung (Blanchieren) rationalisiert werden. A Blanchierens Vorrichtung kann genauer gestaltet werden , wenn die thermischen Eigenschaften der Blätter im Detail, dh der spezifischen Wärmekapazität und der Wärmeleitfähigkeit bekannt sind. Die Messung dieser Eigenschaften ist zeitaufwendig und arbeitsintensiv und erfordert in der Regel invasive Methoden, die die Probe direkt in Verbindung. Dies kann die Produktausbeute verringern und kann mit Contain Anforderungen, zum Beispiel im Rahmen der guten Herstellungspraxis unvereinbar. Um diese Probleme anzugehen, eine nicht-invasive, berührungslose Verfahren entwickelt, dass die spezifische Wärmekapazität und der Wärmeleitfähigkeit eines intakten Pflanzenblatt in etwa einer Minute bestimmt. Das Verfahren beinhaltet die Anwendung eines kurzen Laserimpuls von definierter Länge und Intensität auf einen kleinen Bereich derBlattprobe, um einen Temperaturanstieg verursacht, der einen nahen Infrarotsensor gemessen wird. Die Temperaturerhöhung wird mit bekannten Blatteigenschaften (Dicke und Dichte) kombiniert, um die spezifische Wärmekapazität zu bestimmen. Die Wärmeleitfähigkeit wird dann basierend auf dem Profil des anschließenden Temperaturabfalls berechnet, Wärmestrahlung und konvektive Wärmeübertragung berücksichtigt wird. Die dazugehörigen Berechnungen und kritische Aspekte der Handhabung der Proben werden diskutiert.
Introduction
Die groß angelegte Verarbeitung von biologischen Materialien erfordert häufig Wärmebehandlungsschritte wie Pasteurisierung. Die Ausrüstung für solche Verfahren kann genauer gestaltet werden , wenn die thermischen Eigenschaften der biologischen Materialien gut charakterisiert sind, einschließlich der spezifischen Wärmekapazität (C p, s) und der Wärmeleitfähigkeit (λ). Diese Parameter können leicht für Flüssigkeiten, Suspensionen und Homogenate von 1 Kalorimetrie bestimmt werden. Allerdings Messung solcher Parameter in festen Proben können arbeitsintensiv sein und erfordert oft einen direkten Kontakt mit der Probe oder sogar die Zerstörung 2. Beispielsweise erfordern Lichtwärmeumsetzmaterial Techniken direkten Kontakt zwischen der Probe und dem Detektor 3. Solche Einschränkungen sind während der Lebensmittelverarbeitung akzeptabel, aber mit stark regulierten Prozesse wie die Produktion von biopharmazeutischen Proteinen in Pflanzen im Rahmen der guten Herstellungs unvereinbar sind Praxis 4. ichn einem solchen Kontext wiederholt (beispielsweise wöchentlich) Überwachung der thermischen Eigenschaften kann während einer siebenwöchigen Wachstumsperiode für einzelne Pflanzen als Qualitätskontrollwerkzeug erforderlich. Wenn eine solche Überwachung erfordern würde und verbrauchen ein Blatt für jede Messung, gäbe es keine Biomasse übrig bleiben zum Zeitpunkt der Ernte verarbeitet werden.
Zusätzlich nur mit Blattteilen anstatt auf die Pflanze Verwundung und das Risiko einer Nekrose oder Pathogeninfektion erhöhen würde dazu führen, was wiederum die Prozessausbeute verringert. Die Wahrscheinlichkeit der Pathogen-Infektion kann auch erhöhen, wenn ein Verfahren mit direktem Kontakt zu der Probe verwendet werden würde, zu induzieren, das Risiko, dass eine gesamte Charge von Pflanzen kann mit einem kontaminierten Sensoreinrichtung durch Kontakt infiziert werden. Ähnliche Aspekte müssen berücksichtigt werden für die Überwachung der Anlage , wie Dürre betont, zum Beispiel in einem ökophysiologische Kontext. Beispielsweise wird der Wasserverlust oft durch eine Änderung in der frischen Biomasse überwacht, die ein invasives tre erfordertatment der Pflanzen untersuchten 5, beispielsweise ein Blatt sezieren. Stattdessen wird die spezifische Wärmekapazität zu bestimmen, die auf der Wassergehalt einer Probe, wie hier beschreiben, in einem nicht-invasive Art und Weise abhängt, kann als Surrogatparameter für den Hydratationsstatus von Anlagen verwendet werden. In beiden Szenarien (pharmazeutische Produktion und Ökophysiologie), induzierte künstliche Spannungen, die durch destruktive oder invasive Messtechniken wäre schädlich, da sie die experimentellen Daten verzerren können. Daher zuvor berichtet Blitzverfahren 6 oder die Platzierung von Proben zwischen Silberplatten 7 sind ungeeignet für solche Verfahren und Experimente , weil sie entweder einen direkten Kontakt zu der Probe erfordern oder zerstörend sind. Die Parameter c p, s und λ müssen, um die Ausrüstung für eine blanchiert Schritt zu entwerfen bestimmt werden , die Produktreinigung vereinfachen und somit die Herstellungskosten 8-10 reduzieren. Sowohl cp, s und λ kann nun schnell durch berührungslose zerstörungs nahen Infrarot (NIR) Laser in konsistenter und reproduzierbarer Weise Sondieren 11 bestimmt werden und dieses neue Verfahren wird im Detail nachstehend erläutert. Die Ergebnisse mit diesem Verfahren erhalten wurden , wurden erfolgreich eingesetzt , die Wärmeübertragung zu simulieren , in Tabak 12 verlässt, so dass die Gestaltung geeigneter Verarbeitungsgeräte und die Auswahl der Parameter, wie die Blanchierung Temperatur entspricht.
Das Verfahren ist einfach einzurichten (Abbildung 1) und hat zwei Phasen, Messung und Analyse, von denen jede zwei wichtige Schritte umfasst. In der Messphase wird zunächst eine Blattprobe lokal durch einen kurzen Laserpuls aufgeheizt und die maximale Probentemperatur aufgezeichnet. Das Temperaturprofil der Probe wird dann für eine Dauer von 50 s aufgezeichnet. In der Analysephase Blatteigenschaften wie Dichte (leicht und genau durch pyknometrische Measurem bestimmtent) mit dem maximalen Probentemperatur kombiniert c p, s berechnen. Im zweiten Schritt wird die Blatttemperaturprofil als Eingang für eine Energiebilanzgleichung unter Wärmeleitung, Konvektion und Strahlung in Betracht, verwendet λ zu berechnen.
Detaillierte Schritt-für-Schritt-Anleitungen sind im Protokollabschnitt, der an dem Inhalt des zugehörigen Video erweitert. Typische Messungen werden dann im Ergebnisteil gezeigt. Schließlich werden die Vorteile und Grenzen des Verfahrens sind, zusammen mit potenziellen Verbesserungen und weitere Anwendungen in der Diskussion Abschnitt hervorgehoben.
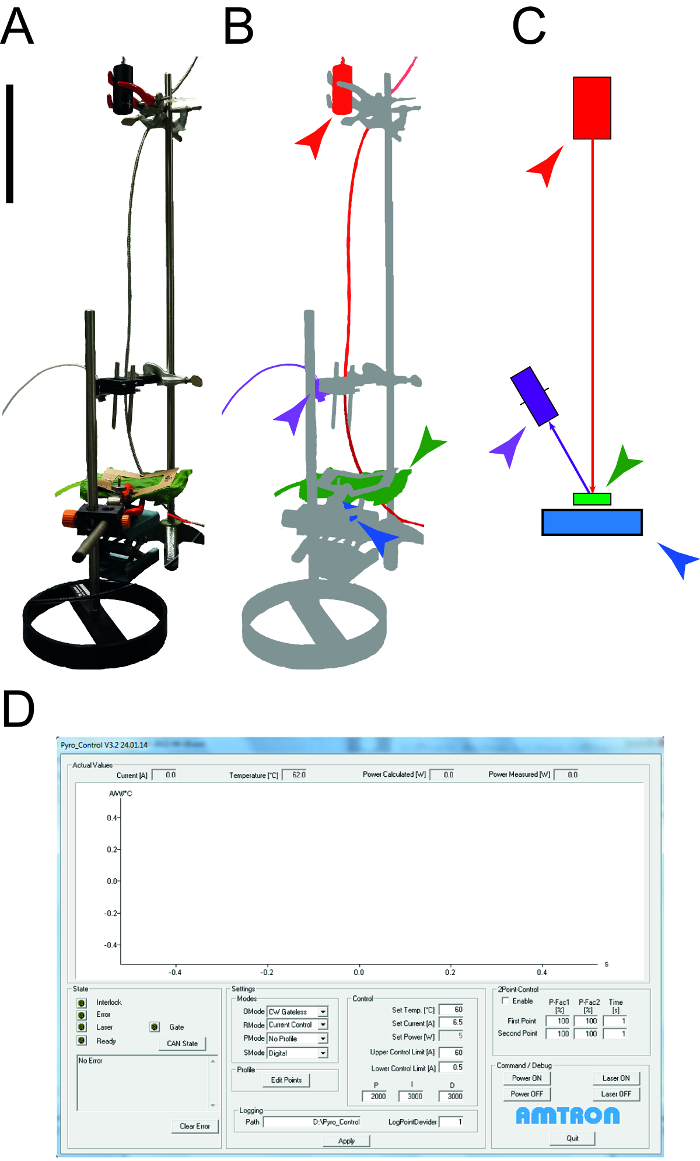
Abbildung 1: Verwendetes Gerät Blatt thermischen Eigenschaften zu bestimmen. A. Fotografie der Messvorrichtung verwendet, um die spezifische Wärmekapazität und Wärmeleitfähigkeit von le zu bestimmenAves. Die Peripheriegeräte (Computer, Oszilloskop) sind nicht gezeigt. B. Schematische Darstellung der Messvorrichtung. Der Laser und die angeschlossenen Geräte in Rot markiert sind, wird der NIR-Detektor für die Temperaturmessung in lila dargestellt, ist die Blattprobe grün und die Photodiode Leistungssensor ist blau. C. Zeichnung der Elemente des Messaufbaus mit dem gleichen Farbcode wie in B. Die Größe Balken zeigt 0,1 m. D. Screenshot illustriert die typischen Elemente der Lasersteuerungssoftware. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Protocol
Representative Results
Discussion
Die berührungslose, zerstörungsfreie Messung oben beschriebene Verfahren kann verwendet werden , c p, s und ʎ in einer simultanen und reproduzierbar zu bestimmen. Die Berechnung der ʎ insbesondere hängt von mehreren Parametern, die zu Fehlern empfindlich sind. Dennoch war die Wirkung dieser Fehler entweder linear oder Unter proportional, und der Variationskoeffizient für alle Parameter weniger als 10% festgestellt wurde. Obwohl das Verfahren somit als robust angesehen werden können, können ei…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
The authors are grateful to Dr. Thomas Rademacher and Ibrahim Al Amedi for cultivating the plants used in this study. We would like to thank Dr. Richard M. Twyman for his assistance with editing the manuscript. This work was in part funded by the European Research Council Advanced Grant “Future-Pharma”, proposal number 269110, the Fraunhofer Zukunftsstiftung (Future Foundation), the Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 1" tube | Thorlabs | SM1L10E | Tube for fiber holder |
| Agarose | Sigma Aldrich | A0701 | Agarose |
| Bi-Convex lense f=25.4 | Thorlabs | LB1761 | Lense |
| Digital Handheld Optical Power and Energy Meter Console | Thorlabs | PM100D | Console for thermal surface absorber sensor |
| Digital Phosphor Oscilloscope | Tektronix | DPO7104 | Oscilloscope |
| DMR light microscope | Leica | n.a. | Light microscope |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-2 | Pycnometer |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Fiber holder | Thorlabs | Fiber holder | |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Infrared Detector Optris CT | Optris | OPTCTLT15 | Infrared detector |
| Infrared Detector Software Compact Connect | Optris | n.a. | Control software for infrared detector |
| Lambda 1050 UV/Vis spectrophotometer | PerkinElmer | L1050 | UV/VIS Spectrophotometer |
| Laser 400μm, 1550nm Conduction Cooled Single Bar Fiber Coupled Module | DILAS | M1F-SS2.1 | Laser |
| Laser cover | Amtron | LM200 | Laser Cover |
| Laser Driver | Amtron | CS 408 | Laser Driver |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Photodiode sensor | Thorlabs | PDA20H-EC | Power sensor for transmission measurements |
| Precision weight Ohaus Analytical Plus | Ohaus | 80251552 | Precision weight |
| Sample frame | Fraunhofer ILT | n.a. | Fixation of the leaf sample |
| Software Pyro Control | Amtron | n.a. | Laser Power Control Software |
| Stainless-steel-holder | n.a. | n.a. | Holder for measurement set-up |
| Teflon plates 2cm | Fraunhofer ILT | n.a. | Teflon attenuation |
| Thermal surface absorber Power sensor | Thorlabs | S314C | Sensor for laser power measurements |
| Vibratome | Leica | 1491200S001 | Vibratome |
| Zoc/Pro 6.51 | EmTec Innovative Software | n.a. | Laser Control Software |
Referenzen
- Wilhelm, E. . Heat Capacities: Liquids, Solutions and Vapours. , 516 (2010).
- Costa, J. M., Grant, O. M., Chaves, M. M. Thermography to explore plant-environment interactions. J. Exp. Bot. 64, 3937-3949 (2013).
- Jayalakshmy, M. S., Philip, J. Thermophysical Properties of Plant Leaves and Their Influence on the Environment Temperature. International Journal of Thermophysics. 31, 2295-2304 (2010).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Schuster, A. C., et al. Effectiveness of cuticular transpiration barriers in a desert plant at controlling water loss at high temperatures. AoB PLANTS. 8, (2016).
- Parker, W. J., Jenkins, R. J., Abbott, G. L., Butler, C. P. Flash Method of Determining Thermal Diffusivity, Heat Capacity, and Thermal Conductivity. J Appl Phys. 32, 1679-1684 (1961).
- Hays, R. L. The thermal conductivity of leaves. Planta. 125, 281-287 (1975).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Hubbuch, J., Fischer, R. Blanching intact leaves or heat precipitation in an agitated vessel or heat exchanger removes host cell proteins from tobacco extracts. J. Vis. Exp. , (2015).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Buyel, J. F., Gruchow, H. M., Tödter, N., Wehner, M. Determination of the thermal properties of leaves by non-invasive contact free laser probing. J. Biotechnol. 217, 100-108 (2016).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Hedlund, H., Johansson, P. Heat capacity of birch determined by calorimetry: implications for the state of water in plants. Thermochim Acta. 349, 79-88 (2000).
- Chandrakanthi, M., Mehrotra, A. K., Hettiaratchi, J. P. A. Thermal conductivity of leaf compost used in biofilters: An experimental and theoretical investigation. Environ. Pollut. 136, 167-174 (2005).
- Larcher, W. . Physiological Plant Ecology: Ecophysiology and Stress Physiology of Functional Groups. , (2003).
- Cowen, R. A gamma-ray burst’s enduring fireball. Science News. 152, 197 (1997).
- Jones, H. G., et al. Thermal infrared imaging of crop canopies for the remote diagnosis and quantification of plant responses to water stress in the field. Funct. Plant Biol. 36, 978-989 (2009).
- Defraeye, T., Verboven, P., Ho, Q. T., Nicolai, B. Convective heat and mass exchange predictions at leaf surfaces: Applications, methods and perspectives. Comput. Electron. Agric. 96, 180-201 (2013).
- Arndt, S. K., Irawan, A., Sanders, G. J. Apoplastic water fraction and rehydration techniques introduce significant errors in measurements of relative water content and osmotic potential in plant leaves. Physiol. Plant. 155, 355-368 (2015).
- Jones, H. G., Schofield, P. Thermal and other remote sensing of plant stress. General and Applied Plant Physiology. 34, 19-32 (2008).
- Jones, H. G., Archer, N., Rotenberg, E., Casa, R. Radiation measurement for plant ecophysiology. J. Exp. Bot. 54, 879-889 (2003).
- Dupont, C., Chiriac, R., Gauthier, G., Toche, F. Heat capacity measurements of various biomass types and pyrolysis residues. Fuel. 115, 644-651 (2014).
- Chaerle, L., et al. Multi-sensor plant imaging: Towards the development of a stress-catalogue. Biotechnol. J. 4, 1152-1167 (2009).
- Hackl, H., Baresel, J. P., Mistele, B., Hu, Y., Schmidhalter, U. A Comparison of Plant Temperatures as Measured by Thermal Imaging and Infrared Thermometry. J. Agron. Crop. Sci. , 415-429 (2012).
- Yuan, L., et al. Spectral analysis of winter wheat leaves for detection and differentiation of diseases and insects. Field Crops Res. 156, 199-207 (2014).

