Un láser de sondeo rápido método facilita la determinación no invasiva y sin contacto de la hoja de Propiedades Térmicas
Summary
A method was developed to determine the specific heat capacity and thermal conductivity of leaf tissue by non-invasive, contact-free near infrared laser probing, which requires less than 1 min per sample.
Abstract
Las plantas pueden producir sustancias valiosas tales como metabolitos secundarios y proteínas recombinantes. La purificación de este último a partir de biomasa de la planta puede ser simplificado mediante el tratamiento de calor (escaldado). Un aparato de escaldado se puede diseñar con más precisión si las propiedades térmicas de las hojas se conocen en detalle, es decir, la capacidad de calor específico y conductividad térmica. La medición de estas propiedades es mucho tiempo y mucha mano de obra, y por lo general requiere métodos invasivos que entran en contacto la muestra directamente. Esto puede reducir el rendimiento del producto y puede ser incompatible con los requisitos de contención, por ejemplo, en el contexto de buenas prácticas de fabricación. Para abordar estos problemas, un método no invasivo, sin contacto fue desarrollado que determina la capacidad de calor específico y la conductividad térmica de una hoja de la planta intacta en aproximadamente un minuto. El método implica la aplicación de un pulso de láser corto de la longitud y la intensidad se define a una pequeña área de lamuestra de hoja, causando un aumento de la temperatura que se mide usando un sensor de infrarrojo cercano. El aumento de temperatura se combina con conocidas propiedades de la hoja (espesor y densidad) para determinar la capacidad de calor específico. La conductividad térmica se calcula entonces basándose en el perfil de la disminución de la temperatura posterior, teniendo la radiación térmica y la transferencia de calor por convección en cuenta. Se discuten los cálculos asociados y aspectos críticos de la manipulación de las muestras.
Introduction
El procesamiento a gran escala de materiales biológicos a menudo requiere pasos de tratamiento térmico tales como la pasteurización. El equipo para tales procesos se puede diseñar con más precisión si las propiedades térmicas de los materiales biológicos están bien caracterizadas, incluyendo la capacidad específica de calor (c p, s) y la conductividad térmica (λ). Estos parámetros se pueden determinar fácilmente para líquidos, suspensiones y homogeneizados mediante calorimetría 1. Sin embargo, la medición de estos parámetros en muestras sólidas pueden ser de mano de obra, y a menudo requiere el contacto directo con la muestra o incluso su destrucción 2. Por ejemplo, las técnicas de fototérmicos requieren contacto directo entre la muestra y el detector 3. Estas limitaciones son aceptables durante el procesamiento de alimentos, pero son incompatibles con los procesos altamente regulados, tales como la producción de proteínas biofarmacéuticas en plantas en el contexto de las buenas prácticas de fabricación 4. yon este contexto, puede ser necesario repetir (por ejemplo, semanal) el seguimiento de las propiedades térmicas durante un período de siete semanas de crecimiento para las plantas individuales como una herramienta de control de calidad. Si una supervisión de este tipo requeriría y consumir una hoja para cada medición, no habría biomasa izquierda a procesar en el momento de la cosecha.
Además, utilizando únicamente piezas de hoja en lugar podría causar heridas a la planta y aumentar el riesgo de necrosis o infección por patógenos, de nuevo disminuyendo el rendimiento del proceso. La probabilidad de que la infección por patógenos también puede aumentar si se utiliza un método de contacto directo con la muestra, que induce el riesgo de que un lote entero de las plantas puede estar infectada por el contacto con un dispositivo sensor contaminada. Aspectos similares tienen que ser considerados para la supervisión de la planta destaca como la sequía, por ejemplo, en un contexto ecofisiológica. Por ejemplo, la pérdida de agua es a menudo controlado por un cambio en la biomasa fresca, lo que requiere un tre invasivaatment de las plantas que se investigan 5, por ejemplo, una hoja de disección. En lugar de ello, la determinación de la capacidad de calor específico, que depende del contenido de agua de una muestra, de una manera no invasiva como se ha descrito aquí, se puede utilizar como un parámetro sustituto para el estado de hidratación de las plantas. En ambos escenarios (producción farmacéutica y ecofisiología), tensiones artificiales inducidos por técnicas de medición destructivas o invasivos serían perjudiciales ya que pueden distorsionar los datos experimentales. Métodos de flash, por lo tanto, se informó anteriormente 6 o la colocación de muestras entre las placas de plata 7 no son adecuados para este tipo de procesos y experimentos, ya sea porque requieren contacto directo con la muestra o son destructivos. Los parámetros c p, s y λ deben determinarse con el fin de diseñar el equipo de proceso de una etapa de blanqueo que puede simplificar la purificación del producto y reducir así los costes de fabricación 8-10. tanto cp, s y λ ahora pueden determinarse rápidamente por láser sin contacto infrarrojo cercano no destructivo (NIR) de sondeo de una manera consistente y reproducible 11 y este nuevo método se explicarán en detalle a continuación. Los resultados obtenidos con este método se utilizaron con éxito para simular la transferencia de calor en las hojas de tabaco 12, lo que permite el diseño de equipos de procesamiento apropiada y la selección de los parámetros correspondientes tal como la temperatura de escaldado.
El método es fácil de configurar (Figura 1) y tiene dos fases, la medición y el análisis, cada una de las cuales comprende dos etapas principales. En la fase de medición, una muestra de hoja se calienta primero a nivel local por un pulso de láser corto y se registra la temperatura máxima de la muestra. El perfil de temperatura de la muestra se registra a continuación, para una duración de 50 s. En la fase de análisis, las propiedades de la hoja tales como la densidad (con facilidad y precisión determinados por measurem picnométricoent) se combinan con la temperatura máxima de la muestra para calcular c p, s. En el segundo paso, el perfil de temperatura de la hoja se utiliza como entrada para una ecuación de balance de energía, teniendo la conducción, convección y radiación en cuenta, para calcular λ.
Detalladas instrucciones paso a paso se proporcionan en la sección de protocolo, ampliando el contenido del video que lo acompaña. mediciones típicos se muestran a continuación en la sección de resultados. Por último, los beneficios y limitaciones del método se resaltan en la sección de discusión, junto con las posibles mejoras y nuevas aplicaciones.
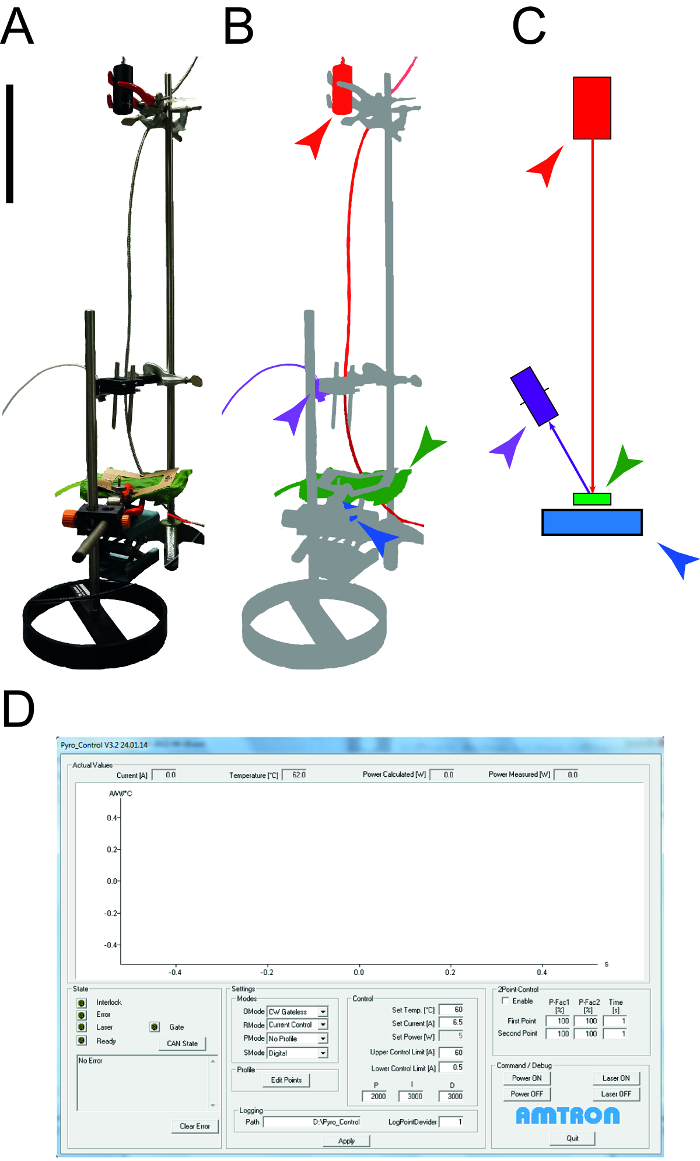
Figura 1: Aparato utilizado para determinar las propiedades térmicas de las hojas. A. Fotografía del aparato de medición utilizado para determinar la capacidad de calor específico y la conductividad térmica de leAves. Los dispositivos periféricos (ordenadores, osciloscopio) no se muestran. B. Representación esquemática del aparato de medición. El láser y el equipo conectado están resaltados en rojo, el detector NIR para la medición de la temperatura se muestra en la púrpura, la muestra de la hoja es verde y el sensor de potencia fotodiodo es de color azul. C. Dibujo de los elementos de la configuración de la medición con el mismo código de color como en B. La barra indica el tamaño de 0,1 m. D. Captura de pantalla que ilustra los elementos típicos del software de control de láser. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
El método de medición sin contacto, no destructivo descrito anteriormente se puede utilizar para determinar c p, s y ʎ de una manera simultánea y reproducible. El cálculo de ʎ, en particular, depende de varios parámetros que son sensibles a los errores. Sin embargo, el impacto de estos errores se encontró era lineal o sub-proporcional, y el coeficiente de variación para todos los parámetros a ser inferior a 10%. A pesar de que el método por lo tanto puede ser considerado como robusta, algu…
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
The authors are grateful to Dr. Thomas Rademacher and Ibrahim Al Amedi for cultivating the plants used in this study. We would like to thank Dr. Richard M. Twyman for his assistance with editing the manuscript. This work was in part funded by the European Research Council Advanced Grant “Future-Pharma”, proposal number 269110, the Fraunhofer Zukunftsstiftung (Future Foundation), the Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 1" tube | Thorlabs | SM1L10E | Tube for fiber holder |
| Agarose | Sigma Aldrich | A0701 | Agarose |
| Bi-Convex lense f=25.4 | Thorlabs | LB1761 | Lense |
| Digital Handheld Optical Power and Energy Meter Console | Thorlabs | PM100D | Console for thermal surface absorber sensor |
| Digital Phosphor Oscilloscope | Tektronix | DPO7104 | Oscilloscope |
| DMR light microscope | Leica | n.a. | Light microscope |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-2 | Pycnometer |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Fiber holder | Thorlabs | Fiber holder | |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Infrared Detector Optris CT | Optris | OPTCTLT15 | Infrared detector |
| Infrared Detector Software Compact Connect | Optris | n.a. | Control software for infrared detector |
| Lambda 1050 UV/Vis spectrophotometer | PerkinElmer | L1050 | UV/VIS Spectrophotometer |
| Laser 400μm, 1550nm Conduction Cooled Single Bar Fiber Coupled Module | DILAS | M1F-SS2.1 | Laser |
| Laser cover | Amtron | LM200 | Laser Cover |
| Laser Driver | Amtron | CS 408 | Laser Driver |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Photodiode sensor | Thorlabs | PDA20H-EC | Power sensor for transmission measurements |
| Precision weight Ohaus Analytical Plus | Ohaus | 80251552 | Precision weight |
| Sample frame | Fraunhofer ILT | n.a. | Fixation of the leaf sample |
| Software Pyro Control | Amtron | n.a. | Laser Power Control Software |
| Stainless-steel-holder | n.a. | n.a. | Holder for measurement set-up |
| Teflon plates 2cm | Fraunhofer ILT | n.a. | Teflon attenuation |
| Thermal surface absorber Power sensor | Thorlabs | S314C | Sensor for laser power measurements |
| Vibratome | Leica | 1491200S001 | Vibratome |
| Zoc/Pro 6.51 | EmTec Innovative Software | n.a. | Laser Control Software |
Referenzen
- Wilhelm, E. . Heat Capacities: Liquids, Solutions and Vapours. , 516 (2010).
- Costa, J. M., Grant, O. M., Chaves, M. M. Thermography to explore plant-environment interactions. J. Exp. Bot. 64, 3937-3949 (2013).
- Jayalakshmy, M. S., Philip, J. Thermophysical Properties of Plant Leaves and Their Influence on the Environment Temperature. International Journal of Thermophysics. 31, 2295-2304 (2010).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Schuster, A. C., et al. Effectiveness of cuticular transpiration barriers in a desert plant at controlling water loss at high temperatures. AoB PLANTS. 8, (2016).
- Parker, W. J., Jenkins, R. J., Abbott, G. L., Butler, C. P. Flash Method of Determining Thermal Diffusivity, Heat Capacity, and Thermal Conductivity. J Appl Phys. 32, 1679-1684 (1961).
- Hays, R. L. The thermal conductivity of leaves. Planta. 125, 281-287 (1975).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Hubbuch, J., Fischer, R. Blanching intact leaves or heat precipitation in an agitated vessel or heat exchanger removes host cell proteins from tobacco extracts. J. Vis. Exp. , (2015).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Buyel, J. F., Gruchow, H. M., Tödter, N., Wehner, M. Determination of the thermal properties of leaves by non-invasive contact free laser probing. J. Biotechnol. 217, 100-108 (2016).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Hedlund, H., Johansson, P. Heat capacity of birch determined by calorimetry: implications for the state of water in plants. Thermochim Acta. 349, 79-88 (2000).
- Chandrakanthi, M., Mehrotra, A. K., Hettiaratchi, J. P. A. Thermal conductivity of leaf compost used in biofilters: An experimental and theoretical investigation. Environ. Pollut. 136, 167-174 (2005).
- Larcher, W. . Physiological Plant Ecology: Ecophysiology and Stress Physiology of Functional Groups. , (2003).
- Cowen, R. A gamma-ray burst’s enduring fireball. Science News. 152, 197 (1997).
- Jones, H. G., et al. Thermal infrared imaging of crop canopies for the remote diagnosis and quantification of plant responses to water stress in the field. Funct. Plant Biol. 36, 978-989 (2009).
- Defraeye, T., Verboven, P., Ho, Q. T., Nicolai, B. Convective heat and mass exchange predictions at leaf surfaces: Applications, methods and perspectives. Comput. Electron. Agric. 96, 180-201 (2013).
- Arndt, S. K., Irawan, A., Sanders, G. J. Apoplastic water fraction and rehydration techniques introduce significant errors in measurements of relative water content and osmotic potential in plant leaves. Physiol. Plant. 155, 355-368 (2015).
- Jones, H. G., Schofield, P. Thermal and other remote sensing of plant stress. General and Applied Plant Physiology. 34, 19-32 (2008).
- Jones, H. G., Archer, N., Rotenberg, E., Casa, R. Radiation measurement for plant ecophysiology. J. Exp. Bot. 54, 879-889 (2003).
- Dupont, C., Chiriac, R., Gauthier, G., Toche, F. Heat capacity measurements of various biomass types and pyrolysis residues. Fuel. 115, 644-651 (2014).
- Chaerle, L., et al. Multi-sensor plant imaging: Towards the development of a stress-catalogue. Biotechnol. J. 4, 1152-1167 (2009).
- Hackl, H., Baresel, J. P., Mistele, B., Hu, Y., Schmidhalter, U. A Comparison of Plant Temperatures as Measured by Thermal Imaging and Infrared Thermometry. J. Agron. Crop. Sci. , 415-429 (2012).
- Yuan, L., et al. Spectral analysis of winter wheat leaves for detection and differentiation of diseases and insects. Field Crops Res. 156, 199-207 (2014).

