ثلاثي الأبعاد ثقافة الفحص لاستكشاف سرطان الغازية خلية والأقمار الصناعية ورم تشكيل
Summary
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
Abstract
يستخدم على نطاق واسع الثقافة خلايا الثدييات في الطبقات الوحيدة لدراسة مختلف العمليات الفسيولوجية والجزيئية. ومع ذلك، فإن هذا النهج لدراسة نمو الخلايا غالبا ما يولد الآثار غير المرغوب فيها. ولذلك، زراعة الخلايا في (3D) بيئة ثلاثية الأبعاد، وغالبا ما تستخدم مكونات المصفوفة خارج الخلية، ظهرت كبديل للاهتمام بسبب التشابه الوثيق للمواليد في أنسجة الجسم الحي أو الجهاز. قمنا بتطوير نظام زراعة الخلايا 3D باستخدام اثنين من مقصورات، وهما (ط) في المقصورة المركزية التي تحتوي على الخلايا السرطانية جزءا لا يتجزأ من التمثيل جل الكولاجين وجود ورم macrospherical الزائفة الأساسي و (ب) حجرة خالية من الخلايا الطرفية المصنوعة من هلام الليفين، أي عنصر المصفوفة خارج الخلية مختلفة عن تلك المستخدمة في المركز، والتي الخلايا السرطانية يمكن ترحيل (غزو الجبهة) و / أو تشكل الأورام microspherical تمثل أورام ثانوية أو الأقمار الصناعية. تشكيل الأورام الأقمار الصناعية في المقصورة المحيطيةالمترابطة بشكل ملحوظ إلى العدوانية المعروفة أو الأصل المنتشر من الخلايا السرطانية الأم، مما يجعل هذا النظام الثقافة 3D فريدة من نوعها. قد يعتبر هذا النهج زراعة الخلايا لتقييم السرطان غزو الخلية والحركة، والتفاعلات مصفوفة الخلايا خارج الخلية وكوسيلة لتقييم خصائص للأدوية المضادة للسرطان.
Introduction
التحقيق في الخصائص الأساسية والطبية الحيوية من غزو الخلايا السرطانية / الهجرة وإنشاء ورم خبيث لاحقا هو موضوع من 1،2 أبحاث مكثفة. الانبثاث هي المرحلة النهائية من السرطان وتبقى إدارتها السريرية بعيد المنال. وهناك فهم أفضل لورم خبيث على المستويات الخلوية والجزيئية تمكن من تطوير علاجات أكثر فعالية 3.
يمكن استكشاف العديد من الخصائص من الخلايا المتنقل في المختبر 4 بما في ذلك stemness وإمكاناتهم للحصول على الحالة الانتقالية (على سبيل المثال،-شبيه الظهارة الوسيطة الانتقالية) لترحيل وغزو داخل ومن الورم الرئيسي 5. ومع ذلك، فإن التقييم في المختبر من العمليات / ورم خبيث الغزو تحديا لأنه يستثني عمليا مساهمة الدم / الدورة اللمفاوية. الثقافات عضوي النمط أن تضمين شظايا ورم في المواد الهلامية الكولاجين لها بريفيوخبيث تم استخدامها لرصد سرطان العدوانية. وعلى الرغم من الحفاظ على تعقيد الأورام (على سبيل المثال، وجود خلايا غير سرطانية)، تتعرض أجزاء الورم لنشر المتوسطة محدود، لاختلاف أخذ العينات، وإلى فرط نمو خلايا انسجة 6. يتكون طريقة بديلة في زراعة الخلايا السرطانية ضمن مكونات المصفوفة خارج الخلية (ECM)، الذي يحاكي ثلاثية الأبعاد (3D) بيئة الخلية. انتشار خطوط خلايا سرطان الثدي في هلام الكولاجين و / أو مصفوفة المستمدة غشاء الطابق السفلي هو من بين الأمثلة أفضل وصف للثقافة خلية 3D. باستخدام بيئات محددة ثقافة الخلية 3D، والتجمع غير منظم لوحظت في خلايا سرطان الثدي نمت في ظل ظروف قياسية يمكن عكسها إلى تشكيل عفوية من عنيبات الثديية والهياكل الأنبوبية 7-10. وعلاوة على ذلك، وتشكيل الأجسام الشبه الكروية المتعددة الخلايا السرطانية المشتقة من الخلايا السرطانية غدية تجمعوا باستخدام تقنيات مختلفة (على سبيل المثال، والشنق قطرات، الكروية العائمة، أجار الغرز) يشكل الآن الأكثر شيوعا خلية 3D ثقافة الفحص 11-13. ومع ذلك، هذا الاختبار محدودة بسبب مجموعة محدودة من خطوط الخلايا السرطانية التي يمكن أن تشكل الكروية والفترة القصيرة المتاحة لدراسة الخلايا في هذه الظروف.
في هذه التقنية تصور، ونحن هنا إدخال خلية 3D فحص ثقافة متطورة حيث هي جزء لا يتجزأ الخلايا السرطانية من الفائدة في جل الكولاجين للسماح للتشكيل في المختبر وجود ورم شبه الأساسي الذي يمكن أن تطلى بدلا من ذلك مع قبو مصفوفة المشتقة من الغشاء. تشكلت مرة واحدة، ثم يتم رطة الورم شبه أساسي في مصفوفة ديكي (هلام الليفين في هذه الحالة)، والذي يسمح للخلايا السرطانية عبر واجهة بين المقصورات مصفوفة اثنين (انظر الشكل 1). ومن المثير للاهتمام، ويبدو أن هياكل تشبه الورم الثانوية الناشئة من الورم الزائفة الأساسي جنبا إلى جنب مع الخلايا السرطانية العدوانية فيهلام الليفين. يوفر هذا النظام الثقافة 3D المرونة المطلوبة للتحقيق، على سبيل المثال، الأدوية المضادة للسرطان، التعبير الجيني وخلية خلية و / أو التفاعلات خلية ECM 14-16.
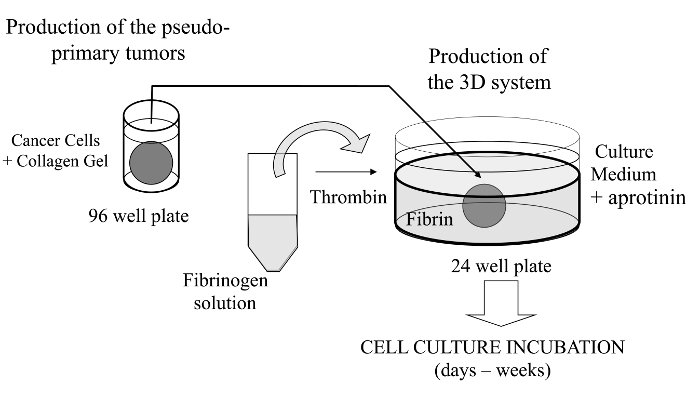
الشكل 1: لمحة عامة عن أسلوب ملخص تخطيطي لطريقة لتوليد خلية نظام الثقافة 3D كنموذج لدراسات السرطان الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
كما حاشية فنية مهمة، فمن الضروري أن توجد فجوة موجودة في واجهة بين الحكومة المركزية والمواد الهلامية الطرفية. خلاف ذلك، قد يقلل من قدرة الخلايا على الهجرة / غزو الجل الليفين. مسافة بين الكولاجين والمواد الهلامية الليفين قد تشكل خلال ال 24 ساعة الأولى للثقافة إذا الثروم…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
Materials
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65-85% protein with ≥75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5-10TIU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
References
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).

