Трехмерный культура анализа для изучения раковых клеток инвазивности и Satellite Опухоль Формирование
Summary
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
Abstract
Млекопитающим культуры клеток в монослоях широко используется для изучения различных физиологических и молекулярных процессов. Тем не менее, этот подход к изучению растущие клетки часто создает нежелательные артефакты. Таким образом, культура клеток в трехмерной (3D) окружающей среды, часто с использованием компонентов внеклеточного матрикса, возникла как интересную альтернативу из – за его близкое сходство с нативным в естественных условиях ткани или органа. Мы разработали систему культивирования клеток 3D с использованием двух отсеков, а именно : (I) центральный отсек , содержащий раковые клетки , внедренные в коллагеновый гель , действующего в качестве псевдо-первичной macrospherical опухоли и (II) периферийную бесклеточной отсеком , изготовленным из фибринового геля, т.е. внеклеточный матричный компонент отличается от используемого в центре, в котором раковые клетки могут мигрировать (фронт вторжения) и / или форме микросферических опухоли , представляющие вторичные или спутниковые опухоли. Формирование спутниковых опухолей в периферийном отделении являетсяудивительно коррелировало с известным агрессивностью или метастатического происхождения нативных опухолевых клеток, что делает эту систему 3D культуры уникальна. Эта культура подход клеток может рассматриваться для оценки инвазивность раковых клеток и моторику, клеточно-внеклеточный матрикс взаимодействий и в качестве метода оценки свойств лекарств против рака.
Introduction
Исследование фундаментальных и медико – биологические характеристики раковых клеток вторжения / миграции и последующее создание метастазирования является предметом интенсивных исследований в 1,2 раза . Метастазы является конечной стадией рака и его клиническое управление остается неуловимым. Лучшее понимание метастазирования на клеточном и молекулярном уровнях будет способствовать развитию более эффективных методов лечения 3.
Некоторые свойства метастатических клеток могут быть изучены в пробирке 4 , включая их стволовости и потенциал , чтобы приобрести переходное состояние (например, эпителиоидная-мезенхимальных перехода) мигрировать и вторгнуться внутри , так и от первичной опухоли 5. Тем не менее, оценка в пробирке процессов / метастазирования вторжения было проблемой , поскольку она практически исключает вклад крови / лимфы. Органотипической культуры, которые встраивать фрагменты опухоли в коллагеновые гели Previouхитрая используются для мониторинга рака агрессивностью. Хотя сложность опухолей сохраняется (например, наличие незлокачественных клеток), фрагменты опухоли подвергаются ограниченной средней диффузии, к вариации выборки, и чрезмерно быстрый рост стромальных клеток 6. Альтернативный метод состоит в выращивании раковых клеток в пределах компонентов внеклеточного матрикса (ECM), который имитирует трехмерную (3D) среды клеток. Распространение линий клеток рака молочной железы в коллагеновый гель и / или базальную мембрану, полученной матрицы является одним из лучших охарактеризованных примеров культуры 3D-клеток. При использовании конкретных условий 3D культуры клеток, неупорядоченная сборка наблюдается для клеток рака молочной железы , выращенных в стандартных условиях может быть обращено к спонтанному образованию молочных желез ацинусов и трубчатых структур 7-10. Кроме того, образование многоклеточных опухолевых сфероидов, полученных из раковых клеток аденокарциномы скопились с использованием различных методов (например, висячей капли, плавающие сфероиды, агар заделки) в настоящее время является наиболее широко используемой культуры анализа 3D – клеток 11-13. Тем не менее, этот анализ ограничивается ограниченным набором линий раковых клеток, которые могут образовывать сфероиды и в течение короткого периода, доступной для изучения клеток в этих условиях.
В этом визуализируется техники, мы здесь , ввести сложный анализ культуры 3D клеток , где раковые клетки , представляющие интерес , внедренный в коллагеновый гель , чтобы позволить образование в пробирке псевдояруса первичной опухоли , которые могут быть в качестве альтернативы покрыта мембраной полученные матрицы базальной. После образования псевдо-первичная опухоль затем зажатой в бесклеточной матрицы (фибринового геля в данном случае), что позволяет раковым клеткам пересекает границу раздела между двумя матричными отсеков (см рисунок 1). Интересно отметить, что вторичные опухолевые-подобные структуры, происходящие из псевдо-первичной опухоли наряду с агрессивными раковыми клетками появляются вфибрина гель. Такая система 3D культуры обеспечивает гибкость , необходимую для исследования, например, противоопухолевые препараты, экспрессия генов и межклеточных и / или клеточно-ECM взаимодействий 14-16.
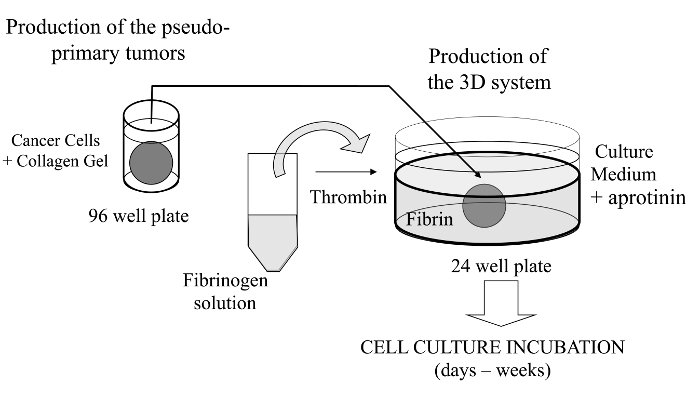
Рисунок 1:.. Обзор методов Схематическое описание способа сформировать систему культивирования клеток 3D в качестве модели для исследования рака Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Protocol
Representative Results
Discussion
В качестве важной технической сноске, важно, чтобы никакого зазора не присутствует на границе раздела между центральным и периферийным гелей. В противном случае это может привести к уменьшению способности клеток к миграции / вторжению гель фибрина. Пространство между коллагеном и гел?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
Materials
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65-85% protein with ≥75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5-10TIU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
References
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).

