Three-Dimensional Culture Assay pour explorer des cellules cancéreuses invasives et Tumor Satellite Formation
Summary
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
Abstract
culture de cellules animales dans des monocouches est largement utilisé pour étudier divers processus physiologiques et moléculaires. Cependant, cette approche pour étudier les cellules en croissance génère souvent des artefacts indésirables. Par conséquent, la culture de cellules dans un (3D) de l' environnement en trois dimensions, souvent en utilisant des composants de la matrice extracellulaire, est apparue comme une alternative intéressante en raison de sa similitude avec le natif dans un tissu ou un organe in vivo. Nous avons développé un système de culture cellulaire 3D à l' aide de deux compartiments, à savoir : (i) un compartiment central contenant des cellules cancéreuses noyées dans une faisant office de gel de collagène comme une tumeur macrospherical pseudo-primaire et (ii) un compartiment acellulaire périphérique constituée d'un gel de fibrine, soit un composant de la matrice extracellulaire différent de celui utilisé dans le centre, dans lequel les cellules cancéreuses peuvent migrer (invasion avant) et / ou de former des tumeurs microsphériques qui représentent les tumeurs secondaires ou satellites. La formation de tumeurs par satellite dans le compartiment périphérique estremarquablement en corrélation avec l'agressivité connue ou d'origine métastatique des cellules tumorales d'origine, ce qui rend ce système de culture 3D unique. Cette méthode de culture des cellules peut être considérée pour évaluer le cancer invasif et de la motilité des cellules, les interactions cellule-matrice extracellulaire et une méthode pour évaluer les propriétés des médicaments anti-cancéreux.
Introduction
L' étude des caractéristiques fondamentales et biomédicales de l' invasion des cellules cancéreuses / migration et l' établissement de métastases ultérieures est l'objet d'un 1,2 de recherche intense. Métastase est le stade ultime du cancer et de sa prise en charge clinique reste insaisissable. Une meilleure compréhension des métastases aux niveaux cellulaires et moléculaires permettra le développement de thérapies plus efficaces 3.
Plusieurs propriétés des cellules métastatiques peuvent être explorées 4 in vitro , y compris leur stemness et le potentiel d'acquérir un état de transition (par exemple, la transition épithélio-mésenchymateuse) à migrer et à envahir et à l'intérieur de la tumeur primaire 5. Toutefois, l'évaluation in vitro de processus / de métastases d'invasion a été un défi , car il exclut pratiquement la contribution du sang / circulation lymphatique. cultures organotypiques qui intègrent des fragments de tumeur dans des gels de collagène ont Previously été utilisé pour surveiller l'agressivité du cancer. Bien que la complexité des tumeurs est conservée (par exemple, la présence de cellules non cancéreuses), des fragments de tumeur sont exposées à une diffusion moyenne limitée à une variation d'échantillonnage et à une prolifération de cellules stromales 6. Une méthode alternative consiste dans les cellules cancéreuses en croissance au sein des composants de la matrice extracellulaire (ECM), qui imite la (3D) de l'environnement de la cellule à trois dimensions. La prolifération des lignées de cellules de cancer du sein dans un gel de collagène et / ou une matrice de membrane basale dérivé est parmi les exemples les mieux caractérisés de la culture de cellules 3D. En utilisant des milieux de culture cellulaire 3D spécifiques, l'ensemble désorganisé observée pour les cellules cancéreuses du sein cultivées dans des conditions standard peut être inversé pour la formation spontanée d'acini mammaires et des structures tubulaires 7-10. En outre, la formation de sphéroïdes de tumeur multicellulaires dérivées de cellules cancéreuses d'adénocarcinome rassemblés en utilisant différentes techniques (par exemple, la pendaison gouttes, sphéroïdes flottante, agar embedment) constitue désormais la cellule 3D culture test le plus couramment utilisé 11-13. Cependant, cet essai est limité par l'ensemble limité de lignées cellulaires cancéreuses qui peuvent former des sphéroïdes et par la courte période disponible pour étudier les cellules dans ces conditions.
Dans cette technique visualisée, nous ici introduire un dosage de culture cellulaire 3D sophistiqué où les cellules cancéreuses d'intérêt sont incorporés dans un gel de collagène pour permettre la formation in vitro d'une tumeur pseudo-primaire qui peut être alternativement revêtue d'une membrane – matrice dérivée de sous – sol. Une fois formée, la tumeur pseudo-primaire est alors prise en sandwich dans une matrice acellulaire (gel de fibrine dans le cas présent), ce qui permet aux cellules cancéreuses de traverser l'interface entre les deux compartiments de la matrice (voir figure 1). Fait intéressant, des structures ressemblant à des tumeurs secondaires issues de la tumeur pseudo-primaire ainsi que des cellules cancéreuses agressives apparaissent dans leun gel de fibrine. Un tel système de culture 3D offre la flexibilité nécessaire pour enquêter sur , par exemple, les médicaments anticancéreux, expression génique et cellule-cellule et / ou les interactions cellule-ECM 14-16.
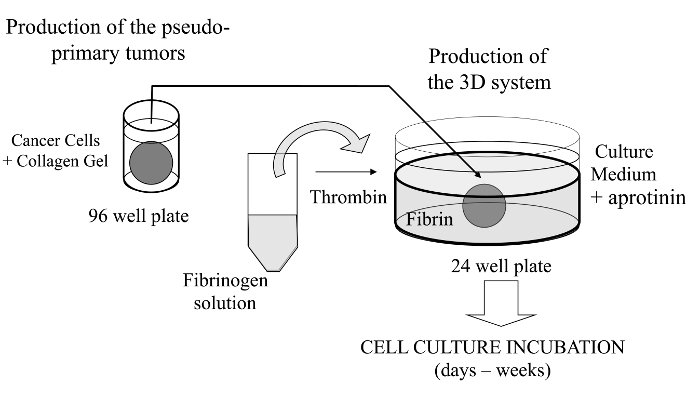
Figure 1:.. Vue d' ensemble de la méthode résumé schématique de la méthode pour générer le système de culture cellulaire 3D comme un modèle pour les études sur le cancer S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Protocol
Representative Results
Discussion
Comme une note technique important, il est essentiel qu'aucun écart est présent à l'interface entre la centrale et les gels périphériques. Dans le cas contraire, il pourrait réduire la capacité des cellules à migrer / envahissent le gel de fibrine. Un espace entre le collagène et les gels de fibrine peuvent se former pendant les 24 premières heures de la culture si la thrombine n'a pas été dilué de manière appropriée. Il est également possible que la lignée cellulaire testée pourrait entra?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
Materials
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65-85% protein with ≥75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5-10TIU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
References
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).

