Driedimensionale Culture Assay te ontdekken Cancer Cell Invasiviteit en Satellite tumorvorming
Summary
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
Abstract
Zoogdiercelcultuur in monolagen wordt algemeen gebruikt om diverse fysiologische en moleculaire processen te bestuderen. Echter, deze benadering van de groeiende cellen te bestuderen genereert vaak ongewenste artefacten. Daarom celkweek in een driedimensionale (3D) omgeving, vaak met behulp van extracellulaire matrixcomponenten, zich tot een interessant alternatief vanwege de grote gelijkenis met de natuurlijke in vivo weefsel of orgaan. We ontwikkelden een 3D celkweek systeem met twee compartimenten, namelijk (i) een centraal compartiment met kanker cellen ingebed in een collageen gel werkt als een pseudo-primaire macrospherical tumor en (ii) een perifere celvrije compartiment gemaakt van een fibrine gel, dat wil zeggen een extracellulaire matrix component verschilt van die in het centrum, die kankercellen kunnen migreren (invasie vooraan) en / of vormen microsferische tumoren die secundaire of satelliet tumoren. De vorming van satelliet tumoren in het perifere compartimentopvallend gecorreleerd aan de bekende agressiviteit metastatische oorsprong van de natieve tumorcellen die deze 3D kweeksysteem uniek. Deze celkweek benadering kan worden gesteld kankercel invasiviteit en motiliteit, cel-extracellulaire matrix interacties als een methode om antikankergeneesmiddel eigenschappen evaluatie uitgevoerd.
Introduction
De fundamenteel biomedische kenmerken van kankercel invasie / migratie en daaropvolgende metastase inrichting is het onderwerp van intens onderzoek 1,2. Metastase is de ultieme fase van kanker en de klinische behandeling blijft ongrijpbaar. Een beter begrip van metastase op cellulair en moleculair niveau zal de ontwikkeling van efficiëntere therapieën 3 mogelijk.
Verschillende eigenschappen van metastatische cellen kan worden verkend in vitro 4 met inbegrip van hun stemness en potentieel om een overgang staat (bv epithelioid-mesenchymale transitie) te verwerven om te migreren en binnenvallen in en uit de primaire tumor 5. Echter, de in vitro beoordeling van de invasie / metastasering processen een uitdaging sinds het vrijwel exclusief de bijdrage van het bloed / lymfatische circulatie. Organotypische culturen die tumor fragmenten insluiten in collageen gels hebben Previously gebruikt om kanker agressiviteit controleren. Hoewel de complexiteit van tumoren wordt bewaard (bijvoorbeeld de aanwezigheid van niet-kankercellen), tumorfragmenten blootgesteld aan beperkte diffusie medium, steekproeven variatie, en een overmatige groei van bindweefselcellen 6. Een alternatieve werkwijze bestaat erin groeiende kanker cellen in componenten van de extracellulaire matrix (ECM), die de driedimensionale (3D) celomgeving nabootst. De proliferatie van borstkankercellijnen in een collageen gel en / of basismembraan-afgeleide matrix onder de meest bestudeerde voorbeelden van 3D celkweek. Door het gebruik van specifieke 3D celcultuur-omgevingen, kan het ongeorganiseerd assemblage waargenomen voor borstkankercellen gekweekt onder standaard omstandigheden worden omgekeerd om de spontane vorming van de melkklieren acini en buisvormige structuren 7-10. Bovendien is de vorming van multicellulaire bolvormige tumoren afgeleid van adenocarcinoom cellen bijeen met verschillende technieken (bijvoorbeeld, opknoping druppels, drijvende bolletjes, agar inbedding) Nu vormt de meest gebruikte 3D celcultuur assay 11-13. Maar deze assay beperkt door de beperkte set kankercellijnen die sferoïden kunnen vormen en de korte periode om cellen te bestuderen in deze voorwaarden.
In dit gevisualiseerd techniek we hierin introduceren geavanceerde 3D celkweektest wanneer kankercellen plaats zijn ingebed in een collageengel om de in vitro vorming van een pseudo-primaire tumor die als alternatief kan worden bekleed met een kelder membraan-afgeleide matrix mogelijk. Eenmaal gevormd wordt de pseudo-primaire tumor dan ingeklemd in een acellulair matrix (fibrine gel in het onderhavige geval), waardoor de kankercellen aan het grensvlak tussen de twee compartimenten matrix kan passeren (zie figuur 1). Interessant secundaire tumor-achtige structuren afkomstig van de pseudo-primaire tumor met agressieve kankercellen verschijnen in hetfibrinegel. 3D dergelijk teeltsysteem biedt de vereiste flexibiliteit te onderzoeken, bijvoorbeeld antikankergeneesmiddelen, genexpressie en cel-cel en / of cel-ECM interacties 14-16.
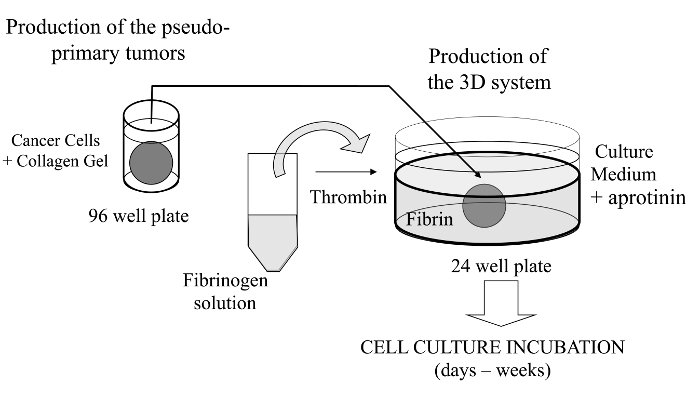
Figuur 1:.. Overzicht van de methode Schematisch overzicht van de methode om de 3D-celcultuur systeem als een model voor kanker studies genereren Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Als belangrijke technische voetnoot, is het essentieel dat geen ruimte bij het grensvlak tussen de centrale en perifere gelen. Anders kan het het vermogen van de cellen om te migreren / binnenvallen fibrinegel verminderen. Een ruimte tussen het collageen en fibrine gels kunnen gedurende de eerste 24 uur van de cultuur vormen indien trombine niet correct werd verdund. Het is ook mogelijk dat de cellijn getest kan de collageengel tot krimpen tijdens kweken, waarbij een relatief grote ruimte waardoor vormen tussen beide ge…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
Materials
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65-85% protein with ≥75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5-10TIU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
References
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).

