암 세포 침윤 및 위성 종양 형성을 탐색하는 문화 분석 세 가지 차원
Summary
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
Abstract
단일 층에서 포유 동물 세포 배양 널리 다양한 생리 학적 및 분자 과정을 연구하는 데 사용됩니다. 그러나 성장 세포를 연구하는이 방법은 종종 원치 않는 아티팩트를 생성합니다. 따라서, 주로 세포 외 기질 성분을 사용하여 3 차원 (3D) 환경에서 세포 배양이 때문에 생체 조직 또는 기관에서 고유로 그 유사성 흥미로운 대안으로 나타났다. 우리는 피브린 겔 이루어지는 의사 차 macrospherical 종양 및 (ⅱ) 주연 무 세포 격실 콜라겐 겔 연기에 포함 된 암 세포를 함유하는 중앙 구획 개의 구획, 즉 (i)를 이용하여 3 차원 세포 배양 시스템을 개발 즉, 센터에서 사용되는 다른 세포 외 매트릭스 성분이있는 암세포 마이그레이션 (내습 전면) 및 / 또는 보조 위성을 나타내는 종양 microspherical 종양을 형성 할 수있다. 주변 구획 위성 종양의 형성은이 현저 차원 배양 시스템의 차별화 네이티브 종양 세포의 공지 공격성 또는 전이성 기원 상관. 이 세포 배양 방법은 암 세포의 침윤과 운동성, 세포 외 기질의 상호 작용 및 항암 약물의 특성을 평가하는 방법으로 평가하는 것으로 간주 될 수있다.
Introduction
암 세포 침공 / 마이그레이션 및 후속 전이 설립의 기본 및 생물 의학 특성을 조사하는 강렬한 연구 1, 2의 주제이다. 전이 암의 최종 단계이며, 임상 관리하기 어려운 남아있다. 세포 및 분자 수준에서의 전이에 대한 이해는보다 효율적인 치료 (3)의 개발을 가능하게한다.
전이성 세포의 여러 특성은 자신의 stemness 및 마이그레이션 내에서 기본 종양 5 침공 전이 상태 (예를 들면, 상피 – 중간 엽 전이를) 획득 가능성을 포함하여 시험 관내 4 탐험 할 수 있습니다. 그것은 거의 혈액 / 림프 순환의 기여를 배제하기 때문에, 내습 / 전이 과정의 시험 관내 평가는 도전하고있다. 콜라겐 젤에 종양 조각을 삽입의 Organotypic 문화는 기존에 가지고교활한 암의 공격성을 모니터링하는 데 사용되었다. 종양의 복잡도가 보존되어 있지만 (예를 들면, 비 – 암성 세포의 존재), 종양 절편 샘플링 변동 제한된 확산 매체에 노출 및 기질 세포 (6)의 과도한 성장한다. 대안적인 방법은 3 차원 셀 환경을 모방 세포 외 기질 (ECM)의 구성 요소 내에서의 암세포 성장에있다. 콜라겐 겔 및 / 또는 기저막 유래 매트릭스 유방암 세포주의 증식 차원 세포 배양의 가장 특징으로하는 실시 예 사이이다. 특정 3 차원 세포 배양 환경을 사용하여 표준 조건 하에서 성장 유방암 세포에 대해 관찰 된 무질서 조립체 유방 꽈리 및 관상 구조 7-10의 자연 형성에 역전 될 수있다. 또한, 선암종 암세포 유래의 다세포 종양 타원체의 형성은 (서로 다른 기술을 이용하여 군집예를 들면, 현재 가장 일반적으로 사용되는 3 차원 세포 배양 분석법 11-13을 구성하는) 매립 한천, 타원체, 플로팅 방울 매달려. 그러나 이러한 분석은 구 상체를 형성 할 수있는 암 세포주의 제한된 세트에 의해 이러한 조건에서 세포를 연구 할 수 짧은 기간에 의해 제한된다.
이러한 시각화 방법에서, 우리는 본 명세서에서 관심있는 암세포 대안 기저막 유래 매트릭스로 피복 될 수있는 의사 원발 종양의 체외 형성을 허용하기 위해 콜라겐 겔에 포함 된 정교한 3D 세포 배양 분석을 소개한다. 형성되면, 가상 기본 종양 후 암세포 두 매트릭스 구획과의 계면을 통과 할 수있는 무 세포 기질 (본 경우 피브린 겔)에 끼워진다 (도 1 참조). 흥미롭게 공격적인 암세포와 함께 의사 원발 종양 유래 이차 종양 같은 구조가 나타나지섬유소 젤. 이러한 3 차원 배양 시스템은 예를 들어, 항암제, 유전자 발현 및 세포 – 세포 및 / 또는 세포 ECM 상호 14-16 조사하는 필요한 유연성을 제공한다.
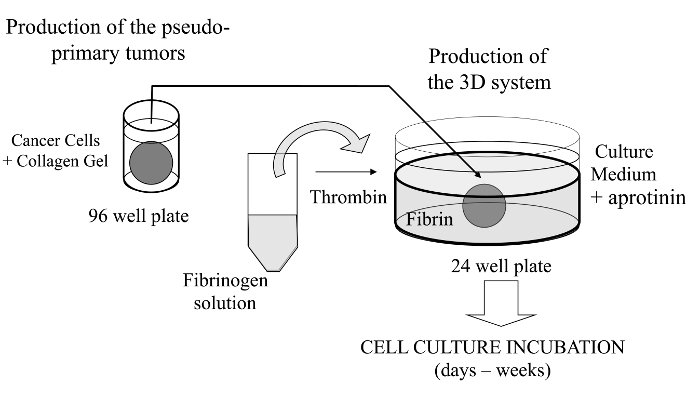
그림 1 :.. 방법의 개요 암 연구를위한 모델로 3D 세포 배양 시스템을 생성하는 방법의 도식 요약 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
중요한 기술적 각주, 갭 중앙과 주변 겔 사이의 계면에 존재하지 않는 것이 중요하다. 그렇지 않으면 / 마이그레이션 피브린 겔 침투하는 전지의 용량을 줄일 수있다. 트롬빈 적절히 희석되지 않은 경우 콜라겐과 피브린 겔 사이의 공간은 배양의 처음 24 시간 동안 형성 할 수도있다. 콜라겐 겔을 초래할 수 시험 세포주 모두시켜 겔 사이에 형성하기 위해 상대적으로 큰 공간을 일으키는 동안 배양 …
Divulgations
The authors have nothing to disclose.
Acknowledgements
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
Materials
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65-85% protein with ≥75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5-10TIU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
References
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).

