Detectie van abnormaal prioneiwit door immunohistochemie
Summary
Immunolabeling van abnormaal prioneiwit met behulp van immunohistochemieprotocollen vereist specifieke monster- en anti-PrP-antilichaamvoorbereidingsmethoden. Het huidige protocol beschrijft de belangrijkste stappen in epitoopontmaskering om te zorgen voor een goede PrP-immunolabeling en om niet-specifieke achtergrondkleuring te minimaliseren. Ook houdt deze benadering rekening met bioveiligheidsmaatregelen bij het uitvoeren van immunohistochemische studies met de prion-geïnfecteerde weefsels.
Abstract
Abnormale prioneiwitten (PrPSc) zijn de ziekte-geassocieerde isovorm van cellulair prioneiwit en diagnostische markers van overdraagbare spongiforme encefalopathieën (TSE’s). Deze neurodegeneratieve ziekten treffen mensen en verschillende diersoorten en omvatten scrapie, zoönotische boviene spongiforme encefalopathie (BSE), chronische verspillingsziekte van hertachtigen (CWD) en de nieuw geïdentificeerde kameel prionziekte (CPD). De diagnose van TSE’s is gebaseerd op immunodetectie van PrPSc door toepassing van zowel immunohistochemie (IHC) als westerse immunoblotmethoden (WB) op encefalonweefsels, namelijk de hersenstam (obex-niveau). IHC is een veelgebruikte methode die primaire antilichamen (monoklonaal of polyklonaal) gebruikt tegen antigenen van belang in cellen van een weefselsectie. De antilichaam-antigeenbinding kan worden gevisualiseerd door een kleurreactie die gelokaliseerd blijft in het gebied van het weefsel of de cel waar het antilichaam op gericht was. Als zodanig worden bij prionziekten, net als in andere onderzoeksgebieden, de immunohistochemische technieken niet alleen gebruikt voor diagnostische doeleinden, maar ook in pathogenesestudies. Dergelijke studies omvatten het detecteren van de PrPSc-patronen en -typen van de eerder beschreven patronen om de nieuwe prionstammen te identificeren. Aangezien BSE mensen kan infecteren, wordt aanbevolen dat faciliteiten en/of praktijken van bioveiligheidslaboratoria niveau 3 (BSL-3) worden gebruikt voor het hanteren van monsters van runderen, kleine herkauwers en hertachtigen die in de TSE-bewaking zijn opgenomen. Daarnaast worden containment en prion-dedicated apparatuur aanbevolen, waar mogelijk, om verontreiniging te beperken. De PrPSc IHC-procedure bestaat uit een mierenzuur epitoop-deasking stap die ook fungeert als een prion-inactivatiemaatregel, omdat formaline-gefixeerde en paraffine-ingebedde weefsels die in deze techniek worden gebruikt, besmettelijk blijven. Bij het interpreteren van de resultaten moet ervoor worden gezorgd dat niet-specifieke immunolabeling wordt onderscheiden van doeletikettering. Voor dit doel is het belangrijk om artefacten van immunolabeling te herkennen die zijn verkregen in bekende TSE-negatieve controledieren om die te onderscheiden van specifieke PrP Sc-immunolabelingtypen, die kunnen variëren tussen TSE-stammen, gastheersoorten en prnp-genotype, verder hierin beschreven.
Introduction
Volgens de prionhypothese is de abnormale isovorm (PrPSc) de primaire of enige component van het infectieuze agens in overdraagbare spongiforme encefalopathieën (TSE’s). Bevestiging voor de diagnose van TSE is gebaseerd op immunodetectie van PrPSc door toepassing van immunohistochemie (IHC) protocollen en/of westerse immunoblotmethoden (WB) van encefalonweefsels1.
IHC is een methode waarbij monoklonale of, in sommige gevallen, polyklonale antilichamen (als primaire antilichamen) worden gebruikt als eerste stap in immunostaining van specifiek gerichte antigenen van belang in cellen van een weefselsectie. Elke effectieve primaire antilichaam-antigeenbinding wordt vervolgens gevisualiseerd met behulp van secundaire antilichamen die specifiek zijn voor de primaire antilichamen. Deze secundaire antilichamen worden geconjugeerd aan enzymen, zoals mierikswortelperoxidase (HRP) of alkalische fosfatase (AP). Visualisatie wordt vervolgens bereikt door een substraat aan deze enzymen toe te voegen, waardoor onoplosbare kleurproducten worden geproduceerd die zijn gelokaliseerd in gebieden waar de primaire antilichamen zijn gebonden aan de beoogde antigenen. Verbeterde visualisatie kan worden bereikt door counterstaining, waarbij een kleurstof wordt gebruikt om een contrast te creëren tussen immunogelabeld en niet-immunogelabeld weefsel2.
Met IHC met behulp van formaline-gefixeerde paraffine-ingebedde weefsels (FFPE), kan formalinefixatie de effectiviteit van primaire antilichamen tenietdoen als gevolg van cross-linking door formaldehyde en verwarming en uitdroging tijdens paraffine-inbedding. Deze veranderen de conformatie van eiwitten, vernietigen, denatureren of maskeren de epitopen, waardoor hun detectie wordt verminderd of ingetrokken3. Als zodanig vereist dit antigeen retrieval (AR). De AR-technieken verstoren formaldehyde-gerelateerde chemische groep cross-linking in de antigene moleculen, waardoor de oorspronkelijke antigeen-eiwitconformatie wordt hersteld of ontmaskerd. Dit resulteert in het herstellen van de antilichaam-antigeen (epitoop) affiniteit voor immunolabeling. De uiteindelijke werkzaamheid van AR hangt af van de kwaliteiten van het beoogde antigeen en/of het primaire antilichaam2.
Heat-induced antigen (epitope) retrieval (HIER) is een procedure van AR3 en wordt routinematig gebruikt voor PrPSc IHC-detectie, zoals hierin beschreven. IHC is essentieel voor de diagnose en wordt gebruikt in onderzoekslaboratoria om de weefselverdeling van een pathologie-geassocieerd antigeen te bepalen. Het wordt veel gebruikt bij het diagnosticeren en onderzoeken van kanker, neurowetenschappen en infectieziekten4, onder anderen. Voor TSE’s speelt IHC een belangrijke rol in diagnose en onderzoek voor het bevestigen en onderzoeken van PrPSc-distributie in natuurlijke gastheren en experimentele modellen. IHC draagt bij aan prionpathogenesestudies en de analyse van PrP Sc-depositietypen en -patronen, namelijk in neurale weefsels5, om afwijkingen van routinematig beschreven infecties te detecteren en vermeende nieuwe prionstammen te identificeren.
Omdat prionen van boviene spongiforme encefalopathie (BSE) de mens kunnen infecteren, kunnen bepaalde laboratoriumprotocollen die betrokken zijn bij het werk met BSE het gebruik van BSL-3-faciliteiten en -praktijken vereisen6. Deze omvatten het gebruik van een verzegelde secundaire container om potentiële met BSE geïnfecteerde weefselmonsters binnen het instituut en het laboratorium te vervoeren. Het omvat ook het aanwijzen van inperkingsgebieden en prionspecifieke apparatuur voor BSE-onderzoek en -analyse, waar mogelijk. Dit wordt gedaan om besmetting buiten het werkgebied te voorkomen en een besloten ruimte te bieden, omdat decontaminatieprocedures noodzakelijk worden.
Dienovereenkomstig volgt het Laboratorium voor Pathologie van INIAV de aanbevolen bioveiligheidsniveau-3 (BSL-3) faciliteiten en praktijken6 om potentiële prion-geïnfecteerde monsters van weefsels van runderen, kleine herkauwers en hertachtigen in verband met de TSE-surveillance te beheren.
Formaline-gefixeerde en paraffine-ingebedde weefsels opgenomen in TSE diagnostische of onderzoeksprocedures, vooral in het centrale zenuwstelsel, kunnen potentieel besmettelijk zijn. Daarom moeten deze vaste weefsels worden behandeld met mierenzuur om de infectiviteit van prionen, indien aanwezig, voorafgaand aan weefselverwerking te verminderen. Dit wordt uitgevoerd door vaste, bijgesneden weefsels (ongeveer 2-4 mm dikte) in een verwerkingscassette te plaatsen. De cassette wordt vervolgens ondergedompeld in 98% mierenzuur (gedurende 1 uur). Na onderdompeling worden de cassettes met weefsels gedurende 30 minuten in stromend leidingwater gewassen en teruggebracht naar het fixatief voor verdere verwerking. Als weefselsecties niet vóór de verwerking worden behandeld, moeten postmicrotomische weefselsecties gedurende ten minste 5 minuten vóór histologische kleuring in onverdund mierenzuur worden ondergedompeld7. Het IHC-protocol voor PrPSc bevat een routinematige mierenzuur-epitoop-ontmaskeringsstap, die ook dient om prionen7 te inactiveren. Na deze prioninactiveringsstappen kunnen de resulterende vaste weefsels vervolgens worden verwerkt bij BSL-2 met behulp van standaard BSL-2-praktijken.
De minimale weefselbemonsteringsvereiste voor TSE-diagnose bij elk dier dat onder TSE-surveillance valt, is het verzamelen van de hersenstam (op obex-niveau). Bovendien wordt voor het opsporen van atypische BSE en scrapie geadviseerd om ook een deel van het cerebellum te verzamelen 1,8. Voor CWD-diagnose moeten zowel hersenstam (obex) als retrofaryngeale lymfeklieren worden getest, omdat PrP Sc kan worden gedetecteerd in lymfoïde weefsels zonder detecteerbare PrPSc in obex9, beoordeeld door Machado et al.10.
Het obex-gedeelte van de hersenstam omvat diagnostische TSE-doellocaties, namelijk de dorsale vagale kern (DVN), solitaire tractuskern (STN) en spinale tractuskern van de trigeminuszenuw (V). Deze gebieden vertonen consequent bilaterale PrP Sc-accumulatie, zelfs in de vroege stadia van BSE en klassieke scrapie. In klinische gevallen van gevorderde TSE vertonen alle grijze stofgebieden in de hersenstam een wijdverspreide PrPSc-distributie 11.
Voordat de hersenmonsters worden gesegmenteerd en verwerkt, worden ze geëvalueerd (figuur 1) om het niveau van autolyse en de aanwezigheid van weefselschade vast te stellen die mogelijk de geschiktheid van het monster voor IHC-gebaseerde bevestigende diagnose8 in gevaar brengt. Om de integriteit van de voorbereidende protocollen en de analyseresultaten te valideren, worden de positieve en negatieve weefselmonsters van TSE opgenomen als controles in combinatie met de bereiding van weefsels uit testgevallen in elke test.
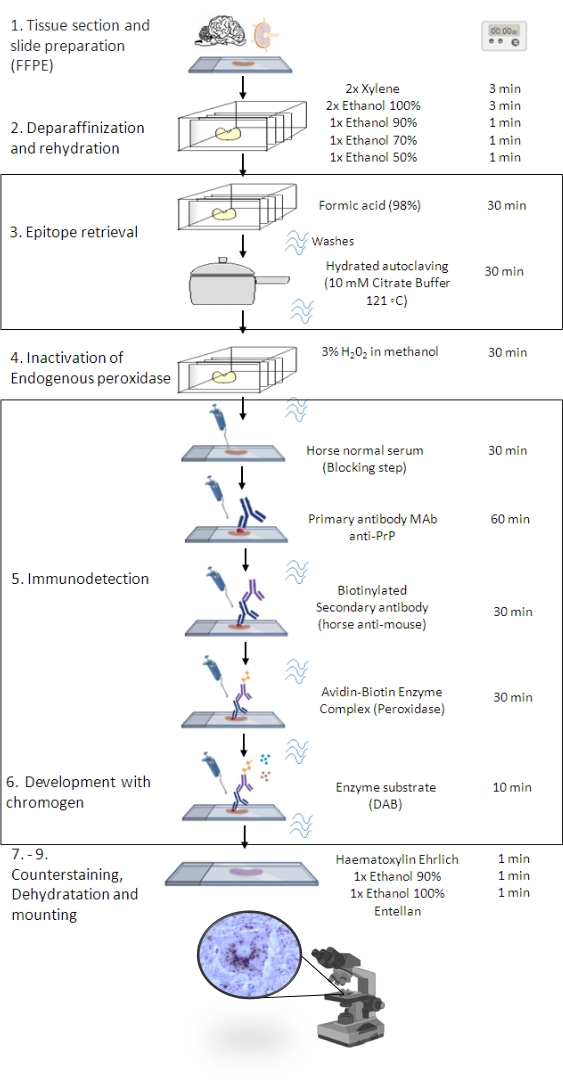
Figuur 1: De PrPSc IHC procedure. Representatie van de stapsgewijze volgorde van de PrPSc IHC-procedure van deparaffinisatie van weefselsecties tot uiteindelijke immunostaining en detectie (FFPE – Formaline-fixed paraffine-embedded; Mab – monoklonaal antilichaam; DAB – 3,3′ diaminobenzidine). Deze figuur is gemaakt in BioRender.com. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
TSE’s zijn potentiële zoönotische ziekten. Na het opduiken van BSE in 1986 in het Verenigd Koninkrijk werd Portugal een van de lidstaten van de Europese Unie met een hogere incidentie van deze ziekte14,15. Om deze ziekte onder controle te houden, zijn andere TSE’s die zijn opgedoken (klassieke en atypische scrapie, BSE-varianten en momenteel de bewaking van chronische verspillingsziekte bij hertachtigen), bewakingsmechanismen ontwikkeld door het directoraat-gen…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit artikel werd gefinancierd door het project POCI-01-0145-FEDER-029947 “Chronic wasting disease risk assessment in Portugal” ondersteund door FCT (Fundação para a Ciência e a Tecnologia) – FEDER -Balcão2020. Ook ontvingen de auteurs van de onderzoekseenheid CECAV financiering van de FCT, in het kader van het project UIDB / CVT / 0772 / 2020.We bedanken Bruce C. Campbell, Research Director (gepensioneerd), Western Regional Research Center, USDA, voor zijn hulp.
Materials
| Absolute ethanol | Labchem | LB0507-9010 | Undituled |
| Diluted 90%, 70% and 50% in distilled water | |||
| Avidin-biotin complex and peroxidase Vectastain Elite ABC kit Peroxidase |
Vector Laboratories | PK-6100 | Prepare and gently mix 30 min before use according to kit instructions. Do not mix after standing. |
| Biotinylated secondary antibody (Horse anti-mouse IgG H+L) | Vector Laboratories | BA-2000-1.5 | Dilute at 1/200 in TBS with 10% horse normal serum. Prepare the volume required depending on the number of sections. |
| Chromogen Diaminobenzidine- DAB, substrate kit, Peroxidase | Vector Laboratories | SK-4100 | Prepare before use according to kit instructions. Use 400 µL of solution per section. |
| DakoCytomation Pascal pressure chamber | DAKO | S2800 | |
| Ehrlich’s Hematoxylin: | |||
| Hematoxylin | Merck | 115938 | Dissolve 2 g of hematoxylin in 100 mL of absolute ethanol. Add 100 mL of distilled water, 10 mL of glacial acetic acid and 15 g of potassium alum with constant stirring. Add 100 mL of glycerin. The natural oxidation process takes 2 months, before use. |
| Absolute ethanol | Labchem | LB0507-9010 | |
| Glacial acetic acid | Merck | 101830 | |
| Potassium alum | Merck | 1.01047.1000 | |
| Glycerin | Merck | 1.04091.1000 | |
| Endogenous Peroxidase Block solution (3% concentration H2O2): | 40 mL Hydrogen peroxide (30% w/w) in 360 mL Methanol. Prepare before use |
||
| Hydrogen peroxide (30% w/w) | Scharlau | HI0136 | |
| Methanol | Sigma Aldrich | 322415-2L | |
| Formic acid 98% | Merck | 1.00264.1000 | Undiluted |
| Microtome | Shandon-AS325 | Microtome | Shandon-AS325 |
| Mounting medium Entellan | Merck | 107960 | Ready- to- use. |
| Normal serum (20% ) block solution in TBS: Horse normal serum |
Gibco |
16050-122 |
Prepare final volume according to the number of sections in the assay (200 µL of solution per section). |
| Primary antibody anti-PrP Mouse MAb 2G11 | BIORAD | MCA2460 | PrP 146-R154R171182 Ovine including atypical scrapie, cervine, feline. Not suitable for bovine. According to the number of sections in the assay (200 µL of solution per section) and antibody dilution, prepare final volume in TBS supplemented with 10% of normal serum from the species the secondary antibody was raised in (horse normal serum) Usual antibody dilution: MAb 2G11 1/100 but working dilution should be established in every new batch to get the concentration to give the strongest labelling with lowest background. For storage, freeze aliquot volumes of a minimum of 10 μL into sterile microtubes. Defrost and use one aliquot at a time. |
| Primary antibody anti-PrP Mouse MAb 12F10 | Cayman Chemical Company | 189710 | PrP142-160 Bovine, not suitable for ovine Usual antibody dilution: 1/200 but working dilution should also be established. Prepare as MAb 2G11 |
| Shandon CoverplateTM chamber | Thermo Scientific | 72110017 | |
| Shandon Sequenza® Immunstaining center | Thermo Scientific | 73300001 | |
| Shandon Sequenza® Immunstaining slide rack | Thermo Scientific | 73310017 | |
| Solution Citrate Buffer (10 mM pH 6.1): | 2.55 g Tri-sodium citrate dihydrate and 0.255 g Citric acid in one litre purified water. Adjust pH of working solution to 6.1 using 10 mM citric acid solution (1.05 g citric acid in 500 mL purified water) Prepare on assay day. |
||
| Tri-sodium citrate dihydrate | Sigma-aldrich | S4641-500G | |
| Citric acid | Sigma Aldrich | C0759 | |
| Staining jar and basket | Deltalab | 19360 | |
| 19361 | |||
| Superfrost Plus microscope slides | VWR | 631-0108 | |
| Tris-Buffered Saline solution (TBS) (50 mM TRIZMA BASE; 0.8% NaCI; pH 7.6): | 10xTBS (stock solution 0.5 M TRIZMA BASE; 8% NaCI; pH 7.6): TRIZMA BASE 60,57 g and NaCl 80 g in 800 mL purified water. Adjust pH of stock solution using Hydrochloric acid 37% and final volume to one litre with purified water (keep 5± 3 °C until 2 months) Dilute TBS stock solution 1/10 on assay day. |
||
| TRIZMA BASE | Sigma Aldrich | T6066-1KG | |
| Sodium Chloride (NaCl) | Merck | 106404 | |
| Xylene | Panreac Applied Chem ITW reagents | 251769 | Undiluted |
References
- . WOAH, Manual of Diagnostic Tests and Vaccines for Terrestrial Animals Online Access. Chapter 3.4.5.-Bovine Spongiform Encephalopathy (Version May 2021) and Chapter 3.8.11. – Scrapie (Version May 2022) Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/ (2022)
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M., Oliver, C., Jamur, M. Heat-Induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Immunocytochemical Methods and Protocols. Methods in Molecular Biology. 588, 103-119 (2010).
- Duraiyan, J., Govindarajan, R., Kaliyappan, K., Palanisamy, M. Applications of immunohistochemistry). Journal Pharmacy Bioallied Sciences. 4, 307-309 (2012).
- Orge, L., et al. Neuropathology of Animal Prion Diseases. Biomolecules. 11 (3), 466 (2021).
- . Biosafety in Microbiological and Biomedical Laboratories. 6th Edition Revised June 2020 Available from: https://www.cdc.gov/labs/pdf/SF_19_308133-A_BMBL6_00-BOOK-WEB-final-3.pdf (2022)
- APHA. Fixation, tissue processing, histology and immunohistochemistry procedures for diagnosis of animal TSE (BSE, scrapie, atypical scrapie, CWD). Histo & IHC protocols for TSE diagnosis_Rev_Jan2019.pdf. TSEglobalNet – International Reference Laboratory for TSE. , (2022).
- Sample requirements for TSE testing and confirmation. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- TSE EU Reference Laboratory Guidelines for the detection of Chronic Wasting Disease in cervids. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- Machado, C. N., et al. TSE Monitoring in Wildlife Epidemiology, Transmission, Diagnosis, Genetics and Control. Wildlife Population Monitoring. IntechOpen. , (2019).
- APHA. Neuropathology: Confirmatory diagnosis of transmissible spongiform encephalopathies (TSEs) in cattle and small ruminants. Confirmatory (Histo & IHC) diagnostic criteria Rev_Jan2019.pdf. TSEglobalNet – International Reference Laboratory for TSE. , (2019).
- Ryder, S. J., Spencer, Y. I., Bellerby, P. J., March, S. A. Immunohistochemical detection of PrP in the medulla oblongata of sheep: The spectrum of staining in normal and scrapie-affected sheep. The Veterinary Record. 148 (1), 7-13 (2001).
- Simmons, M. M., et al. Experimental classical bovine spongiform encephalopathy: definition and progression of neural PrP immunolabeling in relation to diagnosis and disease controls. Veterinary Pathology. 48 (5), 948-963 (2011).
- Orge, L., et al. Identification of H-type BSE in Portugal. Prion. 9 (1), 22-28 (2015).
- Orge, L., Simas, J. P., Fernandes, A. C., Ramos, M., Galo, A. Similarity of the lesion profile of BSE in Portuguese cattle to that described in British cattle. Veterinary Record. 147 (17), 486-488 (2000).
- Pires, M. A., Travassos, F. S., Gärtner, F. Atlas of veterinary pathology. Biopathology. Lidel VII. 195 (6), 179-180 (2004).
- Pires, M. A., et al. Immunology protocols, didactic series. Applied Sciences. , 357 (2010).

