면역조직화학에 의한 비정상적인 프리온 단백질 검출
Summary
면역조직화학 프로토콜을 사용하여 비정상 프리온 단백질을 면역표지하려면 특정 샘플 및 항-PrP 항체 준비 방법론이 필요합니다. 본 프로토콜은 적절한 PrP 면역표지를 보장하고 비특이적 배경 염색을 최소화하기 위한 에피토프 마스킹의 주요 단계를 설명합니다. 또한, 이 접근법은 프리온 감염 조직으로 면역조직화학 연구를 수행할 때 생물학적 안전성 조치를 고려합니다.
Abstract
비정상 프리온 단백질(PrP,Sc)은 세포 프리온 단백질의 질병 관련 동형이며 전염성 해면상 뇌병증(TSE)의 진단 마커입니다. 이러한 신경퇴행성 질환은 인간과 여러 동물 종에 영향을 미치며 스크래피, 인수공통전염병(BSE), 만성 자궁경부 소모성 질환(CWD) 및 새로 확인된 낙타 프리온 질병(CPD)을 포함합니다. TSE의 진단은 뇌 조직, 즉 뇌간(obex 수준)에 면역조직화학(IHC)과 웨스턴 면역블롯 방법(WB)을 모두 적용하여 PrPSc의 면역검출에 의존합니다. IHC는 조직 절편의 세포에서 관심있는 항원에 대해 1 차 항체 (단일 클론 또는 폴리 클로날)를 사용하는 널리 사용되는 방법입니다. 항체-항원 결합은 항체가 표적이 된 조직 또는 세포 영역에 국한된 채로 남아 있는 색 반응에 의해 시각화될 수 있습니다. 따라서 프리온 질병에서 다른 연구 분야와 마찬가지로 면역 조직 화학 기술은 진단 목적뿐만 아니라 병인 연구에도 사용됩니다. 이러한 연구는 새로운 프리온 균주를 식별하기 위해 이전에 설명한 것에서 PrPSc 패턴 및 유형을 검출하는 것을 포함합니다. BSE는 인간을 감염시킬 수 있으므로 TSE 감시에 포함된 소, 작은 반추 동물 및 자궁경부 샘플을 처리하기 위해 생물안전 실험실 레벨 3(BSL-3) 시설 및/또는 관행을 사용하는 것이 좋습니다. 또한 오염을 제한하기 위해 가능하면 봉쇄 및 프리온 전용 장비를 권장합니다. PrPSc IHC 절차는 이 기술에 사용된 포르말린 고정 및 파라핀 포매 조직이 감염성을 유지하기 때문에 프리온 불활성화 측정으로도 작용하는 포름산 에피토프 데마스킹 단계로 구성됩니다. 결과를 해석할 때 비특이적 면역 표지와 표적 표지를 구별하기 위해 주의를 기울여야 합니다. 이러한 목적을 위해, 본원에 추가로 기술된 TSE 균주, 숙주 종 및 prnp 유전자형 간에 변할 수 있는 특정 PrPSSc 면역표지 유형으로부터 이들을 구별하기 위해 공지된 TSE-음성 대조군 동물에서 얻어진 면역표지의 인공물을 인식하는 것이 중요하다.
Introduction
프리온 가설에 따르면, 비정상적인 동형(PrPSc)은 전염성 해면상 뇌병증(TSE)에서 감염원의 주요 또는 유일한 구성 요소입니다. TSE 진단을 위한 확인은 면역조직화학(IHC) 프로토콜 및/또는 뇌 조직의 웨스턴 면역블롯 방법(WB)을 적용하여 PrPSc 의 면역검출에 의존합니다1.
IHC는 조직 절편의 세포에 위치하는 특이적 표적화된 관심 항원의 면역염색의 첫 번째 단계로서 단일클론 항체 또는 일부 경우에 다클론 항체(1차 항체)를 사용하는 방법입니다. 임의의 효과적인 1차 항체-항원 결합은 1차 항체에 특이적인 2차 항체를 사용하여 시각화된다. 이러한 2차 항체는 양 고추 냉이 과산화 효소 (HRP) 또는 알칼리성 포스파타제 (AP)와 같은 효소에 접합됩니다. 그런 다음 이러한 효소에 기질을 추가하여 1차 항체가 표적 항원에 결합하는 영역에 국한된 불용성 색상 제품을 생성함으로써 시각화를 달성합니다. 개선된 시각화는 대조염색에 의해 달성될 수 있으며, 여기서 염료는 면역표지된 조직과 면역표지되지 않은 조직 사이의 대조를 생성하기 위해 사용된다2.
포르말린 고정 파라핀 포매 조직 (FFPE)을 사용하는 IHC를 사용하면 포르말린 고정은 포름알데히드에 의한 가교 결합 및 파라핀 포매 동안 가열 및 탈수로 인한 1차 항체의 효과를 무효화할 수 있습니다. 이들은 단백질의 형태를 변화시켜 에피토프를 파괴, 변성 또는 마스킹하여 검출을 감소시키거나 폐지한다3. 따라서 항원 검색(AR)이 필요합니다. AR 기술은 항원 분자에서 포름알데히드 관련 화학 그룹 가교를 방해하여 원래의 항원-단백질 형태를 복원하거나 마스킹을 해제합니다. 이는 면역표지를 위한 항체-항원(에피토프) 친화도를 회복시키는 결과를 가져온다. AR의 최종 효능은 표적 항원 및/또는 1차 항체의 특성에 따라 달라집니다2.
열-유도 항원 (에피토프) 검색 (HIER)은 AR3 의 한 절차이고, 본원에 기재된 바와 같이,PrPSc IHC 검출을 위해 일상적으로 사용된다. IHC는 진단에 필수적이며 병리학 관련 항원의 조직 분포를 결정하기 위해 연구 실험실에서 사용됩니다. 암, 신경과학, 전염병4 등의 진단 및 연구에 널리 사용된다. TSE의 경우, IHC는 자연 숙주 및 실험 모델에서 PrPSSc 분포를 확인하고 조사하기 위한 진단 및 연구에서 중요한 역할을 합니다. IHC는 프리온 병인 연구와PrPSC 침착 유형 및 패턴, 즉 신경 조직5의 분석에 기여하여 일상적으로 기술되는 감염으로부터의 편차를 감지하고 추정되는 새로운 프리온 균주를 식별한다.
소 해면상 뇌병증(bovine spongiform encephalopathy, BSE)의 프리온은 인간을 감염시킬 수 있기 때문에, BSE 연구와 관련된 특정 실험실 프로토콜은 BSL-3 시설 및 관행을 사용해야 할 수 있다6. 여기에는 밀봉된 2차 용기를 사용하여 연구소 및 실험실 내에서 잠재적인 BSE 감염 조직 샘플을 운반하는 것이 포함됩니다. 또한 가능할 때마다 BSE 연구 및 분석을 위한 격리 구역과 프리온 전용 장비를 지정하는 것도 포함됩니다. 이는 작업장 외부의 오염을 방지하고 오염 제거 절차가 필요하기 때문에 밀폐된 공간을 제공하기 위해 수행됩니다.
따라서, INIAV의 병리학 실험실은 TSE 감시와 관련된 소, 작은 반추 동물 및 자궁 경부의 잠재적인 프리온 감염 조직 샘플을 관리하기 위해 권장되는 생물안전 등급-3(BSL-3) 시설 및 관행6 을 따른다.
TSE 진단 또는 연구 절차, 특히 중추 신경계에 포함 된 포르말린 고정 및 파라핀 포매 조직은 잠재적으로 전염 될 수 있습니다. 따라서 이러한 고정 조직은 조직 처리 전에 프리온의 감염성을 줄이기 위해 포름산으로 처리해야 합니다. 이것은 고정되고 손질 된 조직 (약 2-4mm 두께)을 처리 카세트에 넣어 수행됩니다. 그런 다음 카세트를 98% 포름산에 담급니다(1시간 동안). 침지 후, 티슈가 있는 카세트를 흐르는 수돗물에서 30분 동안 세척하고, 추가 처리 전에 고정액으로 되돌립니다. 조직 절편을 처리 전에 처리하지 않는 경우, 조직학적 염색 전에 최소 5분 동안 희석되지 않은 포름산에 세포 절편을 담가야 한다7. PrPSc 에 대한 IHC 프로토콜은 일상적인 포름산 에피토프-데마스킹 단계를 포함하며, 또한 프리온을 불활성화시키는 역할을 한다(7). 이러한 프리온 불활성화 단계 후, 생성된 고정 조직은 표준 BSL-2 관행을 사용하여 BSL-2에서 처리될 수 있습니다.
TSE 감시에 포함 된 모든 동물에서 TSE 진단을위한 최소 조직 샘플링 요구 사항은 뇌간을 수집하는 것입니다 (obex 수준에서). 또한, 비정형 BSE와 스크래피를 검출하기 위해서는 소뇌의 일부도 채취하는 것이 좋다 1,8. CWD 진단의 경우, Machado et al.10에 의해 검토된 obex9에서 검출 가능한 PrP Sc가 없는 림프 조직에서 PrPSc가 검출될 수 있으므로 뇌간(obex)과 후인두 림프절을 모두 검사해야 합니다.
뇌간의 obex 부분에는 진단 TSE 표적 부위, 즉 삼차 신경의 등쪽 미주 신경(DVN), 고립관 핵(STN) 및 척수 핵이 포함됩니다. 이 영역은 BSE 및 고전적 스크래피의 초기 단계에서도 일관되게 양측 PrPSc 축적을 나타냅니다. 진행성 TSE의 임상 사례에서, 뇌간 내의 모든 회백질 영역은 광범위한 PrPS분포 를 보인다11.
절편 및 처리 전에, 뇌 검체를 평가하여(그림 1) 자가분해 수준과 IHC 기반 확증 진단에 대한 검체의 적합성을 잠재적으로 손상시킬 수 있는 조직 손상의 존재를 확인한다8. 분취 프로토콜 및 분석 결과의 무결성을 검증하기 위해 TSE 양성 및 음성 조직 샘플은 각 분석에서 테스트 케이스의 조직 준비와 함께 대조군으로 포함됩니다.
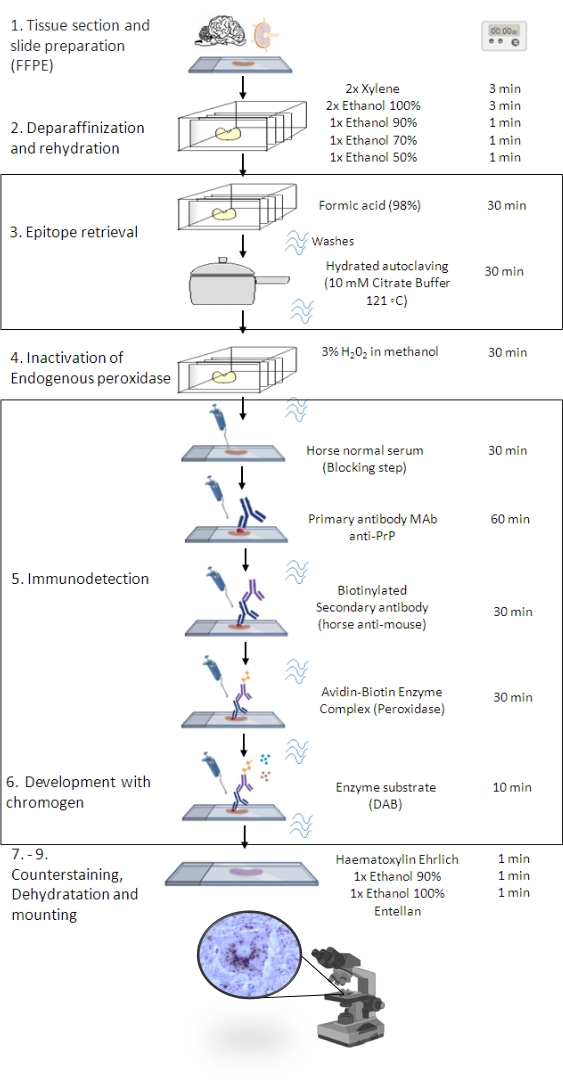
그림 1: PrPSc IHC 절차. 조직 절편의 탈파라핀화부터 최종 면역염색 및 검출까지PrPSC 의 단계별 서열을 보여주는 IHC 절차(FFPE – Formalin-fixed paraffin-embedded; Mab – 단클론 항체; DAB – 3,3′ 디아미노벤지딘). 이 그림은 BioRender.com 년에 만들어졌습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
TSE는 잠재적인 인수공통전염병입니다. 영국에서 1986에서 BSE가 출현 한 후, 포르투갈은이 질병의 발병률이 높은 유럽 연합 회원국 중 하나가되었습니다14,15. 이 질병을 통제하기 위해 등장한 다른 TSE (고전적 및 비정형 스크래피, BSE 변종 및 현재 자궁 경부에서 만성 소모성 질환의 감시), 감시 메커니즘은 식품 수의학 총국 (DGAV)과 국립 농업 및 수의학 연…
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 기사는 FCT(Fundação para a Ciência e a Tecnologia) – FEDER -Balcão2020이 지원하는 프로젝트 POCI-01-0145-FEDER-029947 “포르투갈의 만성 소모성 질병 위험 평가”의 자금 지원을 받았습니다. 또한 연구 단위 CECAV의 저자는 UIDB/CVT/0772/2020 프로젝트에 따라 FCT로부터 자금을 받았습니다.
Materials
| Absolute ethanol | Labchem | LB0507-9010 | Undituled |
| Diluted 90%, 70% and 50% in distilled water | |||
| Avidin-biotin complex and peroxidase Vectastain Elite ABC kit Peroxidase |
Vector Laboratories | PK-6100 | Prepare and gently mix 30 min before use according to kit instructions. Do not mix after standing. |
| Biotinylated secondary antibody (Horse anti-mouse IgG H+L) | Vector Laboratories | BA-2000-1.5 | Dilute at 1/200 in TBS with 10% horse normal serum. Prepare the volume required depending on the number of sections. |
| Chromogen Diaminobenzidine- DAB, substrate kit, Peroxidase | Vector Laboratories | SK-4100 | Prepare before use according to kit instructions. Use 400 µL of solution per section. |
| DakoCytomation Pascal pressure chamber | DAKO | S2800 | |
| Ehrlich’s Hematoxylin: | |||
| Hematoxylin | Merck | 115938 | Dissolve 2 g of hematoxylin in 100 mL of absolute ethanol. Add 100 mL of distilled water, 10 mL of glacial acetic acid and 15 g of potassium alum with constant stirring. Add 100 mL of glycerin. The natural oxidation process takes 2 months, before use. |
| Absolute ethanol | Labchem | LB0507-9010 | |
| Glacial acetic acid | Merck | 101830 | |
| Potassium alum | Merck | 1.01047.1000 | |
| Glycerin | Merck | 1.04091.1000 | |
| Endogenous Peroxidase Block solution (3% concentration H2O2): | 40 mL Hydrogen peroxide (30% w/w) in 360 mL Methanol. Prepare before use |
||
| Hydrogen peroxide (30% w/w) | Scharlau | HI0136 | |
| Methanol | Sigma Aldrich | 322415-2L | |
| Formic acid 98% | Merck | 1.00264.1000 | Undiluted |
| Microtome | Shandon-AS325 | Microtome | Shandon-AS325 |
| Mounting medium Entellan | Merck | 107960 | Ready- to- use. |
| Normal serum (20% ) block solution in TBS: Horse normal serum |
Gibco |
16050-122 |
Prepare final volume according to the number of sections in the assay (200 µL of solution per section). |
| Primary antibody anti-PrP Mouse MAb 2G11 | BIORAD | MCA2460 | PrP 146-R154R171182 Ovine including atypical scrapie, cervine, feline. Not suitable for bovine. According to the number of sections in the assay (200 µL of solution per section) and antibody dilution, prepare final volume in TBS supplemented with 10% of normal serum from the species the secondary antibody was raised in (horse normal serum) Usual antibody dilution: MAb 2G11 1/100 but working dilution should be established in every new batch to get the concentration to give the strongest labelling with lowest background. For storage, freeze aliquot volumes of a minimum of 10 μL into sterile microtubes. Defrost and use one aliquot at a time. |
| Primary antibody anti-PrP Mouse MAb 12F10 | Cayman Chemical Company | 189710 | PrP142-160 Bovine, not suitable for ovine Usual antibody dilution: 1/200 but working dilution should also be established. Prepare as MAb 2G11 |
| Shandon CoverplateTM chamber | Thermo Scientific | 72110017 | |
| Shandon Sequenza® Immunstaining center | Thermo Scientific | 73300001 | |
| Shandon Sequenza® Immunstaining slide rack | Thermo Scientific | 73310017 | |
| Solution Citrate Buffer (10 mM pH 6.1): | 2.55 g Tri-sodium citrate dihydrate and 0.255 g Citric acid in one litre purified water. Adjust pH of working solution to 6.1 using 10 mM citric acid solution (1.05 g citric acid in 500 mL purified water) Prepare on assay day. |
||
| Tri-sodium citrate dihydrate | Sigma-aldrich | S4641-500G | |
| Citric acid | Sigma Aldrich | C0759 | |
| Staining jar and basket | Deltalab | 19360 | |
| 19361 | |||
| Superfrost Plus microscope slides | VWR | 631-0108 | |
| Tris-Buffered Saline solution (TBS) (50 mM TRIZMA BASE; 0.8% NaCI; pH 7.6): | 10xTBS (stock solution 0.5 M TRIZMA BASE; 8% NaCI; pH 7.6): TRIZMA BASE 60,57 g and NaCl 80 g in 800 mL purified water. Adjust pH of stock solution using Hydrochloric acid 37% and final volume to one litre with purified water (keep 5± 3 °C until 2 months) Dilute TBS stock solution 1/10 on assay day. |
||
| TRIZMA BASE | Sigma Aldrich | T6066-1KG | |
| Sodium Chloride (NaCl) | Merck | 106404 | |
| Xylene | Panreac Applied Chem ITW reagents | 251769 | Undiluted |
References
- . WOAH, Manual of Diagnostic Tests and Vaccines for Terrestrial Animals Online Access. Chapter 3.4.5.-Bovine Spongiform Encephalopathy (Version May 2021) and Chapter 3.8.11. – Scrapie (Version May 2022) Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/ (2022)
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M., Oliver, C., Jamur, M. Heat-Induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Immunocytochemical Methods and Protocols. Methods in Molecular Biology. 588, 103-119 (2010).
- Duraiyan, J., Govindarajan, R., Kaliyappan, K., Palanisamy, M. Applications of immunohistochemistry). Journal Pharmacy Bioallied Sciences. 4, 307-309 (2012).
- Orge, L., et al. Neuropathology of Animal Prion Diseases. Biomolecules. 11 (3), 466 (2021).
- . Biosafety in Microbiological and Biomedical Laboratories. 6th Edition Revised June 2020 Available from: https://www.cdc.gov/labs/pdf/SF_19_308133-A_BMBL6_00-BOOK-WEB-final-3.pdf (2022)
- APHA. Fixation, tissue processing, histology and immunohistochemistry procedures for diagnosis of animal TSE (BSE, scrapie, atypical scrapie, CWD). Histo & IHC protocols for TSE diagnosis_Rev_Jan2019.pdf. TSEglobalNet – International Reference Laboratory for TSE. , (2022).
- Sample requirements for TSE testing and confirmation. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- TSE EU Reference Laboratory Guidelines for the detection of Chronic Wasting Disease in cervids. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- Machado, C. N., et al. TSE Monitoring in Wildlife Epidemiology, Transmission, Diagnosis, Genetics and Control. Wildlife Population Monitoring. IntechOpen. , (2019).
- APHA. Neuropathology: Confirmatory diagnosis of transmissible spongiform encephalopathies (TSEs) in cattle and small ruminants. Confirmatory (Histo & IHC) diagnostic criteria Rev_Jan2019.pdf. TSEglobalNet – International Reference Laboratory for TSE. , (2019).
- Ryder, S. J., Spencer, Y. I., Bellerby, P. J., March, S. A. Immunohistochemical detection of PrP in the medulla oblongata of sheep: The spectrum of staining in normal and scrapie-affected sheep. The Veterinary Record. 148 (1), 7-13 (2001).
- Simmons, M. M., et al. Experimental classical bovine spongiform encephalopathy: definition and progression of neural PrP immunolabeling in relation to diagnosis and disease controls. Veterinary Pathology. 48 (5), 948-963 (2011).
- Orge, L., et al. Identification of H-type BSE in Portugal. Prion. 9 (1), 22-28 (2015).
- Orge, L., Simas, J. P., Fernandes, A. C., Ramos, M., Galo, A. Similarity of the lesion profile of BSE in Portuguese cattle to that described in British cattle. Veterinary Record. 147 (17), 486-488 (2000).
- Pires, M. A., Travassos, F. S., Gärtner, F. Atlas of veterinary pathology. Biopathology. Lidel VII. 195 (6), 179-180 (2004).
- Pires, M. A., et al. Immunology protocols, didactic series. Applied Sciences. , 357 (2010).

