Een hoge resolutie, enkelkorrelig, in vivo pollenhydratatiebioassay voor Arabidopsis thaliana
Summary
Een verbeterde methode om pollenhydratatieprofielen in Arabidopsis thaliana te meten wordt hier beschreven. De nieuwe methode biedt een hogere resolutie, is niet-invasief en is zeer reproduceerbaar. Het protocol vertegenwoordigt een nieuw hulpmiddel voor een fijnere ontleding van de processen die de vroege stadia van bestuiving reguleren.
Abstract
Seksuele voortplanting in bloeiende planten vereist een initiële interactie tussen de stuifmeelkorrel en het stigmatische oppervlak, waarbij een moleculaire dialoog tot stand wordt gebracht tussen de interagerende partners. Studies over een reeks soorten hebben aangetoond dat een reeks moleculaire controlepunten de pollen-stigma-interactie reguleren om ervoor te zorgen dat alleen compatibel, over het algemeen intraspecifiek stuifmeel succesvol is in het bewerkstelligen van bevruchting. Bij soorten die een ‘droog stigma’ hebben, zoals de modelplant Arabidopsis thaliana, is het eerste post-bestuiving, prezygote compatibiliteitscontrolepunt de vaststelling van stuifmeelhydratatie.
Deze fase van bestuiving is strak gereguleerd, waarbij signalen van de stuifmeelkorrel de afgifte van water uit het stigma opwekken, waardoor pollenhydratatie mogelijk wordt. Het vermogen om pollenhydratatie in de loop van de tijd nauwkeurig te meten en te volgen, is de sleutel tot het ontwerpen van experimenten die gericht zijn op het begrijpen van de regulatie van deze kritieke stap in de voortplanting. Gepubliceerde protocollen maken vaak gebruik van bloemen die uit de ouderplant zijn weggesneden, op vloeibare of vaste media zijn onderhouden en in bulk zijn bestoven.
Dit artikel beschrijft een niet-invasieve, in vivo bestuivingsbioassay die het mogelijk maakt om van minuut tot minuut hydratatie te volgen van individuele A. thaliana stuifmeelkorrels met hoge resolutie. De test is zeer reproduceerbaar, in staat om zeer subtiele variaties van pollenhydratatieprofielen te detecteren en is dus geschikt voor de analyse van mutanten die routes beïnvloeden die de bestuiving reguleren. Hoewel het protocol langer is dan die beschreven voor bulkbestuivingen, maken de precisie en reproduceerbaarheid die het biedt, samen met de in vivo aard, het ideaal voor de gedetailleerde ontleding van bestuivingsfenotypen.
Introduction
Succesvolle seksuele voortplanting bij bedektzadigen is meestal afhankelijk van de overdracht van intraspecifieke stuifmeelkorrels van de helmknop naar het stigma, binnen of tussen individuen (d.w.z. bestuiving). Deze overdracht van stuifmeelkorrels naar een ontvankelijke bloem wordt meestal gemedieerd door bestuivers of abiotische factoren; Als zodanig resulteert dit ook vaak in de afzetting van heterospecifiek stuifmeel onder natuurlijke omstandigheden. Op een paar uitzonderingen na is de progressie van bestuiving door heterospecifiek stuifmeel evolutionair nadelig, waardoor de reproductieve fitheid wordt verminderd door verloren paringskansen, waarbij de meeste resulterende hybride nakomelingen zich niet op de juiste manier ontwikkelen of steriel zijn1. Zo zijn er mechanismen geëvolueerd om bestuiving te blokkeren door ‘incompatibel’ heterospecifiek stuifmeel2. Snelle herkenning van compatibel stuifmeel is daarom misschien wel het belangrijkste proces in de vroege stadia van seksuele voortplanting in veel bloeiende planten.
In de Brassicaceae-familie, waar stigma’s van het ‘droge’ type zijn, werkt een reeks moleculaire controlepunten in meerdere stadia van het voortplantingsproces dat de bestuiving reguleert, zodat alleen compatibel stuifmeel succesvol is. Stuifmeelhydratatie is een van de belangrijkste controlepunten (figuur 1), omdat stuifmeel dat niet hydrateert niet kan doorgaan om een stuifmeelbuis te produceren en vervolgens sperma af te leveren aan de vrouwelijke gametofyt. Vaak passeren incompatibele korrels dit eerste bestuivingscontrolepunt niet en krijgen ze dus geen toegang tot stigmatisch water3. Bij leden van de Brassicaceae-familie treedt de herkenning van stuifmeel snel op, waarbij de compatibiliteit binnen enkele minuten na de aanhechting van stuifmeelkorrels aan de stamper 4,5 wordt vastgesteld. In de afgelopen jaren is er veel vooruitgang geboekt en we beginnen nu de moleculaire mechanismen te begrijpen die belangrijke bestuivingscontrolepunten reguleren.
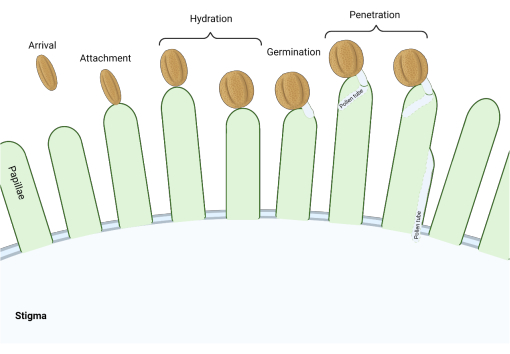
Figuur 1: Overzicht van belangrijke gebeurtenissen tijdens compatibele bestuiving. Deze stadia, zoals pollenhydratatie en ontkieming van stuifmeelbuizen, zijn ook ‘checkpoints’ voor bestuiving die met succes moeten worden genavigeerd om compatibele bestuiving te bewerkstelligen. Het diagram geeft een ‘droog’ type stigma weer, dat typerend is voor soorten uit de Brassicaceae-familie 2,20. Klik hier om een grotere versie van deze figuur te bekijken.
Baanbrekend onderzoek naar het Brassica zelfincompatibiliteit (SI) systeem, waarbij ‘zelf’ stuifmeel wordt herkend en afgewezen, heeft het paradigma voor pollen-stigmaherkenning vastgesteld in Brassicaceae 6,7,8,9,10. SI in Brassica en zijn verwanten wordt gemedieerd door ‘herkenningseiwitten’ die zich op het oppervlak van stuifmeel en op het stigmatische plasmamembraan bevinden en die bij interactie leiden tot stuifmeelafstoting. SI-stuifmeelafstoting werkt door verstoring van het basale pollenstigmacompatibiliteitssysteem dat, wanneer volledig geactiveerd door de perceptie van compatibel stuifmeel, leidt tot gerichte secretie door het stigma, waardoor de hydratatie van pollen wordt gestimuleerd (voor beoordelingen van het pollencompatibiliteitsmechanisme, zie11,12). In het voorbeeld van SI is het door stuifmeel overgedragen ligand een klein cysteïnerijk eiwit, S-locus cysteïne rijk (SCR / SP11), en de stigmatische receptor is het S-locus receptor kinase (SRK).
Onlangs is in Arabidopsis thaliana, een andere groep kleine cysteïnerijke stuifmeel-overgedragen eiwitten, pollenlaageiwitklasse Bs (bijPCP-Bs), belangrijke regulatoren van pollenacceptatie gebleken door de activering van pollenhydratatie13. Stigmatische receptoren van de AtPCP-B’s en aspecten van de downstream regulerende route zijn onlangs ook beschreven14,15. Interessant is dat mutatiestudies van genen die coderen voor potentiële pollengedragen en stigmatische signaalmediatoren van pollenhydratatie (inclusief AtPCP-Bs) er niet in zijn geslaagd om planten te genereren die een volledig blok hebben voor het pollenhydratatiecontrolepunt. Dit suggereert sterk dat meerdere andere, nog onontdekte, factoren een rol spelen bij de regulatie van pollenhydratatie. Voortbouwend op de methode die voor het eerst werd beschreven door Wang et al.13, beschrijven we hier een verbeterde hoge resolutie in vivo bioassay die geschikt is voor de identificatie van subtiele pollenhydratatiedefecten in kandidaat-mutant A. thaliana-lijnen.
Protocol
Representative Results
Discussion
Voor bloeiende planten zijn de zeer vroege stadia van seksuele voortplanting misschien wel de belangrijkste. Op het niveau van de pollen-stigma-interactie worden moleculaire beslissingen genomen die de ‘compatibiliteit’ van de interagerende partners bepalen. Dergelijke beslissingen voorkomen, indien correct genomen, verspilling van middelen die van invloed kunnen zijn op de reproductieve fitheid21. Het toestaan van alleen compatibel stuifmeel om de bevruchting te bewerkstelligen is dus een belangrijk onderdeel van het behoud van goed aangepaste genotypen, en dus het evolutionaire succes van soorten. Onderzoek uitgevoerd met de modelplant A. thaliana is zeer waardevol geweest bij het verdiepen van ons begrip van dit proces. Een aantal studies in de afgelopen decennia hebben de aanwezigheid aangetoond van factoren in de pollenlaag die werken bij het eerste compatibiliteitscontrolepunt, waar het stuifmeel toegang krijgt tot stigmatisch water om pollenhydratatie mogelijk te maken13. Ondanks deze eerste inzichten in de mechanismen die de compatibiliteit tussen pollen en stigma’s reguleren, zijn er nog steeds veel hiaten in ons begrip van dit proces. Tot op heden kunnen geen mutanten van door stuifmeel overgedragen liganden of stigmatische receptoren waarvan bekend is dat ze de hydratatie van pollen beïnvloeden, compatibele bestuiving volledig blokkeren, wat de aanwezigheid van andere onontdekte determinanten van pollenhydratatie suggereert. Door het fenotype van interesse gemakkelijk te kunnen observeren, is de hier beschreven pollenhydratatiebioassay een van de meest eenvoudige technieken om potentiële mutanten te bestuderen die de bestuiving reguleren.
Bestaande methoden voor het meten van pollenhydratatie maken vaak gebruik van bulkbestuivingen en rapporteren minder tijdpunten 14,22,23, en kunnen dus belangrijke fenotypen met subtiele hydratatieprofielen missen. Bijvoorbeeld, de studie van Wang et al.13, samen met het werk aan andere pollen coat eiwitmutanten in ons laboratorium (ongepubliceerde observaties), hebben intrigerende verschillen in hydratatieprofielen tussen mutanten onthuld. Dergelijke subtiele verschillen kunnen belangrijke aanwijzingen bevatten voor de regulerende mechanismen die ten grondslag liggen aan compatibele bestuiving.
De hier beschreven methode richt zich op het verkrijgen van relatief kleine aantallen metingen tussen mutant- en WT-plantlijnen, met de nadruk op methodologische precisie om variatie binnen de datasets te verminderen. Hoewel deze methode zeer reproduceerbaar is (zoals weergegeven in figuur 7), ervan uitgaande dat temperatuur en vochtigheid voldoende worden gecontroleerd, is het belangrijk om hydratatiegegevens te verzamelen voor bijna gelijke aantallen WT- en mutant stuifmeel op dezelfde dag om de kans op variatie verder te verminderen. Gegevens kunnen vervolgens indien nodig over verschillende dagen worden samengevoegd. Bovendien is het selecteren van de juiste WT-controle-installaties van vitaal belang voor een juiste interpretatie van de hydratatieresultaten. Voor de stuifmeelontvanger moet dezelfde plantenlijn worden gebruikt voor het ontvangen van zowel WT-controle als gemuteerde stuifmeelkorrels.
We gebruiken bijvoorbeeld de pA9-barnase mannelijke steriele plantenlijn, die ook in het videoprotocol voorkomt, als de stuifmeelontvanger voor zowel WT (controle) als mutant (experimenteel) stuifmeel bij het onderzoeken van T-DNA-stuifmeelmutantlijnen (zoals de ‘KD’-mutant beschreven in figuur 8). Het mengen van gegevens van zo’n mannelijke steriele lijn, die niet hoeven te worden uitgemergeld, met die verzameld uit een handmatig uitgemergelde controlelijn moet worden vermeden, omdat deze stigma’s zich waarschijnlijk anders zullen gedragen. Evenzo moeten uitgemergelde mutantlijnen waar mogelijk worden gebruikt in combinatie met een uitgemergelde WT (controle) lijn. Dezelfde voorzichtigheid moet ook worden toegepast bij het overwegen van de genetische achtergrond van de onderzochte planten. Terwijl de meest populaire T-DNA-mutantencollecties werden gegenereerd in de Col-0-achtergrond, zijn andere, zoals de FLAG-collectie van het Institut national de la Recherche Agronomique (INRA), beschikbaar in de Wassilewskija (WS) genetische achtergrond24,25. In dergelijke gevallen is het raadzaam om de WT-fabriekslijnen van het betreffende ecotype als controles te gebruiken.
Hoewel we ons hier hebben gericht op pollenhydratatie gedurende de eerste 10 minuten van de pollen-stigma-interactie, kan deze methode ook worden aangepast om hydratatieprofielen te omvatten die een langere periode bestrijken. Een belangrijk kenmerk van het protocol is dat bloemen gehecht blijven aan de oorspronkelijke plant-stroom gepubliceerde protocollen vereisen meestal excisie van de stamper en plaatsing in media om het weefsel te ondersteunen voor de duur van het experiment14,18,26. Hoewel er geen direct bewijs is dat suggereert dat een dergelijke semi-in vivo benadering de hydratatie van stuifmeel beïnvloedt of zelfs de in vivo regulatie van dit proces verandert, is het denkbaar dat excisie van de bloemen van de moederplant de bestuiving kan beïnvloeden. Dit protocol bereikt dus een echte in vivo omgeving voor de studie van de pollen-stigma-interactie, waarbij de structurele integriteit van de plant behouden blijft.
De overdracht van enkele stuifmeelkorrels naar ‘maagdelijke’ stigmatische papillen is misschien wel een van de meest uitdagende operaties die in dit protocol worden beschreven. Het is niet ongebruikelijk om clusters van stuifmeelkorrels per ongeluk over te brengen. De kans hierop kan echter sterk worden verkleind door ervoor te zorgen dat er slechts een monolaag stuifmeel op de tang aanwezig is (figuur 3A) (of zelfs maar een enkele stuifmeelkorrel; Figuur 5), en/of door gebruik te maken van stuifmeelkorrels die al georiënteerd zijn, zodanig dat ze op de punt van de tang uit anderen ‘steken’. We hebben ontdekt dat een ervaren operator met succes de overdracht van een enkel stuifmeel naar een stigmatische papillacel in ongeveer 3 minuten kan voltooien en gegevens kan registreren voor maximaal vijf stuifmeelkorrels gedurende een periode van 1 uur. Zo kunnen over een periode van 2-4 dagen voldoende gegevens worden verzameld voor een zinvolle statistische analyse van de bestudeerde plantenlijnen.
Menselijke fouten zijn potentieel de grootste bron van variatie in de analyse van datasets die zijn afgeleid van studies die dit protocol gebruiken. Zo komt de definitie van de ‘pollengrens’ tijdens beeldanalyse neer op het oordeel van de individuele onderzoeker. Er is dus het potentieel dat metingen door verschillende onderzoekers, zelfs op dezelfde dataset, variatie kunnen genereren. Waar mogelijk moet één onderzoeker de metingen uitvoeren om bemonsteringsfouten tot een minimum te beperken. Bovendien ontkent het koppelen van de analyse van WT- en mutantdatasets door dezelfde operator de potentieel subjectieve definitie van de ‘pollengrens’ en interoperatorvariatie.
Kortom, een geavanceerde maar nauwkeurige methode om pollenhydratatieprofielen in het modelorganisme A. thaliana te meten, wordt beschreven. We hebben aangetoond dat, door gebruik te maken van dit protocol, zeer consistente pollenhydratatiegegevens voor A. thaliana gemakkelijk kunnen worden verkregen. Drie onafhankelijke batches van gegevens voor WT-bestuivingen verkregen op verschillende dagen toonden consistente kleine afwijkingen van <3% over alle tijdspunten (figuur 7 en aanvullende tabel S1). Hoewel de hier gepresenteerde bioassay iets complexer is dan de meeste bestaande protocollen, is de resolutie van de gegenereerde gegevens superieur en geschikt voor de identificatie en karakterisering van nieuwe mutanten die van invloed zijn op routes die compatibele bestuiving reguleren.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit onderzoek werd ondersteund door postdoctorale beurzen van de Universiteit van Bath (University of Bath, Bath, UK, BA2 7AY) aan Y.-L.L. en L.W. Figuur 1 is gemaakt met BioRender.com (https://biorender.com/).
Materials
| A9-barnase line | University of Bath | Courtsey of Prof. Rod Scott | Male sterile Arabidopsis thaliana wildtype equivalent line of the ecotype Columbia-0 |
| Dumont Tweezer, Dumont #5 Inox 11cm | Fisher | Dumont 500342 | Tweezer uses for transfer of pollen grain |
| GraphPad Prsim (version 8.0.2) | Dotmatics | Prism | Comprehensive data analysis, graphing and statistics software |
| JMP (version 17) | JMP Statistical Discovery LLC | JMP 17 | Statistical analysis software |
| Levington F2S seed & modular compost (with sand) | Levington | LEV75F2SMS | General-purpose compost for plant growth |
| Micromanipulator | Singer instrument Co. LTD. | Singer Micromanipulator | Micromanipulator to aid transfer of pollen grain |
| Nikon Digit sight DS-U1 | Nikon | DS-U1 | Microscope camera (coupletd to SMZ1500) |
| Nikon Eclipse TE2000-S Inverted Microscope | Nikon | TE2000-S | Inverted microscope |
| Nikon SMZ1500 Stereomicroscope | Nikon | SMZ1500 | Stereomicroscope |
| Nikon DS-Fi3 microscope camera | Nikon | DS-Fi3 | Microscope camera (coupletd to TE2000-S) |
| Nikon NIS-Elements Basic Research | Nikon | NIS-Elements BR | Image accquisition and analysis software (for DS-Fi3) |
| Nikon NIS-Elements F | Nikon | NIS-Elements F | Image accquisition and analysis software (for DS-U1) |
| WT Col-0 plant line | NASC | N700000 | Wildtype Arabidopsis thaliana, ecotype Columbia-0 |
References
- Rieseberg, L. H., Willis, J. H. Plant speciation. Science. 317 (5840), 910-914 (2007).
- Hiscock, S. J., Allen, A. M. Diverse cell signalling pathways regulate pollen-stigma interactions: the search for consensus. New Phytologist. 179 (2), 286-317 (2008).
- Kandasamy, M. K., Nasrallah, J. B., Nasrallah, M. E. Pollen pistil interactions and developmental regulation of pollen-tube growth in Arabidopsis. Development. 120 (12), 3405-3418 (1994).
- Bosch, M., Wang, L. Pollen-stigma interactions in Brassicaceae: complex communication events regulating pollen hydration. Journal of Experimental Botany. 71 (9), 2465-2468 (2020).
- Rozier, F., et al. Live-cell imaging of early events following pollen perception in self-incompatible Arabidopsis thaliana. Journal of Experimental Botany. 71 (9), 2513-2526 (2020).
- Dickinson, H. Dry stigmas, water and self-incompatibility in Brassica. Sexual Plant Reproduction. 8, 1-10 (1995).
- Takasaki, T., et al. The S receptor kinase determines self-incompatibility in Brassica stigma. Nature. 403 (6772), 913-916 (2000).
- Schopfer, C. R., Nasrallah, M. E., Nasrallah, J. B. The male determinant of self-incompatibility in Brassica. Science. 286 (5445), 1697-1700 (1999).
- Takayama, S., et al. Direct ligand-receptor complex interaction controls Brassica self-incompatibility. Nature. 413 (6855), 534-538 (2001).
- Shiba, H., et al. A pollen coat protein, SP11/SCR, determines the pollen S-specificity in the self-incompatibility of Brassica species. Plant Physiology. 125 (4), 2095-2103 (2001).
- Broz, A. K., Bedinger, P. A. Pollen-pistil interactions as reproductive barriers. Annual Review of Plant Biology. 72 (1), 615-639 (2021).
- Cheung, A. Y., Duan, Q., Li, C., James Liu, M. -. C., Wu, H. -. M. Pollen-pistil interactions: It takes two to tangle but a molecular cast of many to deliver. Current Opinion in Plant Biology. 69, 102279 (2022).
- Wang, L. D., et al. PCP-B class pollen coat proteins are key regulators of the hydration checkpoint in Arabidopsis thaliana pollen-stigma interactions. New Phytologist. 213 (2), 764-777 (2017).
- Liu, C., et al. Pollen PCP-B peptides unlock a stigma peptide-receptor kinase gating mechanism for pollination. Science. 372 (6538), 171-175 (2021).
- Bordeleau, S. J., Sanchez, L. E. C., Goring, D. R. Finding new Arabidopsis receptor kinases that regulate compatible pollen-pistil interactions. Frontiers in Plant Science. 13, 1022684 (2022).
- Suwabe, K., et al. Double-locking mechanism of self-compatibility in Arabidopsis thaliana: the synergistic effect of transcriptional depression and disruption of coding region in the male specificity gene. Frontiers in Plant Science. 11, 576140 (2020).
- Smyth, D. R., Bowman, J. L., Meyerowitz, E. M. Early flower development in Arabidopsis. Plant Cell. 2 (8), 755-767 (1990).
- Lee, H. K., Macgregor, S., Goring, D. R. A toolkit for teasing apart the early stages of pollen-stigma interactions in Arabidopsis thaliana. Pollen and Pollen Tube Biology. 2160, 13-28 (2020).
- Dilkes, B. P., et al. The maternally expressed WRKY transcription factor TTG2 controls lethality in interploidy crosses of Arabidopsis. PLoS Biology. 6 (12), 2707-2720 (2008).
- Riglet, L., et al. KATANIN-dependent mechanical properties of the stigmatic cell wall mediate the pollen tube path in Arabidopsis. eLife. 9, e57282 (2020).
- Zhou, L. Z., Dresselhaus, T. Friend or foe: Signaling mechanisms during double fertilization in flowering seed plants. Plant Development and Evolution. 131, 453-496 (2019).
- Gao, X. -. Q., et al. The Arabidopsis KINβγ subunit of the SnRK1 complex regulates pollen hydration on the stigma by mediating the level of reactive oxygen species in pollen. PLoS Genetics. 12 (7), e1006228 (2016).
- Lee, H. K., Goring, D. R. Two subgroups of receptor-like kinases promote early compatible pollen responses in the Arabidopsis thaliana pistil. Journal of Experimental Botany. 72 (4), 1198-1211 (2021).
- O’Malley, R. C., Barragan, C. C., Ecker, J. R. A user’s guide to the Arabidopsis T-DNA insertion mutant collections. Pollen and Pollen Tube Biology. 1284, 323-342 (2015).
- Samson, F., et al. FLAGdb++: a database for the functional analysis of the Arabidopsis genome. Nucleic Acids Research. 32, D347-D350 (2004).
- Doucet, J., et al. Investigations into a putative role for the novel BRASSIKIN pseudokinases in compatible pollen-stigma interactions in Arabidopsis thaliana. BMC Plant Biology. 19 (1), 549 (2019).

