Arabidopsis thaliana için Yüksek Çözünürlüklü, Tek Taneli, In Vivo Polen Hidrasyon Biyotahlili
Summary
Arabidopsis thaliana’da polen hidrasyon profillerini ölçmek için geliştirilmiş bir yöntem burada açıklanmaktadır. Yeni yöntem daha yüksek çözünürlük sunar, invaziv değildir ve yüksek oranda tekrarlanabilir. Protokol, tozlaşmanın erken aşamalarını düzenleyen süreçlerin daha ince bir diseksiyonu için yeni bir aracı temsil etmektedir.
Abstract
Çiçekli bitkilerde cinsel üreme, polen tanesi ile etkileşime giren ortaklar arasında moleküler bir diyaloğun kurulduğu stigmatik yüzey arasındaki ilk etkileşimi gerektirir. Bir dizi tür üzerinde yapılan çalışmalar, bir dizi moleküler kontrol noktasının, yalnızca uyumlu, genellikle intraspesifik polenlerin döllenmeyi etkilemede başarılı olmasını sağlamak için polen-damgalama etkileşimini düzenlediğini ortaya koymuştur. Arabidopsis thaliana model bitkisi gibi ‘kuru damgalamaya’ sahip türlerde, tozlaşma sonrası ilk prezigotik uyumluluk kontrol noktası polen hidrasyonunun kurulmasıdır.
Bu tozlaşma aşaması sıkı bir şekilde düzenlenir, böylece polen tanesinden gelen sinyaller damgalamadan suyun salınımını sağlar, böylece polen hidrasyonuna izin verir. Polen hidrasyonunu zaman içinde doğru bir şekilde ölçme ve izleme yeteneği, üremedeki bu kritik adımın düzenlenmesini anlamaya yönelik deneylerin tasarımının anahtarıdır. Yayınlanan protokoller sıklıkla ana bitkiden eksize edilmiş, sıvı veya katı ortamlarda tutulan ve toplu olarak tozlaşan çiçekleri kullanır.
Bu yazıda, bireysel A. thaliana polen tanelerinin yüksek çözünürlükte dakika dakika hidrasyon takibine izin veren invaziv olmayan, in vivo tozlaşma biyotahlili açıklanmaktadır. Tahlil oldukça tekrarlanabilir, polen hidrasyon profillerinin çok ince varyasyonlarını tespit edebilir ve bu nedenle tozlaşmayı düzenleyen yolları etkileyen mutantların analizi için uygundur. Protokol, toplu tozlaşmalar için tarif edilenlerden daha uzun olmasına rağmen, sağladığı hassasiyet ve tekrarlanabilirlik, in vivo doğası ile birlikte, tozlaşma fenotiplerinin ayrıntılı diseksiyonu için idealdir.
Introduction
Anjiyospermlerde başarılı cinsel üreme tipik olarak, intraspesifik polen tanelerinin anterden stigmaya, bireylerin içinde veya arasında (yani tozlaşma) aktarılmasına dayanır. Polen tanelerinin alıcı bir çiçeğe bu transferine genellikle tozlayıcılar veya abiyotik faktörler aracılık eder; Bu nedenle, bu aynı zamanda sıklıkla doğal koşullar altında heterospesifik polenlerin birikmesine neden olur. Birkaç istisna dışında, heterospesifik polen tarafından tozlaşmanın ilerlemesi evrimsel olarak dezavantajlıdır, kayıp çiftleşme fırsatları yoluyla üreme uygunluğunu azaltır, sonuçta ortaya çıkan melez döllerin çoğu ya uygun şekilde gelişemez ya da steril olur1. Böylece, ‘uyumsuz’ heterospesifik polen2 ile tozlaşmayı engellemek için mekanizmalar gelişmiştir. Bu nedenle, uyumlu polenlerin hızlı bir şekilde tanınması, birçok çiçekli bitkide cinsel üremenin erken aşamalarında tartışmasız en önemli süreçtir.
Stigmaların ‘kuru’ tipte olduğu Brassicaceae familyasında, bir dizi moleküler kontrol noktası, tozlaşmayı düzenleyen üreme sürecinde birçok aşamada hareket eder, böylece yalnızca uyumlu polenler başarılı olur. Polen hidrasyonu en önemli kontrol noktalarından biridir (Şekil 1), çünkü hidratlanamayan polenler bir polen tüpü üretmek için ilerleyemez ve daha sonra dişi gametofitlere sperm veremez. Sıklıkla, uyumsuz taneler bu ilk tozlaşma kontrol noktasını geçemez ve bu nedenle damgalama suyuna erişemezler3. Brassicaceae familyasının üyeleri arasında, polenlerin tanınması hızlı bir şekilde gerçekleşir ve polen tanesinin pistil 4,5’e bağlanmasından birkaç dakika sonra uyumluluk sağlanır. Son yıllarda çok ilerleme kaydedildi ve şimdi kilit tozlaşma kontrol noktalarını düzenleyen moleküler mekanizmaları anlamaya başlıyoruz.
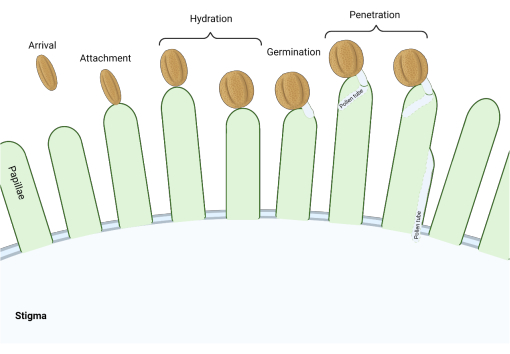
Şekil 1: Uyumlu tozlaşma sırasındaki önemli olaylara genel bakış. Polen hidrasyonu ve polen tüpü çimlenmesi gibi bu aşamalar, uyumlu tozlaşmayı etkilemek için başarılı bir şekilde yönlendirilmesi gereken tozlaşma ‘kontrol noktaları’dır. Diyagram, Brassicaceae familyası 2,20’den türlere özgü olan ‘kuru’ tip bir damgalamayı temsil eder. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
‘Kendini’ polenin tanındığı ve reddedildiği Brassica öz-uyumsuzluk (SI) sistemi üzerine yapılan öncü araştırmalar, Brassicaceae 6,7,8,9,10’da polen-damgalama tanıma paradigmasını oluşturmuştur. Brassica ve akrabalarındaki SI, polen yüzeyinde ve stigmatik plazma zarında bulunan ve etkileşim üzerine polen reddine yol açan ‘tanıma’ proteinleri aracılık eder. SI polen reddi, uyumlu polen algısı ile tamamen aktive edildiğinde, stigma tarafından hedeflenen sekresyona yol açan ve böylece polen hidrasyonunu tetikleyen bazal polen-stigma uyumluluk sisteminin bozulmasıyla çalışır (polen uyumluluk mekanizmasının gözden geçirilmesi için bkz.11,12). SI örneğinde, polen kaynaklı ligand küçük bir sistein bakımından zengin protein, S-lokus sistein bakımından zengin (SCR / SP11) ve stigmatik reseptör S-lokus reseptör kinazdır (SRK).
Son zamanlarda, Arabidopsis thaliana’da, başka bir küçük sistein bakımından zengin polen kaynaklı protein grubu, polen kaplama proteini sınıf Bs (PCP-Bs’de), polen hidrasyonunun aktivasyonu yoluyla polen kabulünün önemli düzenleyicileri olduğu bulunmuştur13. AtPCP-Bs’nin stigmatik reseptörleri ve aşağı akış düzenleyici yolunun yönleri de yakın zamandatanımlanmıştır 14,15. İlginçtir ki, polen hidrasyonunun potansiyel polen kaynaklı ve stigmatik sinyal aracılarını kodlayan genlerin mutasyonel çalışmaları (PCP-B’lerde dahil), polen hidrasyon kontrol noktasına tam bir bloğa sahip bitkiler üretememiştir. Bu, polen hidrasyonunun düzenlenmesinde diğer birçok henüz keşfedilmemiş faktörün rol oynadığını kuvvetle göstermektedir. İlk olarak Wang ve ark.13 tarafından tanımlanan yönteme dayanarak, burada aday mutant A. thaliana hatlarındaki ince polen hidrasyon kusurlarının tanımlanması için uygun, geliştirilmiş yüksek çözünürlüklü in vivo biyotahlili tarif ediyoruz.
Protocol
Representative Results
Discussion
Çiçekli bitkiler için, cinsel üremenin çok erken aşamaları tartışmasız en önemlisidir. Polen-stigma etkileşimi düzeyinde, etkileşime giren ortakların ‘uyumluluğunu’ belirleyen moleküler kararlar alınır. Bu tür kararlar, doğru bir şekilde verilirse, üreme uygunluğunu etkileyebilecek kaynakların israfını önler21. Bu nedenle, sadece uyumlu polenlerin döllenmeyi etkilemesine izin vermek, iyi adapte olmuş genotiplerin korunmasının ve dolayısıyla türlerin evrimsel başarısının önemli bir bileşenidir. Model bitki A. thaliana ile yapılan araştırmalar, bu süreç hakkındaki anlayışımızı derinleştirmede son derece değerli olmuştur. Son birkaç on yılda yapılan bir dizi çalışma, polen katında, polenlerin hidrasyonuna izin vermek için damgalama suyuna eriştiği ilk uyumluluk ‘kontrol noktasında’ hareket eden faktörlerin varlığını ortaya koymuştur13. Polen-damgalama uyumluluğunu düzenleyen mekanizmalara ilişkin bu ilk görüşlere rağmen, bu süreci anlamamızda hala birçok boşluk var. Bugüne kadar, polen hidrasyonunu etkilediği bilinen polen kaynaklı ligandların veya stigmatik reseptörlerin hiçbir mutantı, diğer keşfedilmemiş polen hidrasyon belirleyicilerinin varlığını düşündüren uyumlu tozlaşmayı tamamen engelleyemez. İlgilenilen fenotipi kolayca gözlemleyebilerek, burada açıklanan polen hidrasyon biyotahlili, tozlaşmayı düzenleyen potansiyel mutantları incelemek için en basit tekniklerden biridir.
Polen hidrasyonunu ölçmek için mevcut metodolojiler genellikle toplu tozlaşmaları kullanır ve daha az zaman noktası 14,22,23 bildirir ve bu nedenle önemli ince hidrasyon profili fenotiplerini kaçırabilir. Örneğin, Wang ve ark.13 tarafından yapılan çalışma, laboratuarımızdaki diğer polen kaplama protein mutantları üzerindeki çalışmalarla birlikte (yayınlanmamış gözlemler), mutantlar arasındaki hidrasyon profillerinde ilginç farklılıklar ortaya koymuştur. Bu tür ince farklılıklar, uyumlu tozlaşmanın altında yatan düzenleyici mekanizmalara dair önemli ipuçları tutabilir.
Burada açıklanan yöntem, veri kümelerindeki varyasyonu azaltmak için metodolojik hassasiyete vurgu yaparak, mutant ve WT bitki hatları arasında nispeten az sayıda ölçüm elde edilmesine odaklanmaktadır. Bu yöntem yüksek oranda tekrarlanabilir olsa da ( Şekil 7’de gösterildiği gibi), sıcaklık ve nemin yeterince kontrol edildiğini varsayarsak, varyasyon potansiyelini daha da azaltmak için aynı gün içinde neredeyse eşit sayıda WT ve mutant polen için hidrasyon verilerinin toplanması önemlidir. Veriler daha sonra gerekirse farklı günlerde bir araya getirilebilir. Ek olarak, uygun WT kontrol tesislerinin seçilmesi, hidrasyon sonuçlarının doğru yorumlanması için hayati öneme sahiptir. Polen alıcısı için, hem WT kontrolünü hem de mutant polen tanelerini almak için aynı bitki hattı kullanılmalıdır.
Örneğin, video protokolünde de yer alan pA9-barnaz erkek steril bitki hattını, T-DNA polen mutant hatlarını (Şekil 8’de açıklanan ‘KD’ mutantı gibi) araştırırken hem WT (kontrol) hem de mutant (deneysel) polen alıcısı olarak kullanıyoruz. Böyle bir erkek steril hattından gelen ve iğdiş edilmesi gerekmeyen verilerin, manuel olarak iğdiş edilmiş bir kontrol hattından toplananlarla karıştırılmasından kaçınılmalıdır, çünkü bu damgalamalar muhtemelen farklı davranacaktır. Benzer şekilde, iğdiş edilmiş mutant çizgiler, mümkün olduğunda iğdiş edilmiş bir WT (kontrol) hattı ile birlikte kullanılmalıdır. Aynı dikkat, incelenen bitkilerin genetik arka planı göz önüne alındığında da uygulanmalıdır. En popüler T-DNA mutant koleksiyonları Col-0 arka planında üretilirken, Institut national de la Recherche Agronomique’in (INRA) FLAG koleksiyonu gibi diğerleri Wassilewskija (WS) genetik arka planındamevcuttur 24,25. Bu gibi durumlarda, ilgili ekotipin WT tesis hatlarının kontrol olarak kullanılması tavsiye edilir.
Burada polen-stigma etkileşiminin ilk 10 dakikasında polen hidrasyonuna odaklanmış olsak da, bu yöntem daha uzun bir zaman dilimini kapsayan hidrasyon profillerini kapsayacak şekilde uyarlanabilir. Protokolün önemli bir özelliği, çiçeklerin ana bitki akımına bağlı kalmasıdır yayınlanmış protokoller tipik olarak pistilin eksizyonunu ve deney süresi boyunca dokuyu sürdürmek için ortama yerleştirilmesini gerektirir14,18,26. Böyle bir yarı in vivo yaklaşımın polen hidrasyonunu etkilediğini veya gerçekten de bu sürecin in vivo düzenlemesini değiştirdiğini gösteren doğrudan bir kanıt olmamasına rağmen, çiçeklerin ana bitkiden eksizyonunun tozlaşmayı etkileyebileceği düşünülebilir. Böylece, bu protokol, bitkinin yapısal bütünlüğünün korunduğu polen-stigma etkileşiminin incelenmesi için gerçek bir in vivo ortam sağlar.
Tek polen tanelerinin ‘bakire’ stigmatik papillalara transferi, muhtemelen bu protokolde açıklanan en zorlu işlemlerden biridir. Polen taneleri kümelerini yanlışlıkla aktarmak nadir değildir. Bununla birlikte, bunun meydana gelme şansı, forsepslerde sadece tek katmanlı bir polen bulunmasının sağlanmasıyla büyük ölçüde azaltılabilir (Şekil 3A) (veya hatta sadece tek bir polen tanesi; Şekil 5) ve/veya zaten yönlendirilmiş polen tanelerini kullanarak, forsepsin ucundaki diğerlerinden ‘çıkıntı yapacak’ şekilde. Deneyimli bir operatörün, tek bir polenin stigmatik bir papilla hücresine transferini yaklaşık 3 dakika içinde başarıyla tamamlayabildiğini ve 1 saatlik bir süre boyunca beş polen tanesine kadar veri kaydedebildiğini bulduk. Böylece, 2-4 günlük bir süre boyunca, incelenen tesis hatlarının anlamlı istatistiksel analizi için yeterli veri toplanabilir.
İnsan hatası, bu protokolü kullanan çalışmalardan elde edilen veri kümelerinin analizinde potansiyel olarak en büyük varyasyon kaynağıdır. Örneğin, görüntü analizi sırasında ‘polen sınırı’ tanımı, bireysel araştırmacının kararına bağlıdır. Bu nedenle, farklı araştırmacılar tarafından yapılan ölçümlerin, aynı veri kümesinde bile, varyasyon üretme potansiyeli vardır. Mümkün olan her yerde, örnekleme hatalarını en aza indirmek için ölçümleri tek bir araştırmacı yapmalıdır. Ek olarak, WT ve mutant veri kümelerinin analizinin aynı operatör tarafından birleştirilmesi, ‘polen sınırı’ ve operatörler arası varyasyonun potansiyel olarak öznel tanımını reddeder.
Sonuç olarak, model organizma A. thaliana’daki polen hidrasyon profillerini ölçmek için sofistike ancak doğru bir yöntem tanımlanmıştır. Bu protokolü kullanarak, A. thaliana için son derece tutarlı polen hidrasyon verilerinin kolayca elde edilebileceğini gösterdik. Farklı günlerde elde edilen WT tozlaşmaları için üç bağımsız veri grubu, tüm zaman noktalarında% <3'lük tutarlı küçük sapmalar göstermiştir (Şekil 7 ve Ek Tablo S1). Burada sunulan biyotahlil, mevcut protokollerin çoğundan biraz daha karmaşık olmasına rağmen, üretilen verilerin çözünürlüğü, uyumlu tozlaşmayı düzenleyen yolları etkileyen yeni mutantların tanımlanması ve karakterizasyonu için üstün ve uygundur.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Bu araştırma University of Bath (University of Bath, Bath, UK, BA2 7AY) Y.-L.L. lisansüstü bursları ile desteklenmiştir. ve L.W. Şekil 1 BioRender.com (https://biorender.com/) ile oluşturulmuştur.
Materials
| A9-barnase line | University of Bath | Courtsey of Prof. Rod Scott | Male sterile Arabidopsis thaliana wildtype equivalent line of the ecotype Columbia-0 |
| Dumont Tweezer, Dumont #5 Inox 11cm | Fisher | Dumont 500342 | Tweezer uses for transfer of pollen grain |
| GraphPad Prsim (version 8.0.2) | Dotmatics | Prism | Comprehensive data analysis, graphing and statistics software |
| JMP (version 17) | JMP Statistical Discovery LLC | JMP 17 | Statistical analysis software |
| Levington F2S seed & modular compost (with sand) | Levington | LEV75F2SMS | General-purpose compost for plant growth |
| Micromanipulator | Singer instrument Co. LTD. | Singer Micromanipulator | Micromanipulator to aid transfer of pollen grain |
| Nikon Digit sight DS-U1 | Nikon | DS-U1 | Microscope camera (coupletd to SMZ1500) |
| Nikon Eclipse TE2000-S Inverted Microscope | Nikon | TE2000-S | Inverted microscope |
| Nikon SMZ1500 Stereomicroscope | Nikon | SMZ1500 | Stereomicroscope |
| Nikon DS-Fi3 microscope camera | Nikon | DS-Fi3 | Microscope camera (coupletd to TE2000-S) |
| Nikon NIS-Elements Basic Research | Nikon | NIS-Elements BR | Image accquisition and analysis software (for DS-Fi3) |
| Nikon NIS-Elements F | Nikon | NIS-Elements F | Image accquisition and analysis software (for DS-U1) |
| WT Col-0 plant line | NASC | N700000 | Wildtype Arabidopsis thaliana, ecotype Columbia-0 |
References
- Rieseberg, L. H., Willis, J. H. Plant speciation. Science. 317 (5840), 910-914 (2007).
- Hiscock, S. J., Allen, A. M. Diverse cell signalling pathways regulate pollen-stigma interactions: the search for consensus. New Phytologist. 179 (2), 286-317 (2008).
- Kandasamy, M. K., Nasrallah, J. B., Nasrallah, M. E. Pollen pistil interactions and developmental regulation of pollen-tube growth in Arabidopsis. Development. 120 (12), 3405-3418 (1994).
- Bosch, M., Wang, L. Pollen-stigma interactions in Brassicaceae: complex communication events regulating pollen hydration. Journal of Experimental Botany. 71 (9), 2465-2468 (2020).
- Rozier, F., et al. Live-cell imaging of early events following pollen perception in self-incompatible Arabidopsis thaliana. Journal of Experimental Botany. 71 (9), 2513-2526 (2020).
- Dickinson, H. Dry stigmas, water and self-incompatibility in Brassica. Sexual Plant Reproduction. 8, 1-10 (1995).
- Takasaki, T., et al. The S receptor kinase determines self-incompatibility in Brassica stigma. Nature. 403 (6772), 913-916 (2000).
- Schopfer, C. R., Nasrallah, M. E., Nasrallah, J. B. The male determinant of self-incompatibility in Brassica. Science. 286 (5445), 1697-1700 (1999).
- Takayama, S., et al. Direct ligand-receptor complex interaction controls Brassica self-incompatibility. Nature. 413 (6855), 534-538 (2001).
- Shiba, H., et al. A pollen coat protein, SP11/SCR, determines the pollen S-specificity in the self-incompatibility of Brassica species. Plant Physiology. 125 (4), 2095-2103 (2001).
- Broz, A. K., Bedinger, P. A. Pollen-pistil interactions as reproductive barriers. Annual Review of Plant Biology. 72 (1), 615-639 (2021).
- Cheung, A. Y., Duan, Q., Li, C., James Liu, M. -. C., Wu, H. -. M. Pollen-pistil interactions: It takes two to tangle but a molecular cast of many to deliver. Current Opinion in Plant Biology. 69, 102279 (2022).
- Wang, L. D., et al. PCP-B class pollen coat proteins are key regulators of the hydration checkpoint in Arabidopsis thaliana pollen-stigma interactions. New Phytologist. 213 (2), 764-777 (2017).
- Liu, C., et al. Pollen PCP-B peptides unlock a stigma peptide-receptor kinase gating mechanism for pollination. Science. 372 (6538), 171-175 (2021).
- Bordeleau, S. J., Sanchez, L. E. C., Goring, D. R. Finding new Arabidopsis receptor kinases that regulate compatible pollen-pistil interactions. Frontiers in Plant Science. 13, 1022684 (2022).
- Suwabe, K., et al. Double-locking mechanism of self-compatibility in Arabidopsis thaliana: the synergistic effect of transcriptional depression and disruption of coding region in the male specificity gene. Frontiers in Plant Science. 11, 576140 (2020).
- Smyth, D. R., Bowman, J. L., Meyerowitz, E. M. Early flower development in Arabidopsis. Plant Cell. 2 (8), 755-767 (1990).
- Lee, H. K., Macgregor, S., Goring, D. R. A toolkit for teasing apart the early stages of pollen-stigma interactions in Arabidopsis thaliana. Pollen and Pollen Tube Biology. 2160, 13-28 (2020).
- Dilkes, B. P., et al. The maternally expressed WRKY transcription factor TTG2 controls lethality in interploidy crosses of Arabidopsis. PLoS Biology. 6 (12), 2707-2720 (2008).
- Riglet, L., et al. KATANIN-dependent mechanical properties of the stigmatic cell wall mediate the pollen tube path in Arabidopsis. eLife. 9, e57282 (2020).
- Zhou, L. Z., Dresselhaus, T. Friend or foe: Signaling mechanisms during double fertilization in flowering seed plants. Plant Development and Evolution. 131, 453-496 (2019).
- Gao, X. -. Q., et al. The Arabidopsis KINβγ subunit of the SnRK1 complex regulates pollen hydration on the stigma by mediating the level of reactive oxygen species in pollen. PLoS Genetics. 12 (7), e1006228 (2016).
- Lee, H. K., Goring, D. R. Two subgroups of receptor-like kinases promote early compatible pollen responses in the Arabidopsis thaliana pistil. Journal of Experimental Botany. 72 (4), 1198-1211 (2021).
- O’Malley, R. C., Barragan, C. C., Ecker, J. R. A user’s guide to the Arabidopsis T-DNA insertion mutant collections. Pollen and Pollen Tube Biology. 1284, 323-342 (2015).
- Samson, F., et al. FLAGdb++: a database for the functional analysis of the Arabidopsis genome. Nucleic Acids Research. 32, D347-D350 (2004).
- Doucet, J., et al. Investigations into a putative role for the novel BRASSIKIN pseudokinases in compatible pollen-stigma interactions in Arabidopsis thaliana. BMC Plant Biology. 19 (1), 549 (2019).

