Un bioensayo de hidratación de polen in vivo de grano único de alta resolución para Arabidopsis thaliana
Summary
Aquí se describe un método mejorado para medir los perfiles de hidratación del polen en Arabidopsis thaliana . El nuevo método ofrece una resolución más alta, no es invasivo y es altamente reproducible. El protocolo representa una nueva herramienta para una disección más fina de los procesos que regulan las primeras etapas de la polinización.
Abstract
La reproducción sexual en plantas con flores requiere una interacción inicial entre el grano de polen y la superficie estigmatizada, donde se establece un diálogo molecular entre los socios que interactúan. Los estudios en una variedad de especies han revelado que una serie de puntos de control molecular regulan la interacción polen-estigma para garantizar que solo el polen compatible, generalmente intraespecífico, tenga éxito en efectuar la fertilización. En especies que poseen un “estigma seco”, como la planta modelo Arabidopsis thaliana, el primer punto de control de compatibilidad precigótica posterior a la polinización es el establecimiento de la hidratación del polen.
Esta fase de polinización está estrictamente regulada, por lo que las señales del grano de polen provocan la liberación de agua del estigma, lo que permite la hidratación del polen. La capacidad de medir y rastrear con precisión la hidratación del polen a lo largo del tiempo es clave para el diseño de experimentos dirigidos a comprender la regulación de este paso crítico en la reproducción. Los protocolos publicados con frecuencia utilizan flores que han sido extirpadas de la planta madre, mantenidas en medios líquidos o sólidos y polinizadas a granel.
Este documento describe un bioensayo de polinización in vivo no invasivo que permite el seguimiento minuto a minuto de la hidratación de granos individuales de polen de A. thaliana a alta resolución. El ensayo es altamente reproducible, capaz de detectar variaciones muy sutiles de los perfiles de hidratación del polen y, por lo tanto, es adecuado para el análisis de mutantes que afectan las vías que regulan la polinización. Aunque el protocolo es más largo que los descritos para polinización a granel, la precisión y reproducibilidad que proporciona, junto con su naturaleza in vivo , lo hacen ideal para la disección detallada de fenotipos de polinización.
Introduction
La reproducción sexual exitosa en las angiospermas generalmente se basa en la transferencia de granos de polen intraespecíficos de la antera al estigma, ya sea dentro o entre individuos (es decir, polinización). Esta transferencia de granos de polen a una flor receptiva suele estar mediada por polinizadores o factores abióticos; Como tal, esto también resulta con frecuencia en la deposición de polen heteroespecífico en condiciones naturales. Con algunas excepciones, la progresión de la polinización por polen heteroespecífico es evolutivamente desventajosa, reduciendo la aptitud reproductiva a través de la pérdida de oportunidades de apareamiento, con la mayoría de la progenie híbrida resultante que no se desarrolla adecuadamente o es estéril1. Así, los mecanismos han evolucionado para bloquear la polinización por polen heteroespecífico “incompatible”2. El reconocimiento rápido del polen compatible es, por lo tanto, posiblemente el proceso más importante en las primeras etapas de la reproducción sexual en muchas plantas con flores.
En la familia Brassicaceae, donde los estigmas son del tipo “seco”, una serie de puntos de control molecular actúan en múltiples etapas del proceso reproductivo regulando la polinización, de modo que solo el polen compatible tiene éxito. La hidratación del polen es uno de los puntos de control más importantes (Figura 1), ya que el polen que no se hidrata no puede progresar para producir un tubo polínico y posteriormente entregar espermatozoides al gametofito femenino. Con frecuencia, los granos incompatibles no pasan este primer punto de control de polinización y, por lo tanto, no tienen acceso al agua estigmatizada3. Entre los miembros de la familia Brassicaceae, el reconocimiento del polen ocurre rápidamente, estableciéndose la compatibilidad a los pocos minutos de la fijación del grano de polen al pistilo 4,5. En los últimos años, se ha avanzado mucho, y ahora estamos empezando a comprender los mecanismos moleculares que regulan los puntos de control clave de la polinización.
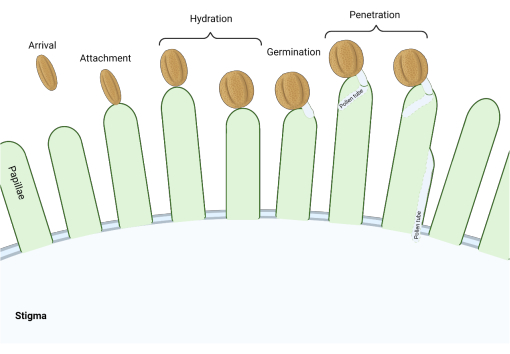
Figura 1: Descripción general de los eventos clave durante la polinización compatible. Estas etapas, como la hidratación del polen y la germinación del tubo polínico, también son “puntos de control” de polinización que deben navegarse con éxito para efectuar una polinización compatible. El diagrama representa un estigma de tipo ‘seco’, que es típico de las especies de la familia Brassicaceae 2,20. Haga clic aquí para ver una versión más grande de esta figura.
La investigación pionera sobre el sistema de autoincompatibilidad (SI) de Brassica, donde el polen “propio” es reconocido y rechazado, estableció el paradigma para el reconocimiento del polen-estigma en Brassicaceae 6,7,8,9,10. El IS en Brassica y sus parientes está mediado por proteínas de “reconocimiento” que residen en la superficie del polen y en la membrana plasmática estigmatizada que, tras la interacción, conducen al rechazo del polen. El rechazo del polen del SI opera mediante la interrupción del sistema de compatibilidad polen-estigma basal que, cuando se activa completamente por la percepción del polen compatible, conduce a una secreción dirigida por el estigma, impulsando así la hidratación del polen (para revisiones del mecanismo de compatibilidad del polen, ver11,12). En el ejemplo de SI, el ligando transmitido por el polen es una pequeña proteína rica en cisteína, rica en cisteína S-locus (SCR/SP11), y el receptor estigmatizado es la quinasa receptora del locus S (SRK).
Recientemente, en Arabidopsis thaliana, se ha encontrado que otro grupo de pequeñas proteínas transmitidas por el polen ricas en cisteína, la proteína de recubrimiento del polen clase B (AtPCP-Bs), son importantes reguladores de la aceptación del polen a través de la activación de la hidratación del polen13. Los receptores estigmatizados de los AtPCP-B y aspectos de la vía reguladora aguas abajo también se han descrito recientemente14,15. Curiosamente, los estudios mutacionales de genes que codifican posibles mediadores de señalización de la hidratación del polen y enigmáticos transmitidos por el polen (incluidos losPCP-B) no han logrado generar plantas que tengan un bloqueo completo en el punto de control de hidratación del polen. Esto sugiere fuertemente que muchos otros factores, aún no descubiertos, juegan un papel en la regulación de la hidratación del polen. Sobre la base del método descrito por primera vez por Wang et al.13, aquí describimos un bioensayo in vivo mejorado de alta resolución adecuado para la identificación de defectos sutiles de hidratación del polen en líneas candidatas mutantes de A. thaliana.
Protocol
Representative Results
Discussion
Para las plantas con flores, las primeras etapas de la reproducción sexual son posiblemente las más importantes. A nivel de la interacción polen-estigma, se toman decisiones moleculares que determinan la “compatibilidad” de los socios que interactúan. Tales decisiones, si se toman correctamente, evitan el desperdicio de recursos que podrían afectar la aptitud reproductiva21. Por lo tanto, permitir que solo el polen compatible efectúe la fertilización es un componente importante para mantener genotipos bien adaptados y, por lo tanto, para el éxito evolutivo de las especies. La investigación realizada con la planta modelo A. thaliana ha sido extremadamente valiosa para profundizar nuestra comprensión de este proceso. Varios estudios realizados en las últimas décadas han revelado la presencia de factores en la capa de polen que actúan en el primer “punto de control” de compatibilidad, donde el polen obtiene acceso al agua estigmatizada para permitir la hidratación del polen13. A pesar de estas primeras ideas sobre los mecanismos que regulan la compatibilidad polen-estigma, todavía hay muchas lagunas en nuestra comprensión de este proceso. Hasta la fecha, ningún mutante de ligandos transmitidos por el polen o receptores estigmatizados conocidos por afectar la hidratación del polen puede bloquear completamente la polinización compatible, lo que sugiere la presencia de otros determinantes de hidratación del polen no descubiertos. Al poder observar fácilmente el fenotipo de interés, el bioensayo de hidratación del polen descrito aquí es una de las técnicas más sencillas para estudiar los mutantes potenciales que regulan la polinización.
Las metodologías existentes para medir la hidratación del polen comúnmente utilizan polinización a granel e informan menos puntos de tiempo 14,22,23, y por lo tanto pueden pasar por alto importantes fenotipos de perfil de hidratación sutil. Por ejemplo, el estudio de Wang et al.13, junto con el trabajo sobre otros mutantes de proteínas de recubrimiento de polen en nuestro laboratorio (observaciones no publicadas), han revelado diferencias intrigantes en los perfiles de hidratación entre mutantes. Tales diferencias sutiles pueden contener pistas importantes sobre los mecanismos reguladores que subyacen a la polinización compatible.
El método descrito aquí se centra en la adquisición de un número relativamente pequeño de mediciones entre líneas de plantas mutantes y WT, con énfasis en la precisión metodológica para reducir la variación dentro de los conjuntos de datos. Si bien este método es altamente reproducible (como se muestra en la Figura 7), suponiendo que la temperatura y la humedad se controlen adecuadamente, es importante recopilar datos de hidratación para un número casi igual de WT y polen mutante en el mismo día para reducir aún más el potencial de variación. Los datos se pueden agrupar en diferentes días si es necesario. Además, seleccionar las plantas de control WT adecuadas es vital para la correcta interpretación de los resultados de hidratación. Para el receptor de polen, se debe usar la misma línea de plantas para recibir tanto el control de WT como los granos de polen mutantes.
Por ejemplo, utilizamos la línea de plantas estériles masculinas pA9-barnasa, que también aparece en el protocolo de video, como receptor de polen tanto para WT (control) como para polen mutante (experimental) cuando investigamos líneas mutantes de polen de ADN-T (como el mutante ‘KD’ descrito en la Figura 8). Se debe evitar la mezcla de datos de una línea estéril masculina de este tipo, que no necesita ser castrada, con los recopilados de una línea de control castrada manualmente, ya que estos estigmas probablemente se comportarán de manera diferente. Del mismo modo, las líneas mutantes castradas deben utilizarse junto con una línea WT (control) castrada siempre que sea posible. La misma precaución también debe aplicarse al considerar los antecedentes genéticos de las plantas en estudio. Mientras que las colecciones mutantes de ADN-T más populares se generaron en el fondo Col-0, otras, como la colección FLAG del Institut national de la Recherche Agronomique (INRA), están disponibles en el fondo genético de Wassilewskija (WS)24,25. En tales casos, es aconsejable utilizar las líneas de plantas WT del ecotipo respectivo como controles.
Aunque aquí nos hemos centrado en la hidratación del polen durante los primeros 10 minutos de la interacción polen-estigma, este método también se puede adaptar para abarcar perfiles de hidratación que cubren un período de tiempo más largo. Una característica clave del protocolo es que las flores permanecen unidas a la planta madre; los protocolos publicados por corriente generalmente requieren la escisión del pistilo y la colocación en medios para sostener el tejido durante la duración del experimento14,18,26. Aunque no hay evidencia directa que sugiera que tal enfoque semi in vivo afecte la hidratación del polen o de hecho altere la regulación in vivo de este proceso, es concebible que la escisión de las flores de la planta madre pueda afectar la polinización. Así, este protocolo consigue un verdadero ambiente in vivo para el estudio de la interacción polen-estigma, donde se preserva la integridad estructural de la planta.
La transferencia de granos de polen individuales a papilas estigmatizadas “vírgenes” es posiblemente una de las operaciones más desafiantes descritas en este protocolo. No es raro transferir grupos de granos de polen por error. Sin embargo, la posibilidad de que esto ocurra puede reducirse en gran medida asegurándose de que solo una monocapa de polen esté presente en las pinzas (Figura 3A) (o incluso un solo grano de polen; Figura 5), y/o utilizando granos de polen que ya están orientados, de tal manera que “sobresalen” de otros en la punta de los fórceps. Hemos descubierto que un operador experimentado puede completar con éxito la transferencia de un solo polen a una célula de papila estigmatizada en aproximadamente 3 minutos y registrar datos de hasta cinco granos de polen durante un período de 1 hora. Por lo tanto, durante un período de 2-4 días, se pueden acumular suficientes datos para un análisis estadístico significativo de las líneas de plantas en estudio.
El error humano es potencialmente la mayor fuente de variación en el análisis de conjuntos de datos derivados de estudios que utilizan este protocolo. Por ejemplo, la definición del “límite del polen” durante el análisis de imágenes se reduce al juicio del investigador individual. Por lo tanto, existe la posibilidad de que las mediciones realizadas por diferentes investigadores, incluso en el mismo conjunto de datos, puedan generar variación. Siempre que sea posible, un solo investigador debe llevar a cabo las mediciones para minimizar los errores de muestreo. Además, el acoplamiento del análisis de WT y conjuntos de datos mutantes por el mismo operador niega la definición potencialmente subjetiva del «límite del polen» y la variación entre operadores.
En conclusión, se describe un método sofisticado pero preciso para medir los perfiles de hidratación del polen en el organismo modelo A. thaliana. Hemos demostrado que, al utilizar este protocolo, se pueden adquirir fácilmente datos de hidratación de polen altamente consistentes para A. thaliana. Tres lotes independientes de datos para polinización de WT adquiridos en diferentes días mostraron pequeñas desviaciones consistentes del <3% en todos los puntos temporales (Figura 7 y Tabla Suplementaria S1). Aunque el bioensayo presentado aquí es ligeramente más complejo que la mayoría de los protocolos existentes, la resolución de los datos generados es superior y adecuada para la identificación y caracterización de nuevos mutantes que impactan en las vías que regulan la polinización compatible.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Esta investigación fue apoyada por las becas de posgrado de la Universidad de Bath (Universidad de Bath, Bath, Reino Unido, BA2 7AY) para Y.-L.L. y L.W. La Figura 1 fue creada con BioRender.com (https://biorender.com/).
Materials
| A9-barnase line | University of Bath | Courtsey of Prof. Rod Scott | Male sterile Arabidopsis thaliana wildtype equivalent line of the ecotype Columbia-0 |
| Dumont Tweezer, Dumont #5 Inox 11cm | Fisher | Dumont 500342 | Tweezer uses for transfer of pollen grain |
| GraphPad Prsim (version 8.0.2) | Dotmatics | Prism | Comprehensive data analysis, graphing and statistics software |
| JMP (version 17) | JMP Statistical Discovery LLC | JMP 17 | Statistical analysis software |
| Levington F2S seed & modular compost (with sand) | Levington | LEV75F2SMS | General-purpose compost for plant growth |
| Micromanipulator | Singer instrument Co. LTD. | Singer Micromanipulator | Micromanipulator to aid transfer of pollen grain |
| Nikon Digit sight DS-U1 | Nikon | DS-U1 | Microscope camera (coupletd to SMZ1500) |
| Nikon Eclipse TE2000-S Inverted Microscope | Nikon | TE2000-S | Inverted microscope |
| Nikon SMZ1500 Stereomicroscope | Nikon | SMZ1500 | Stereomicroscope |
| Nikon DS-Fi3 microscope camera | Nikon | DS-Fi3 | Microscope camera (coupletd to TE2000-S) |
| Nikon NIS-Elements Basic Research | Nikon | NIS-Elements BR | Image accquisition and analysis software (for DS-Fi3) |
| Nikon NIS-Elements F | Nikon | NIS-Elements F | Image accquisition and analysis software (for DS-U1) |
| WT Col-0 plant line | NASC | N700000 | Wildtype Arabidopsis thaliana, ecotype Columbia-0 |
References
- Rieseberg, L. H., Willis, J. H. Plant speciation. Science. 317 (5840), 910-914 (2007).
- Hiscock, S. J., Allen, A. M. Diverse cell signalling pathways regulate pollen-stigma interactions: the search for consensus. New Phytologist. 179 (2), 286-317 (2008).
- Kandasamy, M. K., Nasrallah, J. B., Nasrallah, M. E. Pollen pistil interactions and developmental regulation of pollen-tube growth in Arabidopsis. Development. 120 (12), 3405-3418 (1994).
- Bosch, M., Wang, L. Pollen-stigma interactions in Brassicaceae: complex communication events regulating pollen hydration. Journal of Experimental Botany. 71 (9), 2465-2468 (2020).
- Rozier, F., et al. Live-cell imaging of early events following pollen perception in self-incompatible Arabidopsis thaliana. Journal of Experimental Botany. 71 (9), 2513-2526 (2020).
- Dickinson, H. Dry stigmas, water and self-incompatibility in Brassica. Sexual Plant Reproduction. 8, 1-10 (1995).
- Takasaki, T., et al. The S receptor kinase determines self-incompatibility in Brassica stigma. Nature. 403 (6772), 913-916 (2000).
- Schopfer, C. R., Nasrallah, M. E., Nasrallah, J. B. The male determinant of self-incompatibility in Brassica. Science. 286 (5445), 1697-1700 (1999).
- Takayama, S., et al. Direct ligand-receptor complex interaction controls Brassica self-incompatibility. Nature. 413 (6855), 534-538 (2001).
- Shiba, H., et al. A pollen coat protein, SP11/SCR, determines the pollen S-specificity in the self-incompatibility of Brassica species. Plant Physiology. 125 (4), 2095-2103 (2001).
- Broz, A. K., Bedinger, P. A. Pollen-pistil interactions as reproductive barriers. Annual Review of Plant Biology. 72 (1), 615-639 (2021).
- Cheung, A. Y., Duan, Q., Li, C., James Liu, M. -. C., Wu, H. -. M. Pollen-pistil interactions: It takes two to tangle but a molecular cast of many to deliver. Current Opinion in Plant Biology. 69, 102279 (2022).
- Wang, L. D., et al. PCP-B class pollen coat proteins are key regulators of the hydration checkpoint in Arabidopsis thaliana pollen-stigma interactions. New Phytologist. 213 (2), 764-777 (2017).
- Liu, C., et al. Pollen PCP-B peptides unlock a stigma peptide-receptor kinase gating mechanism for pollination. Science. 372 (6538), 171-175 (2021).
- Bordeleau, S. J., Sanchez, L. E. C., Goring, D. R. Finding new Arabidopsis receptor kinases that regulate compatible pollen-pistil interactions. Frontiers in Plant Science. 13, 1022684 (2022).
- Suwabe, K., et al. Double-locking mechanism of self-compatibility in Arabidopsis thaliana: the synergistic effect of transcriptional depression and disruption of coding region in the male specificity gene. Frontiers in Plant Science. 11, 576140 (2020).
- Smyth, D. R., Bowman, J. L., Meyerowitz, E. M. Early flower development in Arabidopsis. Plant Cell. 2 (8), 755-767 (1990).
- Lee, H. K., Macgregor, S., Goring, D. R. A toolkit for teasing apart the early stages of pollen-stigma interactions in Arabidopsis thaliana. Pollen and Pollen Tube Biology. 2160, 13-28 (2020).
- Dilkes, B. P., et al. The maternally expressed WRKY transcription factor TTG2 controls lethality in interploidy crosses of Arabidopsis. PLoS Biology. 6 (12), 2707-2720 (2008).
- Riglet, L., et al. KATANIN-dependent mechanical properties of the stigmatic cell wall mediate the pollen tube path in Arabidopsis. eLife. 9, e57282 (2020).
- Zhou, L. Z., Dresselhaus, T. Friend or foe: Signaling mechanisms during double fertilization in flowering seed plants. Plant Development and Evolution. 131, 453-496 (2019).
- Gao, X. -. Q., et al. The Arabidopsis KINβγ subunit of the SnRK1 complex regulates pollen hydration on the stigma by mediating the level of reactive oxygen species in pollen. PLoS Genetics. 12 (7), e1006228 (2016).
- Lee, H. K., Goring, D. R. Two subgroups of receptor-like kinases promote early compatible pollen responses in the Arabidopsis thaliana pistil. Journal of Experimental Botany. 72 (4), 1198-1211 (2021).
- O’Malley, R. C., Barragan, C. C., Ecker, J. R. A user’s guide to the Arabidopsis T-DNA insertion mutant collections. Pollen and Pollen Tube Biology. 1284, 323-342 (2015).
- Samson, F., et al. FLAGdb++: a database for the functional analysis of the Arabidopsis genome. Nucleic Acids Research. 32, D347-D350 (2004).
- Doucet, J., et al. Investigations into a putative role for the novel BRASSIKIN pseudokinases in compatible pollen-stigma interactions in Arabidopsis thaliana. BMC Plant Biology. 19 (1), 549 (2019).

