Un saggio biologico di idratazione del polline in vivo ad alta risoluzione, a granulo, singolo grano per Arabidopsis thaliana
Summary
Un metodo migliorato per misurare i profili di idratazione del polline in Arabidopsis thaliana è descritto qui. Il nuovo metodo offre una risoluzione più elevata, non è invasivo ed è altamente riproducibile. Il protocollo rappresenta un nuovo strumento per una più fine dissezione dei processi che regolano le prime fasi dell’impollinazione.
Abstract
La riproduzione sessuale nelle piante da fiore richiede un’interazione iniziale tra il granello di polline e la superficie stigmatica, dove si stabilisce un dialogo molecolare tra i partner interagenti. Studi su una serie di specie hanno rivelato che una serie di checkpoint molecolari regolano l’interazione polline-stigma per garantire che solo il polline compatibile, generalmente intraspecifico, abbia successo nell’effettuare la fecondazione. Nelle specie che possiedono uno “stigma secco”, come la pianta modello Arabidopsis thaliana, il primo checkpoint di compatibilità prezigotica post-impollinazione è l’istituzione dell’idratazione del polline.
Questa fase di impollinazione è strettamente regolata, per cui i segnali del granello di polline suscitano il rilascio di acqua dallo stigma, consentendo così l’idratazione del polline. La capacità di misurare e tracciare con precisione l’idratazione del polline nel tempo è fondamentale per la progettazione di esperimenti diretti a comprendere la regolazione di questa fase critica della riproduzione. I protocolli pubblicati utilizzano frequentemente fiori che sono stati asportati dalla pianta madre, mantenuti su supporti liquidi o solidi e impollinati alla rinfusa.
Questo articolo descrive un saggio biologico di impollinazione non invasivo in vivo che consente il monitoraggio dell’idratazione minuto per minuto dei singoli grani di polline di A. thaliana ad alta risoluzione. Il test è altamente riproducibile, in grado di rilevare variazioni molto sottili dei profili di idratazione del polline, ed è quindi adatto per l’analisi di mutanti che influenzano le vie che regolano l’impollinazione. Sebbene il protocollo sia più lungo di quelli descritti per l’impollinazione di massa, la precisione e la riproducibilità che fornisce, insieme alla sua natura in vivo , lo rendono ideale per la dissezione dettagliata dei fenotipi di impollinazione.
Introduction
Il successo della riproduzione sessuale nelle angiosperme si basa tipicamente sul trasferimento di granuli di polline intraspecifici dall’antera allo stigma, sia all’interno che tra gli individui (cioè l’impollinazione). Questo trasferimento di granuli di polline a un fiore ricettivo è solitamente mediato da impollinatori o fattori abiotici; Come tale, questo spesso provoca anche la deposizione di polline eterospecifico in condizioni naturali. Con poche eccezioni, la progressione dell’impollinazione da parte del polline eterospecifico è evolutivamente svantaggiosa, riducendo l’idoneità riproduttiva attraverso la perdita di opportunità di accoppiamento, con la maggior parte della progenie ibrida risultante che non riesce a svilupparsi in modo appropriato o è sterile1. Pertanto, si sono evoluti meccanismi per bloccare l’impollinazione da polline eterospecifico “incompatibile”2. Il rapido riconoscimento del polline compatibile è quindi probabilmente il processo più importante nelle prime fasi della riproduzione sessuale in molte piante da fiore.
Nella famiglia delle Brassicaceae, dove gli stimmi sono di tipo “secco”, una serie di checkpoint molecolari agiscono in più fasi del processo riproduttivo regolando l’impollinazione, in modo tale che solo il polline compatibile abbia successo. L’idratazione del polline è uno dei punti di controllo più importanti (Figura 1), poiché il polline che non riesce a idratarsi non può progredire per produrre un tubo pollinico e successivamente consegnare lo sperma al gametofito femminile. Spesso, i cereali incompatibili non riescono a superare questo primo punto di controllo dell’impollinazione e quindi non ottengono l’accesso all’acqua stigmatica3. Tra i membri della famiglia delle Brassicaceae, il riconoscimento del polline avviene rapidamente, con compatibilità stabilita entro pochi minuti dall’attaccamento del granello di polline al pistillo 4,5. Negli ultimi anni sono stati fatti molti progressi e ora stiamo iniziando a capire i meccanismi molecolari che regolano i punti chiave di controllo dell’impollinazione.
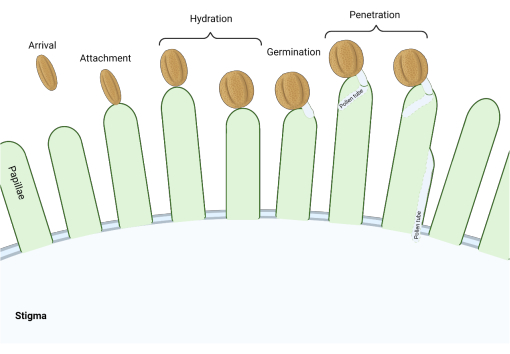
Figura 1: Panoramica degli eventi chiave durante l’impollinazione compatibile. Queste fasi, come l’idratazione del polline e la germinazione del tubo pollinico, sono anche “punti di controllo” di impollinazione che devono essere navigati con successo per effettuare un’impollinazione compatibile. Il diagramma rappresenta uno stigma di tipo “secco”, tipico delle specie della famiglia delle Brassicaceae 2,20. Fare clic qui per visualizzare una versione ingrandita di questa figura.
La ricerca pionieristica sul sistema di auto-incompatibilità (SI) di Brassica, in cui il polline “self” viene riconosciuto e rifiutato, ha stabilito il paradigma per il riconoscimento dello stigma del polline nelle Brassicaceae 6,7,8,9,10. L’SI in Brassica e nei suoi parenti è mediato da proteine di “riconoscimento” che risiedono sulla superficie del polline e sulla membrana plasmatica stigmatica che, dopo interazione, portano al rigetto del polline. Il rigetto del polline SI opera per interruzione del sistema basale di compatibilità polline-stigma che, quando completamente attivato dalla percezione del polline compatibile, porta alla secrezione mirata da parte dello stigma, guidando così l’idratazione del polline (per le revisioni del meccanismo di compatibilità del polline, vedi11,12). Nell’esempio di SI, il ligando trasmesso dal polline è una piccola proteina ricca di cisteina, ricca di cisteina S-locus (SCR / SP11) e il recettore stigmatico è la chinasi del recettore S-locus (SRK).
Recentemente, in Arabidopsis thaliana, un altro gruppo di piccole proteine polline ricche di cisteina, la proteina del rivestimento pollinico di classe B (AtPCP-Bs), è stata trovata per essere importanti regolatori dell’accettazione del polline attraverso l’attivazione dell’idratazione del polline13. Recentemente sono stati descritti anche recettori stigmatici dell’AtPCP-B e aspetti del percorso regolatorio a valle14,15. È interessante notare che gli studi mutazionali sui geni che codificano potenziali mediatori di segnalazione del polline e stigmatici dell’idratazione del polline (compresi i PCP-B) non sono riusciti a generare piante che hanno un blocco completo al checkpoint di idratazione del polline. Ciò suggerisce fortemente che molteplici altri fattori, ancora non scoperti, svolgono un ruolo nella regolazione dell’idratazione del polline. Basandoci sul metodo descritto per la prima volta da Wang et al.13, qui descriviamo un saggio biologico in vivo ad alta risoluzione migliorato adatto per l’identificazione di sottili difetti di idratazione del polline nelle linee candidate mutanti di A. thaliana.
Protocol
Representative Results
Discussion
Per le piante da fiore, le primissime fasi della riproduzione sessuale sono probabilmente le più importanti. A livello dell’interazione polline-stigma, vengono prese decisioni molecolari che determinano la “compatibilità” dei partner interagenti. Tali decisioni, se prese correttamente, evitano lo spreco di risorse che potrebbe influire sull’idoneità riproduttiva21. Pertanto, consentire solo al polline compatibile di effettuare la fecondazione è una componente importante del mantenimento di genotipi ben adattati, e quindi del successo evolutivo delle specie. La ricerca condotta con la pianta modello A. thaliana è stata estremamente preziosa per approfondire la nostra comprensione di questo processo. Numerosi studi negli ultimi decenni hanno rivelato la presenza di fattori nel rivestimento pollinico che agiscono al primo “checkpoint” di compatibilità, dove il polline ottiene l’accesso all’acqua stigmatica per consentire l’idratazione del polline13. Nonostante queste prime intuizioni sui meccanismi che regolano la compatibilità tra polline e stigma, ci sono ancora molte lacune nella nostra comprensione di questo processo. Ad oggi, nessun mutante di ligandi trasmessi dal polline o recettori stigmatici noti per influenzare l’idratazione del polline può bloccare completamente l’impollinazione compatibile, suggerendo la presenza di altri determinanti di idratazione del polline non scoperti. Essendo in grado di osservare prontamente il fenotipo di interesse, il saggio biologico di idratazione del polline qui descritto è una delle tecniche più semplici per studiare potenziali mutanti che regolano l’impollinazione.
Le metodologie esistenti per misurare l’idratazione del polline utilizzano comunemente impollinazioni di massa e riportano meno punti temporali 14,22,23, e quindi possono perdere importanti fenotipi sottili del profilo di idratazione. Ad esempio, lo studio di Wang et al.13, insieme al lavoro su altri mutanti della proteina del rivestimento pollinico nel nostro laboratorio (osservazioni non pubblicate), hanno rivelato differenze intriganti nei profili di idratazione tra i mutanti. Tali sottili differenze possono contenere importanti indizi sui meccanismi regolatori alla base dell’impollinazione compatibile.
Il metodo qui descritto si concentra sull’acquisizione di un numero relativamente piccolo di misurazioni tra linee di piante mutanti e WT, con particolare attenzione alla precisione metodologica per ridurre la variazione all’interno dei set di dati. Sebbene questo metodo sia altamente riproducibile (come mostrato nella Figura 7), supponendo che la temperatura e l’umidità siano adeguatamente controllate, è importante raccogliere dati di idratazione per un numero quasi uguale di WT e polline mutante nello stesso giorno per ridurre ulteriormente il potenziale di variazione. I dati possono quindi essere raggruppati in giorni diversi, se necessario. Inoltre, la selezione degli impianti di controllo WT appropriati è fondamentale per una corretta interpretazione dei risultati di idratazione. Per il destinatario del polline, la stessa linea vegetale dovrebbe essere utilizzata per ricevere sia il controllo WT che i grani di polline mutanti.
Ad esempio, utilizziamo la linea di piante sterili maschili pA9-barnase, che è anche presente nel protocollo video, come destinatario del polline sia per WT (controllo) che per il polline mutante (sperimentale) quando studiamo le linee mutanti del polline del T-DNA (come il mutante “KD” descritto nella Figura 8). La mescolanza dei dati provenienti da una tale linea sterile maschile, che non deve essere evirata, con quelli raccolti da una linea di controllo evirata manualmente dovrebbe essere evitata poiché questi stigmi probabilmente si comporteranno in modo diverso. Allo stesso modo, le linee mutanti evirate dovrebbero essere utilizzate in combinazione con una linea WT (controllo) evirata quando possibile. La stessa cautela dovrebbe essere applicata anche quando si considera il background genetico delle piante in studio. Mentre le collezioni più popolari di mutanti del T-DNA sono state generate nello sfondo Col-0, altre, come la collezione FLAG dell’Institut national de la Recherche Agronomique (INRA), sono disponibili nel background genetico Wassilewskija (WS)24,25. In tali casi, è consigliabile utilizzare come controlli le linee di impianti WT del rispettivo ecotipo.
Sebbene qui ci siamo concentrati sull’idratazione del polline nei primi 10 minuti dell’interazione polline-stigma, questo metodo può anche essere adattato per comprendere profili di idratazione che coprono un periodo di tempo più lungo. Una caratteristica chiave del protocollo è che i fiori rimangono attaccati alla corrente della pianta madre I protocolli pubblicati richiedono tipicamente l’escissione del pistillo e il posizionamento nei mezzi per sostenere il tessuto per la durata dell’esperimento14,18,26. Sebbene non vi siano prove dirette che suggeriscano che un tale approccio semi in vivo influisca sull’idratazione del polline o addirittura alteri la regolazione in vivo di questo processo, è concepibile che l’escissione dei fiori dalla pianta madre possa influire sull’impollinazione. Pertanto, questo protocollo raggiunge un vero ambiente in vivo per lo studio dell’interazione polline-stigma, in cui viene preservata l’integrità strutturale della pianta.
Il trasferimento di singoli granuli di polline a papille stigmatiche “vergini” è probabilmente una delle operazioni più impegnative descritte in questo protocollo. Non è raro trasferire grappoli di granuli di polline per errore. Tuttavia, la possibilità che ciò si verifichi può essere notevolmente ridotta assicurando che solo un monostrato di polline sia presente sul forcipe (Figura 3A) (o anche solo un singolo granello di polline; Figura 5), e/o utilizzando granelli di polline già orientati, in modo tale che “sporgano” dagli altri sulla punta della pinza. Abbiamo scoperto che un operatore esperto può completare con successo il trasferimento di un singolo polline a una cellula di papilla stigmatica in circa 3 minuti e registrare i dati per un massimo di cinque grani di polline in un periodo di 1 ora. Pertanto, in un periodo di 2-4 giorni, è possibile accumulare dati sufficienti per un’analisi statistica significativa delle linee di piante in studio.
L’errore umano è potenzialmente la più grande fonte di variazione nell’analisi dei set di dati derivati da studi che utilizzano questo protocollo. Ad esempio, la definizione del “confine del polline” durante l’analisi delle immagini dipende dal giudizio del singolo ricercatore. Pertanto, esiste la possibilità che le misurazioni effettuate da diversi ricercatori, anche sullo stesso set di dati, possano generare variazioni. Ove possibile, un singolo ricercatore dovrebbe effettuare le misurazioni per ridurre al minimo gli errori di campionamento. Inoltre, l’accoppiamento dell’analisi di WT e set di dati mutanti da parte dello stesso operatore nega la definizione potenzialmente soggettiva del “confine del polline” e della variazione interoperatore.
In conclusione, viene descritto un metodo sofisticato ma accurato per misurare i profili di idratazione del polline nell’organismo modello A. thaliana. Abbiamo dimostrato che, utilizzando questo protocollo, è possibile acquisire facilmente dati di idratazione del polline altamente coerenti per A. thaliana. Tre lotti indipendenti di dati per l’impollinazione WT acquisiti in giorni diversi hanno mostrato piccole deviazioni costanti del <3% in tutti i punti temporali (Figura 7 e Tabella supplementare S1). Sebbene il biotest qui presentato sia leggermente più complesso rispetto alla maggior parte dei protocolli esistenti, la risoluzione dei dati generati è superiore e adatta per l’identificazione e la caratterizzazione di nuovi mutanti che influenzano i percorsi che regolano l’impollinazione compatibile.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Questa ricerca è stata supportata dalle borse di studio post-laurea dell’Università di Bath (Università di Bath, Bath, Regno Unito, BA2 7AY) a Y.-L.L. e L.W. Figure 1 è stato creato con BioRender.com (https://biorender.com/).
Materials
| A9-barnase line | University of Bath | Courtsey of Prof. Rod Scott | Male sterile Arabidopsis thaliana wildtype equivalent line of the ecotype Columbia-0 |
| Dumont Tweezer, Dumont #5 Inox 11cm | Fisher | Dumont 500342 | Tweezer uses for transfer of pollen grain |
| GraphPad Prsim (version 8.0.2) | Dotmatics | Prism | Comprehensive data analysis, graphing and statistics software |
| JMP (version 17) | JMP Statistical Discovery LLC | JMP 17 | Statistical analysis software |
| Levington F2S seed & modular compost (with sand) | Levington | LEV75F2SMS | General-purpose compost for plant growth |
| Micromanipulator | Singer instrument Co. LTD. | Singer Micromanipulator | Micromanipulator to aid transfer of pollen grain |
| Nikon Digit sight DS-U1 | Nikon | DS-U1 | Microscope camera (coupletd to SMZ1500) |
| Nikon Eclipse TE2000-S Inverted Microscope | Nikon | TE2000-S | Inverted microscope |
| Nikon SMZ1500 Stereomicroscope | Nikon | SMZ1500 | Stereomicroscope |
| Nikon DS-Fi3 microscope camera | Nikon | DS-Fi3 | Microscope camera (coupletd to TE2000-S) |
| Nikon NIS-Elements Basic Research | Nikon | NIS-Elements BR | Image accquisition and analysis software (for DS-Fi3) |
| Nikon NIS-Elements F | Nikon | NIS-Elements F | Image accquisition and analysis software (for DS-U1) |
| WT Col-0 plant line | NASC | N700000 | Wildtype Arabidopsis thaliana, ecotype Columbia-0 |
References
- Rieseberg, L. H., Willis, J. H. Plant speciation. Science. 317 (5840), 910-914 (2007).
- Hiscock, S. J., Allen, A. M. Diverse cell signalling pathways regulate pollen-stigma interactions: the search for consensus. New Phytologist. 179 (2), 286-317 (2008).
- Kandasamy, M. K., Nasrallah, J. B., Nasrallah, M. E. Pollen pistil interactions and developmental regulation of pollen-tube growth in Arabidopsis. Development. 120 (12), 3405-3418 (1994).
- Bosch, M., Wang, L. Pollen-stigma interactions in Brassicaceae: complex communication events regulating pollen hydration. Journal of Experimental Botany. 71 (9), 2465-2468 (2020).
- Rozier, F., et al. Live-cell imaging of early events following pollen perception in self-incompatible Arabidopsis thaliana. Journal of Experimental Botany. 71 (9), 2513-2526 (2020).
- Dickinson, H. Dry stigmas, water and self-incompatibility in Brassica. Sexual Plant Reproduction. 8, 1-10 (1995).
- Takasaki, T., et al. The S receptor kinase determines self-incompatibility in Brassica stigma. Nature. 403 (6772), 913-916 (2000).
- Schopfer, C. R., Nasrallah, M. E., Nasrallah, J. B. The male determinant of self-incompatibility in Brassica. Science. 286 (5445), 1697-1700 (1999).
- Takayama, S., et al. Direct ligand-receptor complex interaction controls Brassica self-incompatibility. Nature. 413 (6855), 534-538 (2001).
- Shiba, H., et al. A pollen coat protein, SP11/SCR, determines the pollen S-specificity in the self-incompatibility of Brassica species. Plant Physiology. 125 (4), 2095-2103 (2001).
- Broz, A. K., Bedinger, P. A. Pollen-pistil interactions as reproductive barriers. Annual Review of Plant Biology. 72 (1), 615-639 (2021).
- Cheung, A. Y., Duan, Q., Li, C., James Liu, M. -. C., Wu, H. -. M. Pollen-pistil interactions: It takes two to tangle but a molecular cast of many to deliver. Current Opinion in Plant Biology. 69, 102279 (2022).
- Wang, L. D., et al. PCP-B class pollen coat proteins are key regulators of the hydration checkpoint in Arabidopsis thaliana pollen-stigma interactions. New Phytologist. 213 (2), 764-777 (2017).
- Liu, C., et al. Pollen PCP-B peptides unlock a stigma peptide-receptor kinase gating mechanism for pollination. Science. 372 (6538), 171-175 (2021).
- Bordeleau, S. J., Sanchez, L. E. C., Goring, D. R. Finding new Arabidopsis receptor kinases that regulate compatible pollen-pistil interactions. Frontiers in Plant Science. 13, 1022684 (2022).
- Suwabe, K., et al. Double-locking mechanism of self-compatibility in Arabidopsis thaliana: the synergistic effect of transcriptional depression and disruption of coding region in the male specificity gene. Frontiers in Plant Science. 11, 576140 (2020).
- Smyth, D. R., Bowman, J. L., Meyerowitz, E. M. Early flower development in Arabidopsis. Plant Cell. 2 (8), 755-767 (1990).
- Lee, H. K., Macgregor, S., Goring, D. R. A toolkit for teasing apart the early stages of pollen-stigma interactions in Arabidopsis thaliana. Pollen and Pollen Tube Biology. 2160, 13-28 (2020).
- Dilkes, B. P., et al. The maternally expressed WRKY transcription factor TTG2 controls lethality in interploidy crosses of Arabidopsis. PLoS Biology. 6 (12), 2707-2720 (2008).
- Riglet, L., et al. KATANIN-dependent mechanical properties of the stigmatic cell wall mediate the pollen tube path in Arabidopsis. eLife. 9, e57282 (2020).
- Zhou, L. Z., Dresselhaus, T. Friend or foe: Signaling mechanisms during double fertilization in flowering seed plants. Plant Development and Evolution. 131, 453-496 (2019).
- Gao, X. -. Q., et al. The Arabidopsis KINβγ subunit of the SnRK1 complex regulates pollen hydration on the stigma by mediating the level of reactive oxygen species in pollen. PLoS Genetics. 12 (7), e1006228 (2016).
- Lee, H. K., Goring, D. R. Two subgroups of receptor-like kinases promote early compatible pollen responses in the Arabidopsis thaliana pistil. Journal of Experimental Botany. 72 (4), 1198-1211 (2021).
- O’Malley, R. C., Barragan, C. C., Ecker, J. R. A user’s guide to the Arabidopsis T-DNA insertion mutant collections. Pollen and Pollen Tube Biology. 1284, 323-342 (2015).
- Samson, F., et al. FLAGdb++: a database for the functional analysis of the Arabidopsis genome. Nucleic Acids Research. 32, D347-D350 (2004).
- Doucet, J., et al. Investigations into a putative role for the novel BRASSIKIN pseudokinases in compatible pollen-stigma interactions in Arabidopsis thaliana. BMC Plant Biology. 19 (1), 549 (2019).

