シロイヌナズナの高分解能単粒in in vivo花粉水和バイオアッセイ
Summary
ここでは、シロイヌナズナの花粉水分補給プロファイルを測定するための改善された方法について説明します。新しい方法は、より高い解像度を提供し、非侵襲的であり、再現性が高いです。このプロトコルは、受粉の初期段階を規制するプロセスをより細かく解剖するための新しいツールを表しています。
Abstract
顕花植物の有性生殖は、花粉粒と柱頭表面との間の最初の相互作用を必要とし、そこで相互作用するパートナー間で分子対話が確立される。さまざまな種にわたる研究により、一連の分子チェックポイントが花粉と柱頭の相互作用を調節して、互換性のある、一般的に種内花粉のみが受精に成功することを保証することが明らかになりました。モデル植物 シロイヌナズナのような「乾いた柱頭」を持つ種では、受粉後最初の接合前適合性チェックポイントは花粉水分補給の確立です。
受粉のこの段階は厳しく規制されており、花粉粒からの信号が柱頭からの水分の放出を誘発し、花粉の水和を可能にします。花粉の水和を経時的に正確に測定および追跡する能力は、生殖におけるこの重要なステップの調節を理解することを目的とした実験計画の鍵となります。公開されたプロトコルは、親植物から切り取られ、液体または固体培地で維持され、大量受粉された花を頻繁に利用します。
この論文では、個々のA.タリアナ花粉粒の分ごとの水和追跡を可能にする非侵襲的なin vivo受粉バイオアッセイについて説明します。このアッセイは再現性が高く、花粉の水和プロファイルの非常に微妙な変動を検出できるため、受粉を調節する経路に影響を与える変異体の分析に適しています。このプロトコルは、バルク受粉について説明したものよりも長いですが、それが提供する精度と再現性は、そのin vivoの性質とともに、受粉表現型の詳細な解剖に理想的です。
Introduction
被子植物の有性生殖の成功は、通常、個体内または個体間で、葯から柱頭への種内花粉粒の移動(すなわち受粉)に依存しています。受容的な花への花粉粒のこの移動は、通常、花粉媒介者または非生物的要因によって媒介されます。そのため、これはまた、自然条件下での異種特異的花粉の沈着を頻繁にもたらします。いくつかの例外を除いて、異種特異的花粉による受粉の進行は進化的に不利であり、交配の機会を失うことによって生殖適応度を低下させ、結果として生じるハイブリッド子孫のほとんどは適切に発達しないか、不妊になります1。したがって、メカニズムは、「互換性のない」異種特異的花粉2による受粉をブロックするように進化しました。したがって、互換性のある花粉の迅速な認識は、多くの顕花植物における有性生殖の初期段階において間違いなく最も重要なプロセスです。
柱頭が「乾燥」型であるアブラナ科では、一連の分子チェックポイントが受粉を調節する生殖過程の複数の段階で作用し、互換性のある花粉のみが成功します。花粉の水和は最も重要なチェックポイントの1つです(図1)、水和に失敗した花粉は進行して花粉管を生成し、その後、女性の配偶体に精子を届けることができません。多くの場合、互換性のない穀物はこの最初の受粉チェックポイントを通過できず、したがって柱頭の水にアクセスできません3。アブラナ科のメンバーの間では、花粉の認識が急速に起こり、雌しべ4,5への花粉粒の付着から数分以内に適合性が確立されます。近年、多くの進歩が見られ、主要な受粉チェックポイントを制御する分子メカニズムが理解され始めています。
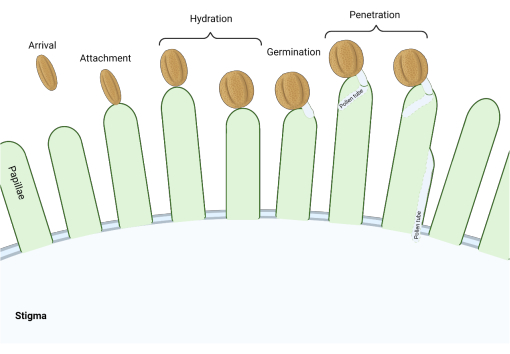
図1:互換性のある受粉中の主要なイベントの概要。花粉の水和や花粉管の発芽などのこれらの段階は、互換性のある受粉を行うためにうまくナビゲートされなければならない受粉の「チェックポイント」でもあります。この図は、アブラナ科の種に典型的な「ドライ」タイプの柱頭を表しています2,20。この図の拡大版を表示するには、ここをクリックしてください。
「自己」花粉が認識され拒絶されるアブラナ属の自己不和合和性(SI)システムに関する先駆的な研究は、アブラナ科の花粉-柱頭認識のパラダイムを確立しました6,7,8,9,10。アブラナ属とその近縁種のSIは、花粉の表面と柱頭の原形質膜に存在する「認識」タンパク質によって媒介され、相互作用すると花粉拒絶を引き起こします。SI花粉除去は、基底花粉-柱頭適合性システムの破壊によって機能し、互換性のある花粉の知覚によって完全に活性化されると、柱頭による標的分泌をもたらし、花粉の水分補給を促進します(花粉適合性メカニズムのレビューについては、11,12を参照)。SIの例では、花粉媒介性リガンドは小さなシステインリッチタンパク質であるS遺伝子座システインリッチ(SCR/SP11)であり、柱頭受容体はS遺伝子座受容体キナーゼ(SRK)です。
最近、システインに富む小さな花粉媒介タンパク質の別のグループであるシロイヌナズナでは、花粉コートタンパク質クラスB(AtPCP-Bs)が、花粉の水和の活性化を通じて花粉受容の重要な調節因子であることが判明しました13。AtPCP-Bsのスティグマ受容体および下流調節経路の態様も最近記載されている14、15。興味深いことに、花粉媒介性および花粉水和のスティグマシグナル伝達メディエーター(AtPCP-Bを含む)をコードする遺伝子の突然変異研究では、花粉の水和チェックポイントへの完全なブロックを持つ植物を生成することができませんでした。これは、他の複数の、まだ発見されていない要因が花粉の水和の調節に役割を果たしていることを強く示唆しています。Wangら13によって最初に記述された方法に基づいて、ここでは、候補変異体A.thaliana系統における微妙な花粉水和欠陥の同定に適した改良された高分解能in vivoバイオアッセイについて説明します。
Protocol
Representative Results
Discussion
開花植物にとって、有性生殖のごく初期の段階は間違いなく最も重要です。花粉と柱頭の相互作用のレベルでは、相互作用するパートナーの「適合性」を決定する分子決定が行われます。このような決定は、正しく行われれば、生殖適応度に影響を与える可能性のある資源の浪費を回避できます21。したがって、互換性のある花粉だけが受精を行うことを許可することは、よく適応した遺伝子型を維持するための重要な要素の1つであり、したがって種の進化的成功です。モデル植物 A. thaliana を用いた研究は、このプロセスの理解を深める上で非常に貴重でした。過去数十年にわたる多くの研究により、花粉が柱頭の水にアクセスして花粉の水和を可能にする最初の互換性「チェックポイント」で作用する花粉コートの要因の存在が明らかになりました13。花粉と柱頭の適合性を調節するメカニズムに関するこれらの最初の洞察にもかかわらず、このプロセスの理解にはまだ多くのギャップがあります。今日まで、花粉媒介性リガンドまたは柱頭受容体の変異体は、花粉の水和に影響を与えることが知られており、互換性のある受粉を完全にブロックすることはできず、他の未発見の花粉水和決定基の存在を示唆しています。ここで説明する花粉水和バイオアッセイは、目的の表現型を容易に観察できるため、受粉を調節する潜在的な変異体を研究するための最も簡単な手法の1つです。
花粉の水和を測定するための既存の方法論は、一般にバルク受粉を利用し、より少ない時点を報告する14,22,23、したがって、重要な微妙な水和プロファイル表現型を見逃す可能性がある。例えば、Wangらによる研究13は、私たちの研究室の他の花粉コートタンパク質変異体に関する研究(未発表の観察)とともに、変異体間の水和プロファイルの興味深い違いを明らかにしました。このような微妙な違いは、互換性のある受粉の根底にある調節メカニズムへの重要な手がかりを保持する可能性があります。
ここで説明する方法は、データセット内の変動を減らすための方法論的精度に重点を置いて、変異株とWT植物系統の間の比較的少数の測定値の取得に焦点を当てています。この方法は再現性が高いですが( 図7を参照)、温度と湿度が適切に制御されていると仮定すると、変動の可能性をさらに減らすために、同じ日にほぼ同数のWTと変異花粉の水和データを収集することが重要です。その後、必要に応じて異なる日にデータをプールできます。さらに、適切なWTコントロールプラントを選択することは、水和結果を正しく解釈するために不可欠です。花粉レシピエントの場合、WTコントロールと変異花粉粒の両方を受け取るために同じ植物ラインを使用する必要があります。
たとえば、T-DNA花粉変異株(図8に示す「KD」変異株など)を調査する際に、WT(対照)および変異体(実験的)花粉の両方の花粉受容者として、ビデオプロトコルにも搭載されているpA9-バルナーゼ雄性無菌植物株を使用します。去勢する必要のないそのような男性の無菌ラインからのデータと手動で去勢されたコントロールラインから収集されたデータの混合は、これらの柱頭が異なる動作をする可能性が高いため、避ける必要があります。同様に、去勢された変異株は、可能な限り去勢されたWT(対照)系統と組み合わせて使用 する必要があります。.研究中の植物の遺伝的背景を考慮するときも同じ注意が適用されるべきです。最も一般的なT-DNA変異体コレクションはCol-0バックグラウンドで生成されましたが、InraのFLAGコレクションなどの他のコレクションは、Wassilewskija(WS)の遺伝的背景24,25で利用できます。このような場合は、それぞれのエコタイプのWTプラントラインをコントロールとして使用することをお勧めします。
ここでは、花粉とスティグマの相互作用の最初の10分間の花粉水和に焦点を当てましたが、この方法は、より長い期間をカバーする水和プロファイルを包含するように適用することもできます。プロトコルの重要な特徴は、花が親植物に付着したままであることである-現在公開されているプロトコルは、典型的には、実験の期間中、組織を維持するために雌しべの切除および培地への配置を必要とする14、18、26。このような半in vivoアプローチが花粉の水和に影響を与えるか、実際にこのプロセスのin vivo調節を変化させることを示唆する直接的な証拠はありませんが、親植物からの花の切除が受粉に影響を与える可能性があると考えられます。したがって、このプロトコルは、植物の構造的完全性が維持される花粉-柱頭相互作用の研究のための真のin vivo環境を達成する。
単一の花粉粒を「処女」柱頭乳頭に移すことは、間違いなくこのプロトコルで説明されている最も困難な操作の1つです。誤って花粉粒のクラスターを転送することは珍しくありません。ただし、鉗子に花粉の単層のみが存在するようにすることで、これが発生する可能性を大幅に減らすことができます(図3A)(または単一の花粉粒; 図5)、および/または鉗子の先端で他の花粉粒から「突き出ている」ように、すでに配向している花粉粒を利用することによって。経験豊富なオペレーターは、約3分で単一の花粉の柱頭細胞への移動を正常に完了し、1時間で最大5つの花粉粒のデータを記録することができることがわかりました。したがって、2〜4日間にわたって、研究中の植物系統の意味のある統計分析に十分なデータを蓄積することができる。
ヒューマンエラーは、このプロトコルを利用した研究から得られたデータセットの分析における変動の最大の原因となる可能性があります。例えば、画像解析における「花粉境界」の定義は、個々の研究者の判断に委ねられています。したがって、同じデータセットであっても、異なる研究者によって行われた測定が変動を生成する可能性があります。可能な限り、サンプリング誤差を最小限に抑えるために、1人の研究者が測定を実行する必要があります。さらに、同じ演算子によるWTデータセットと変異データセットの分析を組み合わせると、「花粉境界」と演算子間の変動の潜在的に主観的な定義が否定されます。
結論として、モデル生物 A. thaliana の花粉水和プロファイルを測定するための洗練された正確な方法が説明されています。このプロトコルを利用することで、 一貫性の高いA. thaliana の花粉水分補給データを容易に取得できることを実証しました。異なる日に取得されたWT受粉のデータの3つの独立したバッチは、すべての時点で<3%の一貫した小さな偏差を示しました(図7 および 補足表S1)。ここで紹介するバイオアッセイは、既存のほとんどのプロトコルよりもわずかに複雑ですが、生成されたデータの分解能は優れており、互換性のある受粉を調節する経路に影響を与える新規変異体の同定と特性評価に適しています。
Disclosures
The authors have nothing to disclose.
Acknowledgements
この研究は、バース大学(バース大学、バース、英国、BA2 7AY)のY.-L.L.への大学院奨学金によって支援されました。 図1 は BioRender.com(https://biorender.com/)で作成されました。
Materials
| A9-barnase line | University of Bath | Courtsey of Prof. Rod Scott | Male sterile Arabidopsis thaliana wildtype equivalent line of the ecotype Columbia-0 |
| Dumont Tweezer, Dumont #5 Inox 11cm | Fisher | Dumont 500342 | Tweezer uses for transfer of pollen grain |
| GraphPad Prsim (version 8.0.2) | Dotmatics | Prism | Comprehensive data analysis, graphing and statistics software |
| JMP (version 17) | JMP Statistical Discovery LLC | JMP 17 | Statistical analysis software |
| Levington F2S seed & modular compost (with sand) | Levington | LEV75F2SMS | General-purpose compost for plant growth |
| Micromanipulator | Singer instrument Co. LTD. | Singer Micromanipulator | Micromanipulator to aid transfer of pollen grain |
| Nikon Digit sight DS-U1 | Nikon | DS-U1 | Microscope camera (coupletd to SMZ1500) |
| Nikon Eclipse TE2000-S Inverted Microscope | Nikon | TE2000-S | Inverted microscope |
| Nikon SMZ1500 Stereomicroscope | Nikon | SMZ1500 | Stereomicroscope |
| Nikon DS-Fi3 microscope camera | Nikon | DS-Fi3 | Microscope camera (coupletd to TE2000-S) |
| Nikon NIS-Elements Basic Research | Nikon | NIS-Elements BR | Image accquisition and analysis software (for DS-Fi3) |
| Nikon NIS-Elements F | Nikon | NIS-Elements F | Image accquisition and analysis software (for DS-U1) |
| WT Col-0 plant line | NASC | N700000 | Wildtype Arabidopsis thaliana, ecotype Columbia-0 |
References
- Rieseberg, L. H., Willis, J. H. Plant speciation. Science. 317 (5840), 910-914 (2007).
- Hiscock, S. J., Allen, A. M. Diverse cell signalling pathways regulate pollen-stigma interactions: the search for consensus. New Phytologist. 179 (2), 286-317 (2008).
- Kandasamy, M. K., Nasrallah, J. B., Nasrallah, M. E. Pollen pistil interactions and developmental regulation of pollen-tube growth in Arabidopsis. Development. 120 (12), 3405-3418 (1994).
- Bosch, M., Wang, L. Pollen-stigma interactions in Brassicaceae: complex communication events regulating pollen hydration. Journal of Experimental Botany. 71 (9), 2465-2468 (2020).
- Rozier, F., et al. Live-cell imaging of early events following pollen perception in self-incompatible Arabidopsis thaliana. Journal of Experimental Botany. 71 (9), 2513-2526 (2020).
- Dickinson, H. Dry stigmas, water and self-incompatibility in Brassica. Sexual Plant Reproduction. 8, 1-10 (1995).
- Takasaki, T., et al. The S receptor kinase determines self-incompatibility in Brassica stigma. Nature. 403 (6772), 913-916 (2000).
- Schopfer, C. R., Nasrallah, M. E., Nasrallah, J. B. The male determinant of self-incompatibility in Brassica. Science. 286 (5445), 1697-1700 (1999).
- Takayama, S., et al. Direct ligand-receptor complex interaction controls Brassica self-incompatibility. Nature. 413 (6855), 534-538 (2001).
- Shiba, H., et al. A pollen coat protein, SP11/SCR, determines the pollen S-specificity in the self-incompatibility of Brassica species. Plant Physiology. 125 (4), 2095-2103 (2001).
- Broz, A. K., Bedinger, P. A. Pollen-pistil interactions as reproductive barriers. Annual Review of Plant Biology. 72 (1), 615-639 (2021).
- Cheung, A. Y., Duan, Q., Li, C., James Liu, M. -. C., Wu, H. -. M. Pollen-pistil interactions: It takes two to tangle but a molecular cast of many to deliver. Current Opinion in Plant Biology. 69, 102279 (2022).
- Wang, L. D., et al. PCP-B class pollen coat proteins are key regulators of the hydration checkpoint in Arabidopsis thaliana pollen-stigma interactions. New Phytologist. 213 (2), 764-777 (2017).
- Liu, C., et al. Pollen PCP-B peptides unlock a stigma peptide-receptor kinase gating mechanism for pollination. Science. 372 (6538), 171-175 (2021).
- Bordeleau, S. J., Sanchez, L. E. C., Goring, D. R. Finding new Arabidopsis receptor kinases that regulate compatible pollen-pistil interactions. Frontiers in Plant Science. 13, 1022684 (2022).
- Suwabe, K., et al. Double-locking mechanism of self-compatibility in Arabidopsis thaliana: the synergistic effect of transcriptional depression and disruption of coding region in the male specificity gene. Frontiers in Plant Science. 11, 576140 (2020).
- Smyth, D. R., Bowman, J. L., Meyerowitz, E. M. Early flower development in Arabidopsis. Plant Cell. 2 (8), 755-767 (1990).
- Lee, H. K., Macgregor, S., Goring, D. R. A toolkit for teasing apart the early stages of pollen-stigma interactions in Arabidopsis thaliana. Pollen and Pollen Tube Biology. 2160, 13-28 (2020).
- Dilkes, B. P., et al. The maternally expressed WRKY transcription factor TTG2 controls lethality in interploidy crosses of Arabidopsis. PLoS Biology. 6 (12), 2707-2720 (2008).
- Riglet, L., et al. KATANIN-dependent mechanical properties of the stigmatic cell wall mediate the pollen tube path in Arabidopsis. eLife. 9, e57282 (2020).
- Zhou, L. Z., Dresselhaus, T. Friend or foe: Signaling mechanisms during double fertilization in flowering seed plants. Plant Development and Evolution. 131, 453-496 (2019).
- Gao, X. -. Q., et al. The Arabidopsis KINβγ subunit of the SnRK1 complex regulates pollen hydration on the stigma by mediating the level of reactive oxygen species in pollen. PLoS Genetics. 12 (7), e1006228 (2016).
- Lee, H. K., Goring, D. R. Two subgroups of receptor-like kinases promote early compatible pollen responses in the Arabidopsis thaliana pistil. Journal of Experimental Botany. 72 (4), 1198-1211 (2021).
- O’Malley, R. C., Barragan, C. C., Ecker, J. R. A user’s guide to the Arabidopsis T-DNA insertion mutant collections. Pollen and Pollen Tube Biology. 1284, 323-342 (2015).
- Samson, F., et al. FLAGdb++: a database for the functional analysis of the Arabidopsis genome. Nucleic Acids Research. 32, D347-D350 (2004).
- Doucet, J., et al. Investigations into a putative role for the novel BRASSIKIN pseudokinases in compatible pollen-stigma interactions in Arabidopsis thaliana. BMC Plant Biology. 19 (1), 549 (2019).

