اختبار حيوي عالي الدقة ، أحادي الحبة ، في الجسم الحي لترطيب حبوب اللقاح لأرابيدوبسيس ثاليانا
Summary
يتم وصف طريقة محسنة لقياس ملامح ترطيب حبوب اللقاح في Arabidopsis thaliana هنا. توفر الطريقة الجديدة دقة أعلى ، وهي غير جراحية ، وقابلة للتكرار بدرجة كبيرة. يمثل البروتوكول أداة جديدة لتشريح أدق للعمليات التي تنظم المراحل المبكرة من التلقيح.
Abstract
يتطلب التكاثر الجنسي في النباتات المزهرة تفاعلا أوليا بين حبوب اللقاح وسطح الوصمة ، حيث يتم إنشاء حوار جزيئي بين الشركاء المتفاعلين. كشفت الدراسات عبر مجموعة من الأنواع أن سلسلة من نقاط التفتيش الجزيئية تنظم تفاعل حبوب اللقاح والوصمة لضمان نجاح حبوب اللقاح المتوافقة بشكل عام في إحداث الإخصاب. في الأنواع التي تمتلك “وصمة عار جافة” ، مثل النبات النموذجي Arabidopsis thaliana ، فإن أول نقطة تفتيش للتوافق قبل الزيجوت بعد التلقيح هي إنشاء ترطيب حبوب اللقاح.
يتم تنظيم هذه المرحلة من التلقيح بإحكام ، حيث تثير الإشارات من حبوب اللقاح إطلاق الماء من وصمة العار ، مما يسمح بترطيب حبوب اللقاح. تعد القدرة على قياس وتتبع ترطيب حبوب اللقاح بدقة بمرور الوقت أمرا أساسيا لتصميم التجارب الموجهة لفهم تنظيم هذه الخطوة الحاسمة في التكاثر. تستخدم البروتوكولات المنشورة في كثير من الأحيان الزهور التي تم استئصالها من النبات الأم ، والحفاظ عليها على وسائط سائلة أو صلبة ، وتلقيح بكميات كبيرة.
تصف هذه الورقة مقايسة حيوية غير جراحية للتلقيح في الجسم الحي تسمح بتتبع الترطيب دقيقة بدقيقة لحبوب لقاح A. thaliana الفردية بدقة عالية. الفحص قابل للتكرار بدرجة كبيرة ، وقادر على اكتشاف الاختلافات الدقيقة جدا في ملامح ترطيب حبوب اللقاح ، وبالتالي فهو مناسب لتحليل الطفرات التي تؤثر على المسارات التي تنظم التلقيح. على الرغم من أن البروتوكول أطول من تلك الموصوفة للتلقيح السائب ، إلا أن الدقة والتكرار الذي يوفره ، إلى جانب طبيعته في الجسم الحي ، يجعله مثاليا للتشريح التفصيلي للأنماط الظاهرية للتلقيح.
Introduction
يعتمد التكاثر الجنسي الناجح في كاسيات البذور عادة على نقل حبوب اللقاح غير المحددة من العضو الآخر إلى وصمة العار ، إما داخل الأفراد أو بينهم (أي التلقيح). عادة ما يتم نقل حبوب اللقاح إلى زهرة متقبلة بوساطة الملقحات أو العوامل اللاأحيائية. على هذا النحو ، يؤدي هذا أيضا في كثير من الأحيان إلى ترسب حبوب اللقاح غير المتجانسة في ظل الظروف الطبيعية. مع استثناءات قليلة ، فإن تطور التلقيح بواسطة حبوب اللقاح غير المتجانسة غير مؤات من الناحية التطورية ، مما يقلل من اللياقة الإنجابية من خلال فرص التزاوج المفقودة ، مع فشل معظم النسل الهجين الناتج في التطور بشكل مناسب أو كونه عقيما1. وهكذا ، تطورت الآليات لمنع التلقيح بواسطة حبوب اللقاح غير المتجانسة “غير المتوافقة”2. لذلك يمكن القول إن التعرف السريع على حبوب اللقاح المتوافقة هو أهم عملية في المراحل المبكرة من التكاثر الجنسي في العديد من النباتات المزهرة.
في عائلة Brassicaceae ، حيث تكون الوصمات من النوع “الجاف” ، تعمل سلسلة من نقاط التفتيش الجزيئية في مراحل متعددة في عملية التكاثر التي تنظم التلقيح ، بحيث تنجح حبوب اللقاح المتوافقة فقط. تعد إماهة حبوب اللقاح واحدة من أهم نقاط التفتيش (الشكل 1)؛ لأن حبوب اللقاح التي تفشل في الترطيب لا يمكنها التقدم لإنتاج أنبوب حبوب اللقاح ومن ثم توصيل الحيوانات المنوية إلى النبات المشيجي الأنثوي. في كثير من الأحيان ، تفشل الحبوب غير المتوافقة في اجتياز نقطة تفتيش التلقيح الأولى هذه ، وبالتالي لا تحصل على مياه وصمة العار3. بين أفراد عائلة Brassicaceae ، يحدث التعرف على حبوب اللقاح بسرعة ، مع التوافق الذي يتم إنشاؤه في غضون دقائق من ارتباط حبوب اللقاح بالمدقة 4,5. في السنوات الأخيرة ، تم إحراز تقدم كبير ، وبدأنا الآن في فهم الآليات الجزيئية التي تنظم نقاط تفتيش التلقيح الرئيسية.
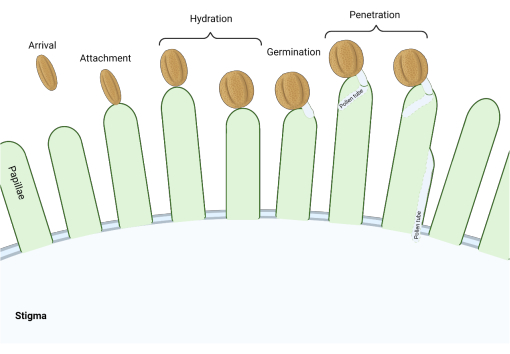
الشكل 1: نظرة عامة على الأحداث الرئيسية أثناء التلقيح المتوافق. هذه المراحل ، مثل ترطيب حبوب اللقاح وإنبات أنبوب حبوب اللقاح ، هي أيضا “نقاط تفتيش” للتلقيح يجب التنقل فيها بنجاح لإحداث تلقيح متوافق. يمثل الرسم البياني وصمة عار من النوع “الجاف” ، وهي نموذجية للأنواع من عائلة Brassicaceae 2,20. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
أنشأت الأبحاث الرائدة حول نظام عدم التوافق الذاتي في براسيكا (SI) ، حيث يتم التعرف على حبوب اللقاح “الذاتية” ورفضها ، نموذجا للتعرف على وصمة العار في Brassicaceae6،7،8،9،10. يتم التوسط في SI في براسيكا وأقاربها بواسطة بروتينات “التعرف” الموجودة على سطح حبوب اللقاح وفي غشاء البلازما الموصوم الذي يؤدي ، عند التفاعل ، إلى رفض حبوب اللقاح. يعمل رفض حبوب اللقاح SI عن طريق تعطيل نظام التوافق مع وصمة اللقاح القاعدية والذي ، عند تنشيطه بالكامل من خلال تصور حبوب اللقاح المتوافقة ، يؤدي إلى إفراز مستهدف بواسطة وصمة العار ، وبالتالي يؤدي إلى ترطيب حبوب اللقاح (لمراجعات آلية توافق حبوب اللقاح ، انظر11،12). في مثال SI ، فإن الرباط الذي يحمله حبوب اللقاح هو بروتين صغير غني بالسيستين ، S-locus cysteine غني (SCR / SP11) ، والمستقبل الموصوم هو مستقبل S-locus kinase (SRK).
في الآونة الأخيرة ، في Arabidopsis thaliana ، تم العثور على مجموعة أخرى من البروتينات الصغيرة الغنية بحبوب اللقاح الغنية بالسيستين ، فئة بروتين معطف حبوب اللقاح Bs (فيPCP-Bs) ، لتكون منظمات مهمة لقبول حبوب اللقاح من خلال تنشيط ترطيب حبوب اللقاح13. كما تم وصف مستقبلات وصمة العار فيPCP-Bs وجوانب المسار التنظيمي النهائي مؤخرا14,15. ومن المثير للاهتمام ، أن الدراسات الطفرية للجينات التي تشفر وسطاء الإشارات المحتملة التي تنقلها حبوب اللقاح والوصمة لترطيب حبوب اللقاح (بما في ذلك فيPCP-Bs) قد فشلت في توليد نباتات لها كتلة كاملة لنقطة تفتيش ترطيب حبوب اللقاح. يشير هذا بقوة إلى أن العديد من العوامل الأخرى ، التي لم يتم اكتشافها بعد ، تلعب دورا في تنظيم ترطيب حبوب اللقاح. بناء على الطريقة التي وصفها Wang et al.13 لأول مرة ، نصف هنا مقايسة حيوية محسنة عالية الدقة في الجسم الحي مناسبة لتحديد عيوب ترطيب حبوب اللقاح الدقيقة في خطوط A. thaliana الطافرة المرشحة.
Protocol
Representative Results
Discussion
بالنسبة للنباتات المزهرة ، يمكن القول إن المراحل المبكرة جدا من التكاثر الجنسي هي الأكثر أهمية. على مستوى تفاعل حبوب اللقاح والوصمة ، يتم اتخاذ القرارات الجزيئية التي تحدد “توافق” الشركاء المتفاعلين. مثل هذه القرارات ، إذا تم اتخاذها بشكل صحيح ، تتجنب إهدار الموارد التي يمكن أن تؤثر على اللياقة الإنجابية21. وبالتالي ، فإن السماح لحبوب اللقاح المتوافقة فقط بإحداث الإخصاب هو أحد المكونات المهمة للحفاظ على الأنماط الجينية المتكيفة جيدا ، وبالتالي النجاح التطوري للأنواع. كانت الأبحاث التي أجريت مع المصنع النموذجي A. thaliana قيمة للغاية في تعميق فهمنا لهذه العملية. كشف عدد من الدراسات على مدى العقود القليلة الماضية عن وجود عوامل في غلاف حبوب اللقاح تعمل عند “نقطة تفتيش” التوافق الأولى ، حيث تحصل حبوب اللقاح على مياه وصمة العار للسماح بترطيب حبوب اللقاح13. على الرغم من هذه الأفكار الأولية حول الآليات التي تنظم التوافق بين حبوب اللقاح ووصمة العار ، لا تزال هناك العديد من الثغرات في فهمنا لهذه العملية. حتى الآن ، لا يمكن لأي طفرات من الروابط التي تنقلها حبوب اللقاح أو المستقبلات الموصومة المعروفة بتأثيرها على ترطيب حبوب اللقاح أن تمنع تماما التلقيح المتوافق ، مما يشير إلى وجود محددات أخرى غير مكتشفة لترطيب حبوب اللقاح. من خلال القدرة على مراقبة النمط الظاهري محل الاهتمام بسهولة ، فإن المقايسة الحيوية لترطيب حبوب اللقاح الموصوفة هنا هي واحدة من أكثر التقنيات المباشرة لدراسة الطفرات المحتملة التي تنظم التلقيح.
عادة ما تستخدم المنهجيات الحالية لقياس ترطيب حبوب اللقاح التلقيح السائب وتبلغ عن نقاط زمنية أقل14،22،23 ، وبالتالي قد تفوت الأنماط الظاهرية الدقيقة المهمة لملف تعريف الترطيب. على سبيل المثال ، كشفت الدراسة التي أجراها Wang et al.13 ، جنبا إلى جنب مع العمل على طفرات بروتين معطف حبوب اللقاح الأخرى في مختبرنا (ملاحظات غير منشورة) ، عن اختلافات مثيرة للاهتمام في ملامح الترطيب بين الطفرات. قد تحمل هذه الاختلافات الدقيقة أدلة مهمة على الآليات التنظيمية الكامنة وراء التلقيح المتوافق.
تركز الطريقة الموصوفة هنا على الحصول على أعداد صغيرة نسبيا من القياس بين خطوط النباتات الطافرة و WT ، مع التركيز على الدقة المنهجية لتقليل التباين داخل مجموعات البيانات. في حين أن هذه الطريقة قابلة للتكرار بدرجة كبيرة (كما هو موضح في الشكل 7) ، بافتراض أن درجة الحرارة والرطوبة يتم التحكم فيها بشكل كاف ، فمن المهم جمع بيانات الترطيب لأعداد متساوية تقريبا من WT وحبوب اللقاح الطافرة في نفس اليوم لتقليل احتمالية التباين. يمكن بعد ذلك تجميع البيانات عبر أيام مختلفة إذا لزم الأمر. بالإضافة إلى ذلك ، يعد اختيار محطات التحكم في WT المناسبة أمرا حيويا للتفسير الصحيح لنتائج الترطيب. بالنسبة لمتلقي حبوب اللقاح ، يجب استخدام نفس خط النبات لتلقي كل من التحكم في WT وحبوب اللقاح الطافرة.
على سبيل المثال ، نستخدم خط النبات المعقم الذكري pA9-barnase ، والذي يظهر أيضا في بروتوكول الفيديو ، كمتلقي حبوب اللقاح لكل من حبوب اللقاح WT (التحكم) وحبوب اللقاح الطافرة (التجريبية) عند التحقيق في خطوط طفرة حبوب اللقاح T-DNA (مثل الطافر “KD” الموصوف في الشكل 8). يجب تجنب خلط البيانات من مثل هذا الخط العقيم للذكور ، والذي لا يحتاج إلى إخصاء ، مع تلك التي تم جمعها من خط التحكم الذي تم إخصاؤه يدويا لأن هذه الوصمات من المحتمل أن تتصرف بشكل مختلف. وبالمثل ، يجب استخدام خطوط متحولة ضعيفة جنبا إلى جنب مع خط WT (تحكم) ضعيف كلما أمكن ذلك. يجب أيضا تطبيق نفس الحذر عند النظر في الخلفية الوراثية للنباتات قيد الدراسة. في حين تم إنشاء مجموعات T-DNA الطافرة الأكثر شيوعا في خلفية Col-0 ، فإن مجموعات أخرى ، مثل مجموعة FLAG من المعهد الوطني للبحوث الزراعية (INRA) ، متوفرة في الخلفية الجينية Wassilewskija (WS)24,25. في مثل هذه الحالات ، ينصح باستخدام خطوط نبات WT الخاصة بالنمط البيئي المعني كعناصر تحكم.
على الرغم من أننا ركزنا هنا على ترطيب حبوب اللقاح خلال أول 10 دقائق من تفاعل حبوب اللقاح ووصمة العار ، إلا أنه يمكن أيضا تكييف هذه الطريقة لتشمل ملفات تعريف الترطيب التي تغطي فترة زمنية أطول. من السمات الرئيسية للبروتوكول أن الزهور تظل مرتبطة بالبروتوكولات المنشورة لتيار النبات الأم تتطلب عادة استئصال المدقة ووضعها في الوسائط للحفاظ على الأنسجة طوال مدة التجربة14،18،26. على الرغم من عدم وجود دليل مباشر يشير إلى أن مثل هذا النهج شبه الحي يؤثر على ترطيب حبوب اللقاح أو يغير بالفعل التنظيم في الجسم الحي لهذه العملية ، فمن المتصور أن استئصال الزهور من النبات الأم يمكن أن يؤثر على التلقيح. وبالتالي ، يحقق هذا البروتوكول بيئة حقيقية في الجسم الحي لدراسة تفاعل حبوب اللقاح والوصمة ، حيث يتم الحفاظ على السلامة الهيكلية للنبات.
يمكن القول إن نقل حبوب اللقاح المفردة إلى الحليمات “البكر” هي واحدة من أكثر العمليات تحديا الموصوفة في هذا البروتوكول. ليس من غير المألوف نقل مجموعات من حبوب اللقاح عن طريق الخطأ. ومع ذلك ، يمكن تقليل فرصة حدوث ذلك بشكل كبير من خلال ضمان وجود طبقة أحادية فقط من حبوب اللقاح على الملقط (الشكل 3 أ) (أو حتى حبة لقاح واحدة فقط ؛ الشكل 5) ، و / أو باستخدام حبوب اللقاح الموجهة بالفعل ، بحيث “تبرز” من الآخرين على طرف الملقط. لقد وجدنا أن المشغل المتمرس يمكنه إكمال نقل حبوب اللقاح الواحدة بنجاح إلى خلية حليمة موصومة في حوالي 3 دقائق وتسجيل البيانات لما يصل إلى خمس حبوب لقاح خلال فترة 1 ساعة. وبالتالي ، على مدى فترة 2-4 أيام ، يمكن تجميع بيانات كافية لإجراء تحليل إحصائي ذي مغزى لخطوط النبات قيد الدراسة.
من المحتمل أن يكون الخطأ البشري أكبر مصدر للتباين في تحليل مجموعات البيانات المستمدة من الدراسات التي تستخدم هذا البروتوكول. على سبيل المثال ، يعود تعريف “حدود حبوب اللقاح” أثناء تحليل الصور إلى حكم الباحث الفردي. وبالتالي ، هناك احتمال أن القياسات التي أجراها باحثون مختلفون ، حتى على نفس مجموعة البيانات ، قد تولد تباينا. حيثما أمكن ، يجب على باحث واحد إجراء القياسات لتقليل أخطاء أخذ العينات. بالإضافة إلى ذلك ، فإن اقتران تحليل WT ومجموعات البيانات الطافرة من قبل نفس المشغل ينفي التعريف الذاتي المحتمل ل “حدود حبوب اللقاح” والاختلاف بين المشغلين.
في الختام ، تم وصف طريقة متطورة ودقيقة لقياس ملامح ترطيب حبوب اللقاح في الكائن الحي النموذجي A. thaliana. لقد أثبتنا أنه من خلال استخدام هذا البروتوكول ، يمكن الحصول بسهولة على بيانات ترطيب حبوب اللقاح المتسقة للغاية ل A. thaliana. أظهرت ثلاث دفعات مستقلة من البيانات الخاصة بتلقيح WT التي تم الحصول عليها في أيام مختلفة انحرافات صغيرة ثابتة بنسبة <3٪ عبر جميع النقاط الزمنية (الشكل 7 والجدول التكميلي S1). على الرغم من أن المقايسة الحيوية المقدمة هنا أكثر تعقيدا قليلا من معظم البروتوكولات الحالية ، إلا أن دقة البيانات المتولدة متفوقة ومناسبة لتحديد وتوصيف الطفرات الجديدة التي تؤثر على المسارات التي تنظم التلقيح المتوافق.
Disclosures
The authors have nothing to disclose.
Acknowledgements
تم دعم هذا البحث من قبل جامعة باث (جامعة باث ، باث ، المملكة المتحدة ، BA2 7AY) منح الدراسات العليا إلى Y.-L.L. و L.W. تم إنشاء الشكل 1 باستخدام BioRender.com (https://biorender.com/).
Materials
| A9-barnase line | University of Bath | Courtsey of Prof. Rod Scott | Male sterile Arabidopsis thaliana wildtype equivalent line of the ecotype Columbia-0 |
| Dumont Tweezer, Dumont #5 Inox 11cm | Fisher | Dumont 500342 | Tweezer uses for transfer of pollen grain |
| GraphPad Prsim (version 8.0.2) | Dotmatics | Prism | Comprehensive data analysis, graphing and statistics software |
| JMP (version 17) | JMP Statistical Discovery LLC | JMP 17 | Statistical analysis software |
| Levington F2S seed & modular compost (with sand) | Levington | LEV75F2SMS | General-purpose compost for plant growth |
| Micromanipulator | Singer instrument Co. LTD. | Singer Micromanipulator | Micromanipulator to aid transfer of pollen grain |
| Nikon Digit sight DS-U1 | Nikon | DS-U1 | Microscope camera (coupletd to SMZ1500) |
| Nikon Eclipse TE2000-S Inverted Microscope | Nikon | TE2000-S | Inverted microscope |
| Nikon SMZ1500 Stereomicroscope | Nikon | SMZ1500 | Stereomicroscope |
| Nikon DS-Fi3 microscope camera | Nikon | DS-Fi3 | Microscope camera (coupletd to TE2000-S) |
| Nikon NIS-Elements Basic Research | Nikon | NIS-Elements BR | Image accquisition and analysis software (for DS-Fi3) |
| Nikon NIS-Elements F | Nikon | NIS-Elements F | Image accquisition and analysis software (for DS-U1) |
| WT Col-0 plant line | NASC | N700000 | Wildtype Arabidopsis thaliana, ecotype Columbia-0 |
References
- Rieseberg, L. H., Willis, J. H. Plant speciation. Science. 317 (5840), 910-914 (2007).
- Hiscock, S. J., Allen, A. M. Diverse cell signalling pathways regulate pollen-stigma interactions: the search for consensus. New Phytologist. 179 (2), 286-317 (2008).
- Kandasamy, M. K., Nasrallah, J. B., Nasrallah, M. E. Pollen pistil interactions and developmental regulation of pollen-tube growth in Arabidopsis. Development. 120 (12), 3405-3418 (1994).
- Bosch, M., Wang, L. Pollen-stigma interactions in Brassicaceae: complex communication events regulating pollen hydration. Journal of Experimental Botany. 71 (9), 2465-2468 (2020).
- Rozier, F., et al. Live-cell imaging of early events following pollen perception in self-incompatible Arabidopsis thaliana. Journal of Experimental Botany. 71 (9), 2513-2526 (2020).
- Dickinson, H. Dry stigmas, water and self-incompatibility in Brassica. Sexual Plant Reproduction. 8, 1-10 (1995).
- Takasaki, T., et al. The S receptor kinase determines self-incompatibility in Brassica stigma. Nature. 403 (6772), 913-916 (2000).
- Schopfer, C. R., Nasrallah, M. E., Nasrallah, J. B. The male determinant of self-incompatibility in Brassica. Science. 286 (5445), 1697-1700 (1999).
- Takayama, S., et al. Direct ligand-receptor complex interaction controls Brassica self-incompatibility. Nature. 413 (6855), 534-538 (2001).
- Shiba, H., et al. A pollen coat protein, SP11/SCR, determines the pollen S-specificity in the self-incompatibility of Brassica species. Plant Physiology. 125 (4), 2095-2103 (2001).
- Broz, A. K., Bedinger, P. A. Pollen-pistil interactions as reproductive barriers. Annual Review of Plant Biology. 72 (1), 615-639 (2021).
- Cheung, A. Y., Duan, Q., Li, C., James Liu, M. -. C., Wu, H. -. M. Pollen-pistil interactions: It takes two to tangle but a molecular cast of many to deliver. Current Opinion in Plant Biology. 69, 102279 (2022).
- Wang, L. D., et al. PCP-B class pollen coat proteins are key regulators of the hydration checkpoint in Arabidopsis thaliana pollen-stigma interactions. New Phytologist. 213 (2), 764-777 (2017).
- Liu, C., et al. Pollen PCP-B peptides unlock a stigma peptide-receptor kinase gating mechanism for pollination. Science. 372 (6538), 171-175 (2021).
- Bordeleau, S. J., Sanchez, L. E. C., Goring, D. R. Finding new Arabidopsis receptor kinases that regulate compatible pollen-pistil interactions. Frontiers in Plant Science. 13, 1022684 (2022).
- Suwabe, K., et al. Double-locking mechanism of self-compatibility in Arabidopsis thaliana: the synergistic effect of transcriptional depression and disruption of coding region in the male specificity gene. Frontiers in Plant Science. 11, 576140 (2020).
- Smyth, D. R., Bowman, J. L., Meyerowitz, E. M. Early flower development in Arabidopsis. Plant Cell. 2 (8), 755-767 (1990).
- Lee, H. K., Macgregor, S., Goring, D. R. A toolkit for teasing apart the early stages of pollen-stigma interactions in Arabidopsis thaliana. Pollen and Pollen Tube Biology. 2160, 13-28 (2020).
- Dilkes, B. P., et al. The maternally expressed WRKY transcription factor TTG2 controls lethality in interploidy crosses of Arabidopsis. PLoS Biology. 6 (12), 2707-2720 (2008).
- Riglet, L., et al. KATANIN-dependent mechanical properties of the stigmatic cell wall mediate the pollen tube path in Arabidopsis. eLife. 9, e57282 (2020).
- Zhou, L. Z., Dresselhaus, T. Friend or foe: Signaling mechanisms during double fertilization in flowering seed plants. Plant Development and Evolution. 131, 453-496 (2019).
- Gao, X. -. Q., et al. The Arabidopsis KINβγ subunit of the SnRK1 complex regulates pollen hydration on the stigma by mediating the level of reactive oxygen species in pollen. PLoS Genetics. 12 (7), e1006228 (2016).
- Lee, H. K., Goring, D. R. Two subgroups of receptor-like kinases promote early compatible pollen responses in the Arabidopsis thaliana pistil. Journal of Experimental Botany. 72 (4), 1198-1211 (2021).
- O’Malley, R. C., Barragan, C. C., Ecker, J. R. A user’s guide to the Arabidopsis T-DNA insertion mutant collections. Pollen and Pollen Tube Biology. 1284, 323-342 (2015).
- Samson, F., et al. FLAGdb++: a database for the functional analysis of the Arabidopsis genome. Nucleic Acids Research. 32, D347-D350 (2004).
- Doucet, J., et al. Investigations into a putative role for the novel BRASSIKIN pseudokinases in compatible pollen-stigma interactions in Arabidopsis thaliana. BMC Plant Biology. 19 (1), 549 (2019).

