طبقة رقيقة الكروماتوجرافي (TLC) فصل واختبارات بيولوجية من المستخلصات النباتية لتحديد المركبات المضادة للميكروبات
Summary
يتم وصف طرق الكروماتوغرافي طبقة رقيقة (TLC) فصل المستخلصات النباتية وbioautography الاتصال لتحديد نواتج مضادة للجراثيم. يتم تطبيق أساليب لفحص المركبات الفينولية البرسيم الأحمر تثبيط فرط إنتاج الأمونيا البكتيريا (HAB) الأصلي إلى الكرش البقري.
Abstract
يتكون شاشة مشترك لمصنع المركبات المضادة للميكروبات فصل المستخلصات النباتية عن طريق الورق أو اللوني طبقة رقيقة (TLC أو PC)، وفضح المخططات الاستشرابية لتعليق الميكروبية (مثل الفطريات أو البكتيريا في مرق أو أجار)، مما يتيح الوقت للميكروبات أن تنمو في بيئة رطبة، وتصور المناطق مع عدم وجود نمو الميكروبات. فعالية هذا الأسلوب الفرز، والمعروفة باسم bioautography، ويعتمد على كل من نوعية الفصل الكروماتوغرافي والرعاية التي اتخذت مع الظروف الثقافة الميكروبية. وتصف هذه الورقة البروتوكولات القياسية لTLC والاتصال bioautography مع تطبيق رواية لالأمينية البكتيريا تخمر حامض. يتم فصل استخراج على مرونة (المدعومة من الألومنيوم) لوحات السيليكا TLC، وتصور العصابات تحت الأشعة فوق البنفسجية (UV) ضوء. يتم قطع مناطق من وحضنت وجهه لأسفل على أجار تلقيح مع اختبار الكائنات الحية الدقيقة. وتصور العصابات المثبطة التي كتبها تلطيخ لوحة آغارق مع نتروبلو الحمراء. يتم تطبيق طريقة لفصل البرسيم الأحمر (نفل pratense السيرة الذاتية. Kenland) المركبات الفينولية والفرز من أجل نشاط ضد كلوستريديوم sticklandii، على إنتاج الأمونيا بكتيريا فرط (HAB) التي هي أصلية في الكرش البقري. تطبيق أساليب TLC لأنواع عديدة من المستخلصات النباتية والأنواع البكتيرية الأخرى (الهوائية أو اللاهوائية)، فضلا عن الفطريات، ويمكن أن تستخدم الكائنات اختبار إذا تم تعديل الشروط الثقافة لتناسب متطلبات نمو الأنواع.
Introduction
يعاير عن المركبات المضادة للميكروبات في محطات يتطلب فصل مكونات مستخلصات نباتية، وفضح الكائنات الحية الدقيقة اختبار لتلك المكونات، وتحديد ما إذا كان يتم تثبيط نمو الكائنات الحية الدقيقة من قبل أي من المركبات. فصل من ورقة أو اللوني طبقة رقيقة (TLC أو PC) هي مريحة لأن العديد من المركبات يمكن فصل على سطح مستو. ويستند الفاصل على قطبية، مع بعض المركبات ملزمة بإحكام إلى مكثف (السليلوز في حالة الكمبيوتر، ومجموعة متنوعة من الممتزات في حالة TLC) والهجرة أقل من غيرها 1. الشكل 1 يوفر مثالا على الأوضاع النسبية لل المركبات الفينولية القطبية وغير القطبية بعد الانفصال على طبق من السيليكا TLC.
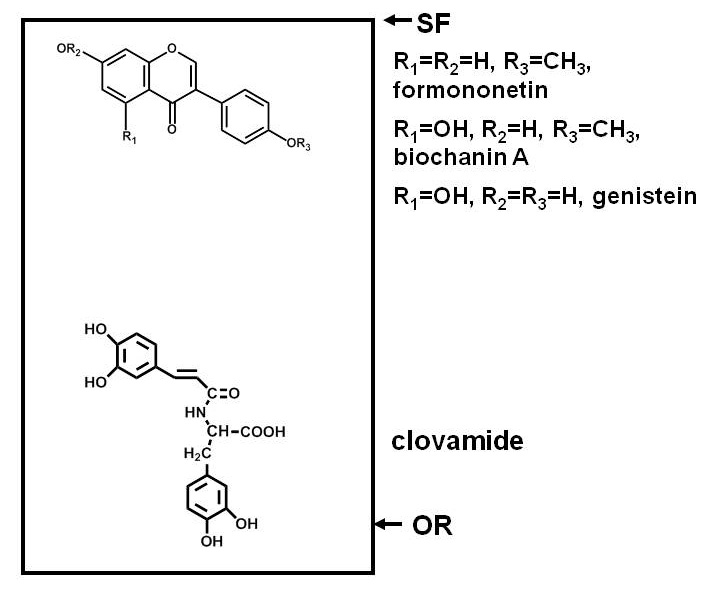
الشكل 1. وتستخدم بياني يوضح توزيع المركبات من أقطاب مختلفة بعد الانفصال على السيليكا طبقة رقيقة الكروماتوغرافي (TLC) لوحة. مركبات الفينول من البرسيم الأحمر (نفل pratense L.) كمثال. مركبات قطبية، مثل clovamide، لديها تقارب قوي لمكثف القطبية مثل السيليكا وتبقى بالقرب من المنشأ (OR)، في حين أن مركبات القطبية أقل، مثل الايسوفلافون ثلاثة قرب الجبهة المذيبات (SF)، والتقسيم بسهولة أكبر في المذيبات (التي هي أقل من السيليكا القطبية ما لم يتم تضمين الماء، والأحماض، أو القواعد) وتهاجر أبعد تصل اللوحة.
بعد فصل مقتطف على لوحة TLC، يمكن أن يتعرض الكائنات الدقيقة اختبار لجميع المركبات على لوحة، وبالتالي تسريع التعرف على مكونات نشطة من مقتطف 2. إذا تعرضت ثقافة الفطرية أو البكتيرية إلى اللوني، وسوف يحدث نمو الجراثيم في كل مكان ما عدا في مناطق مع النمو المانعمركبات ذ. مناطق تثبيط ثم يمكن تصور بملاحظة التناقض بين النمو أفطوري والمناطق الخالية من النمو إذا تم تطبيقها الفطريات 3 أو عن طريق الرش مع المركبات التي تغير لونها عندما خفضت أو تحلل من قبل الخلايا الحية 4. على الرغم من أن استخدام ورقة أو رقيقة طبقة المخططات الاستشرابية لفحوصات مضادة للميكروبات تم تطبيق أول من المضادات الحيوية ومبيدات الفطريات 5 3،6، والآن في كثير من الأحيان فحص المستخلصات النباتية للمركبات المضادة للميكروبات مع هذا الأسلوب، وغالبا ما يشار إليها باسم bioautography. البروتوكولات وصف ينطبق هنا لbioautography من المخططات الاستشرابية طبقة رقيقة. ويستخدم على نطاق واسع TLC لأنه سريع نسبيا ويمكن تنفيذها على الممتزات مختلفة (مثل السيليكا، والنشا، والألومينا)، فضلا عن تقديم قرار جيد وحساسية 1.
المستخلصات النباتية يمكن أن تكون على استعداد لTLC في نواح كثيرة. وتشمل الطرق الشائعة استخراج المواد النباتية في ALCمخاليط ohol المياه مثل الايثانول 80٪ 7،8، وربما مع إضافة حمض أو قاعدة 9. بعد استخراج في مثل المذيبات، والتي تحتوي على بعض الماء وربما هي الحمضية أو الأساسية، يجب أن تتركز مقتطفات بحيث يمكن تطبيقها على لوحات TLC في حجم الحد الأدنى. ويمكن تحقيق تركيز الكحول مقتطفات المياه عن طريق تقسيم مع إمتزاج الماء أو المذيبات العضوية 8 مع خليط من هذه المذيبات، مثل إيثيل الأثير، خلات الإيثيل (1:1، ت / ت) 10،11. يتم استخراج نواتج الأيض النباتية المختلفة في المذيبات العضوية المختلفة، اعتمادا على أقطاب بهم. لضمان أن يتم استخراج النباتية الأحماض العضوية أو القواعد الى المذيبات العضوية في هذه المرحلة، ودرجة الحموضة لاستخراج المياه الكحول يمكن رفع أو خفض مع حامض للذوبان في الماء أو قاعدة لتحويل التحاليل فصلها في أشكالها nondissociated، والتي هي ثم قابل للذوبان في المذيبات العضوية محايد 9. ويمكن بعد ذلك تكون المرحلة العضوية البريدvaporated تحت ضغط منخفض أو تحت النيتروجين وتعديلها لحجم المطلوب لTLC. الرقم الهيدروجيني للاستخراج من غير المرجح أن تكون قاتلة للميكروبات الأحيائي بسبب التقسيم من analytes في المذيبات محايدة، صغيرة الحجم النهائي، والتبخر للاستخراج على لوحة TLC قبل الانفصال.
ويعمل كل من الفطريات والبكتيريا مثل الكائنات الحية الدقيقة في اختبار bioautography من المستخلصات النباتية 2. أبواغ الفطريات بعض، مثل المبغثرة الطيرية، تنبت على لوحات TLC (وبصرف النظر عن المناطق مع المركبات المثبطة) إذا رش على لوحات في المحلول المغذي وحضنت في بيئة رطبة لعدة أيام 3. أفطورة المظلم من C. الطيرية على مناطق noninhibitory يوفر تناقض حاد مع المناطق الحرة من النمو أفطوري. على الرغم من أن البكتيريا تم تطبيقها على طبقة رقيقة اللوني (TLC) لوحات بنفس الطريقة 4،12، وسكب البكتيريا أيضا أكثر من TLCالسطوح وحة في أجار يعلو 13،14. الخميرة، مثل المبيضات البيض، ويمكن تطبيقها في تراكب أجار وكذلك 14. بدلا من ذلك، لوحات TLC يمكن وضعها مقلوبة على أجار تلقيح مع البكتيريا أو الخميرة 10،15 8، طريقة تعرف باسم الاتصال bioautography 2.
نحن تصف طريقة للاتصال bioautography للكشف عن المركبات الفينولية المضادة للميكروبات من البرسيم الأحمر (نفل pratense السيرة الذاتية. Kenland). الكائنات الحية الدقيقة الاختبار هو sticklandii كلوستريديوم، وهو فرط انتاج الأمونيا بكتيريا الكرش (HAB) واهوائي مجبر. على الرغم من أن فصل المستخدمة لا حل جميع مكونات استخراج، كانت تسهل تحديد مناطق نشاط مضادات الميكروبات، وبالتالي تضييق مجموعة من المركبات المضادة للميكروبات ممكن. بروتوكول يستخدم إجراءات موحدة لTLC 1. يصف البروتوكول أيضا بعض التقنيات اللازمة لزراعة obliاللاهوائيات بوابة لمثل هذا الفحص، واستخدام الاتصال bioautography 15 وطريقة التصور مع الملح نتروبلو، التي بقع الخلايا الحية 2،4.
Protocol
Representative Results
Discussion
يصف هذا البروتوكول طريقة بسيطة لفصل مقتطف إلى مجموعات فرعية من المركبات ومعايرة تلك المجموعات الفرعية عن طريق الاتصال bioautography. طريقة مماثلة تماما لتلك المستخدمة من قبل 15 Chomnawang آخرون للكشف عن نواتج النبات المثبطة للبكتيريا المسببة للمرض السيلان. نوع bioautogra…
Disclosures
The authors have nothing to disclose.
Acknowledgements
نشكر المرحوم الدكتور نورم تايلور، النبات وقسم علوم التربة في جامعة كنتاكي، على إتاحة الفرصة لنا لاستخدام عينات من له المؤامرات البرسيم الأحمر لهذه الدراسة. وقد تم تمويل هذا المشروع من قبل وزارة الزراعة في الولايات المتحدة.
Materials
| Silica F254 TLC plates, aluminum-backed, 0.2 mm thickness, 20 × 20 cm | EMD Chemicals | 5554/7 | These plates are coated with silica that contains an indicator fluorescing at 254 nm. Compounds absorbing at that wavelength appear dark on a fluorescent green background. Alternative sources include Analtech, Selecto Scientific, Fluka. Adsorbents other than silica may be needed. Plastic-backed plates may be suitable, depending on the solvents to be used. |
| Sharp, heavy-duty scissors | any sewing supply company | similar to Fiskars 175800-1002 | For cutting TLC plates. A paper cutter with a sharp blade can be used as well. Do not inhale silica dust. |
| Drying oven at 100 °C (mechanical convection) | Thermo Scientific | PR305225M | Quincy Lab, Inc, Chicago, IL (www.quincylab.com); Cascade Technical Sciences, Hillsboro, OR (www.cascadetek.com) |
| TLC chamber | Kimble Chase | 416180-0000 | Alternative sources: Aldrich. Pyrex beakers or preserving jars can be used for small plates (i.e. 5 × 10 cm). Cover with aluminum foil (jar lids may contain material extractable by solvent vapors). |
| 50-µL syringe with flat needle tip | Hamilton | 80965 | For loading amounts of standard or sample exceeding 5-10 µL. Alternative sources are equivalent. |
| micropipets | Drummond | 2-000-001 | For loading small amounts of standards or samples. Alternative sources: VWR. Also, Pasteur pipets can be stretched to a thinner diameter with a butane torch. |
| Filter paper (#1 grade) | Whatman | 1001 917 | Serves as a chamber wick. Other grades of filter paper are OK. This size can be trimmed for the chambers holding 20 × 20 cm plates. |
| Beaker tongs | Fisher Scientific | 15-186 | For putting plates in and out of a large TLC chamber. Alternate sources: VWR |
| Flat-edge forceps | Fisher Scientific | 10-275 | For putting plates in and out of a small chamber. Alternate sources: VWR |
| Small portable UV lamp with 4-Watt or 6-Watt bulbs for short- and long-wave UV light illumination (254 and 365 nm, respectively) | Ultraviolet Products | 95-0271-01 | Alternate sources: Spectronics Corporation (www.spectroline.net) |
| Viewing cabinet for use with hand-held UV lamp | Ultraviolet Products | Chromato-Vue C-10E | UV-active bands are more easily circled if plates can be set in here. Alternate sources: Spectronics Corporation. |
| Photodocumentation system with overhead UV lamp and visible lamp | Kodak | Gel Logic 200 | Alternate sources: Ultraviolet Products (www.uvp.com). See protocol for homemade alternative. |
| Anaerobic Chamber, Type A, Vinyl | Coy | 7150000 | This chamber is appropriate for anaerobic bacteria, like Clostridium sticklandii, as described. However, growth conditions must be tailored to organism used in the assay. A biosafety cabinet and other precautions should be taken if pathogenic organisms are used. Alternate sources: Anaerobe Systems, BioRad, Plas Labs, others |
| Tetrazolium red | Sigma-Aldrich | T8877 | Alternate sources: MP Biomedicals, Santa Cruz Biotechnology, Alfa Aesar |
| Ingredients for HAB media | |||
| Pyridoxamine · 2 HCl | Sigma-Aldrich | P9380 | For this and for all the other reagents in this table, alternative sources are equivalent. |
| Riboflavin | Sigma-Aldrich | R4500 | |
| Thiamine HCl | Sigma-Aldrich | T3902 | |
| Nicotinamide | Sigma-Aldrich | N3376 | |
| Calcium D-Pantothenate | Sigma-Aldrich | C8731 | |
| Lipoic Acid | Sigma-Aldrich | T5625 | |
| p-Aminobenzoic acid | Sigma-Aldrich | A9878 | |
| Folic acid | Sigma-Aldrich | F8798 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Cobalamine | Sigma-Aldrich | C3607 | |
| Pyridoxal HCl | Sigma-Aldrich | P9130 | |
| Pyridoxine | Sigma-Aldrich | P5669 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Iron sulfate · 7 H2O | Sigma-Aldrich | F8263 | |
| Zinc sulfate · 7 H2O | Sigma-Aldrich | Z0251 | |
| Manganese chloride · 4 H2O | Sigma-Aldrich | M8054 | |
| Boric acid | Sigma-Aldrich | B6768 | |
| Cobalt chloride · 6 H2O | Sigma-Aldrich | C8661 | |
| Copper chloride · 2 H2O | Sigma-Aldrich | 459097 | |
| Nickel chloride · 6 H2O | Sigma-Aldrich | 203866 | |
| Sodium molybdate · 2 H2O | Sigma-Aldrich | 331058 | |
| Trypticase (Pancreatic digest of casein) | Thermo Fisher | B11921 | |
| Potassium phosphate monobasic anhydrous | Thermo Fisher | P284 | |
| sodium carbonate · H2O | Thermo Fisher | S636 | |
| Agar | Thermo Fisher | 50841063 | |
| Magnesium sulfate · 6 H2O | Thermo Fisher | 7791-18-6 | |
| Calcium chloride · 2 H2O | Thermo Fisher | BP510 | |
| Cysteine HCl | Thermo Fisher | 19464780 | |
| Potassium phosphate dibasic anhydrous | Thermo Fisher | P290 | |
| Sodium chloride | Thermo Fisher | BP358 |
References
- Stahl, E., Ashworth, M. R. F. . Thin-layer chromatography. , (1969).
- Marston, A. Thin-layer chromatography with biological detection in phytochemistry. J. Chromatogr. A. 1218 (19), 2676-2683 .
- Homans, A. L., Fuchs, A. Direct bioautography on thin-layer chromatograms as a method for detecting fungitoxic substances. J. Chromatogr. 51, 327-329 .
- Lund, B. M., Lyon, G. D. Detection of inhibitors of Erwinia carotovora and E. herbicola on thin-layer chromatograms. J. Chromatogr. 110, 193-196 (1975).
- Betina, V. Bioautography in paper and thin-layer chromatography and its scope in the antibiotic field. J. Chromatogr. A. 78, 41-51 (1973).
- Weltzien, H. C. Ein biologischer Test für fungizide Substanzen auf dem Papierchromatogramm. Naturwissenschaften. 45, 288-289 (1958).
- Khurram, M., Khan, A. M., Hameed, A., Abbas, N., Quayum, A., Inayat, H. Antibacterial activities of Dodonaea viscosa using contact bioautography technique. Molecules. 14 (3), 1332-1341 (2009).
- Khurram, M., et al. Evaluation of anticandidal potential of Quercus baloot Griff. using contact bioautography technique. Afr. J. Pharm. Pharmacol. 5 (12), 1538-1542 (2012).
- Robinson, T. . The Organic Constituents of Higher Plants. , (1963).
- Kagan, I. A., Flythe, M. D. Factors affecting the separation and bioactivity of red clover (Trifolium pratense) extracts assayed against Clostridium sticklandii, a ruminal hyper ammonia-producing bacterium. Nat. Prod. Commun. 7 (12), 1605-1608 (2012).
- Mattila, P., Kumpulainen, J. Determination of free and total phenolic acids in plant-derived foods by HPLC with diode-array detection. J. Agric. Food Chem. 50 (13), 3660-3667 (2002).
- Hamburger, M. O., Cordell, G. A. A direct bioautographic TLC assay for compounds possessing antibacterial activity. J. Nat. Prod. 50 (1), 19-22 (1987).
- Flythe, M., Kagan, I. Antimicrobial effect of red clover (Trifolium pratense) phenolic extract on the ruminal hyper ammonia-producing bacterium, Clostridium sticklandii. Curr. Microbiol. 61, 125-131 .
- Rahalison, L., Hamburger, M., Hostettmann, K., Monod, M., Frenk, E. A bioautographic agar overlay method for the detection of antifungal compounds from higher plants. Phytochem. Anal. 2 (5), 199-203 (1991).
- Chomnawang, M. T., Trinapakul, C., Gritsanapan, W. In vitro antigonococcal activity of Coscinium fenestratum stem extract. J. Ethnopharmacol. 122, 445-449 (2009).
- Stahl, E., Kaldewey, H. Spurenanalyse physiologisch aktiver, einfacher Indolderivate. Hoppe-Seyler’s Z. Physiol. Chem. 323, 182-191 .
- Kagan, I. A., Hammerschmidt, R. Arabidopsis ecotype variability in camalexin production and reaction to infection by Alternaria brassicicola. J. Chem. Ecol. 28 (11), 2121-2140 (2002).
- Kline, R. M., Golab, T. A simple technique in developing thin-layer bioautographs. J. Chromatogr. 18, 409-411 (1965).
- Wedge, D. E., Nagle, D. G. A new 2D-TLC bioautography method for the discovery of novel antifungal agents to control plant pathogens. J. Nat. Prod. 63 (8), 1050-1054 (2000).
- Beck, A. B., Knox, J. R. The acylated isoflavone glycosides from subterranean clover and red clover. Aust. J. Chem. 24 (7), 1509-1518 (1971).
- Kahn, R. A., Bak, S., Svendsen, I., Halkier, B. A., Møller, B. L. Isolation and reconstitution of cytochrome P450ox and in vitro reconstitution of the entire biosynthetic pathway of the cyanogenic glucoside dhurrin from sorghum. Plant Physiol. 115 (4), (1997).
- Peterson, C. A., Edgington, L. V. Quantitative estimation of the fungicide benomyl using a bioautograph technique. J. Agr. Food Chem. 17 (4), 898-899 (1969).

