Dünnschicht-Chromatographie-(TLC) Trennungen und Bioassays der Pflanzenextrakte antimikrobielle Verbindungen zu identifizieren
Summary
Methoden werden für die Dünnschicht-Chromatographie (DC) Trennung von Pflanzenextrakten und Kontakt Bioautographie antibakterielle Metaboliten zu identifizieren beschrieben. Die Methoden sind für das Screening von Rotklee phenolischen Verbindungen Hemmung hyper Ammoniak-produzierende Bakterien (HAB) stammt aus dem Rinder-Pansen aufgebracht.
Abstract
Ein gemeinsamer Bildschirm für Pflanzen antimikrobielle Verbindungen besteht aus der Trennung von Pflanzenextrakten Papier oder Dünnschichtchromatographie (TLC oder PC), Aussetzen der Chromatogramme mikrobiellen Suspensionen (z. B. Pilze und Bakterien in der Brühe oder Agar), so dass genügend Zeit für die Mikroben wachsen in einer feuchten Umgebung und Visualisieren Zonen ohne mikrobielle Wachstum. Die Wirksamkeit dieser Screening-Methode, wie Bioautographie bekannt, hängt sowohl von der Qualität der chromatographischen Trennung und der Sorgfalt, mit mikrobiellen Kulturbedingungen behandelt. Dieses Papier beschreibt Standardprotokolle für TLC und Kontakt Bioautographie mit einer neuen Anwendung zu Säure-Fermentation von Bakterien Aminosäuren. Der Extrakt wird über flexible (Aluminium-backed) Kieselgel-DC-Platten getrennt, und die Banden werden unter UV-(UV-) Licht sichtbar gemacht. Zonen werden auf Agar mit dem Testmikroorganismus beimpft geschnitten und inkubiert Gesicht nach unten. Hemmende Banden werden durch Anfärben der Agar-Platte sichtbars mit Tetrazolium rot. Das Verfahren wird auf die Trennung von Rotklee (Trifolium pratense cv. Kenland) phenolischen Verbindungen und ihre Screening-Aktivität gegen Clostridium sticklandii, einem hyper Ammoniak-produzierenden Bakterium (HAB), die ursprünglich aus der Rinder-Pansen aufgebracht. Die TLC-Verfahren anzuwenden, um viele Arten von Pflanzenextrakten und anderen Bakterienspezies (aerob oder anaerob), sowie Pilze, können als Testorganismen verwendet werden, wenn Kulturbedingungen verändert werden, um die Wachstumsanforderungen der Art passen.
Introduction
Untersuchung auf antimikrobielle Verbindungen in Pflanzen erfordert die Trennung der Komponenten eines Pflanzenextrakts, Belichten eines Testmikroorganismus zu diesen Komponenten und Bestimmen, ob das Wachstum des Mikroorganismus wird von irgendeiner der Verbindungen gehemmt. Trennungen von Papier-oder Dünnschichtchromatographie (TLC oder PC) sind praktisch, weil viele Verbindungen können auf einer ebenen Oberfläche getrennt werden. Trennung auf Polarität basiert, wobei einige Verbindungen feste Bindung an das Adsorbens (Zellulose im Fall von PC, und eine Vielzahl von Adsorptionsmitteln bei der TLC) und die Migration unter anderem 1. Fig. 1 stellt ein Beispiel für die relativen Positionen der polare und unpolare phenolische Verbindungen nach Trennung auf einer Silica-TLC-Platte.
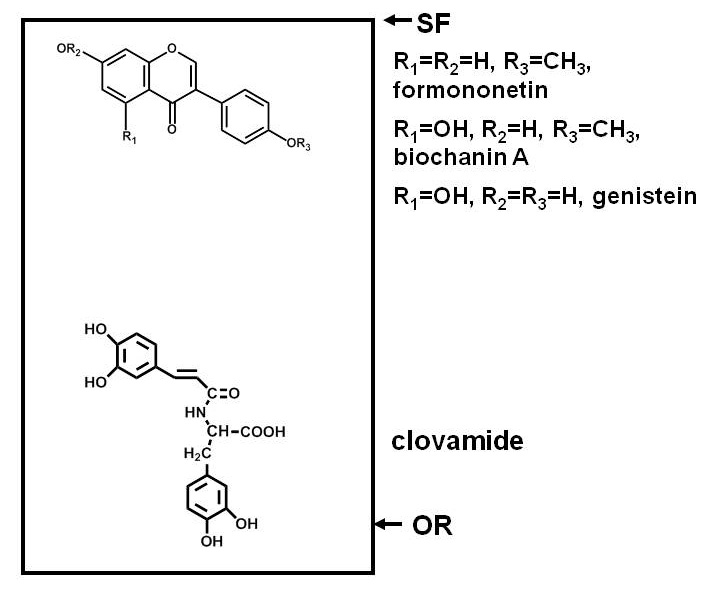
Fig. 1 ist. Schematische Darstellung Verteilungen von Verbindungen unterschiedlicher Polarität nach der Trennung auf einer Silica-Dünnschicht-Chromatographie (DC)-Platte. Phenolverbindungen von Rotklee (Trifolium pratense L.) als Beispiel verwendet. Polare Verbindungen, wie clovamide, haben eine starke Affinität zu einem polaren Adsorbens wie Siliciumdioxid und bleiben in der Nähe des Ursprungs (OR), während weniger polaren Verbindungen, wie die drei Isoflavone in der Nähe der Lösungsmittelfront (SF), Partition leichter in den Lösungsmitteln (es sei denn, das Wasser, Säuren oder Basen enthalten sind weniger polar als Kieselsäure) und wandern weiter bis der Platte.
Nach der Abtrennung eines Extrakts auf eine DC-Platte können Testmikroorganismen zu allen Verbindungen auf der Platte freigelegt werden, und beschleunigt somit die Identifizierung der aktiven Komponenten eines Extraktes 2. Wenn ein Pilz-oder Bakterienkultur wird dem Chromatogramm ausgesetzt ist, wird das mikrobielle Wachstum überall, außer in Bereichen mit Wachstums-Inhibitor auftreteny-Verbindungen. Inhibitionszonen dann kann durch die Beobachtung der Kontrast zwischen Mycel-Wachstum und die Wachstumsfreie Bereiche, wenn Pilze angewendet wurden 3 oder durch Besprühen mit Verbindungen, die Farbe ändern, wenn reduziert oder durch lebende Zellen 4 hydrolysiert visualisiert werden. Obwohl die Verwendung von Papier-oder Dünnschicht-Chromatogramme antimikrobiellen Assays wurde zuerst 5 Antibiotika und Fungizide 3,6 aufgebracht, Pflanzenextrakte werden jetzt häufig für antimikrobielle Verbindungen mit diesem Verfahren, das oft als Bioautographie bezeichnet gescreent. Die beschriebenen Protokolle hierin Bioautographie von Dünnschichtchromatogrammen gelten. TLC wird weithin verwendet, weil es relativ schnell und kann auf verschiedene Adsorbentien (z. B. Siliciumdioxid, Stärke, Aluminiumoxid), sowie eine gute Auflösung und Empfindlichkeit 1 durchgeführt werden.
Pflanzenextrakte können für TLC auf viele Arten hergestellt werden. Gängige Methoden sind extraPflanzenMaterial in alcohol-Wasser-Gemische, wie 80% Ethanol 7,8, gegebenenfalls unter Zusatz von Säure oder Base 9. Nach einer Extraktion in solchen Lösungsmitteln, die etwas Wasser enthalten und gegebenenfalls sauren oder basischen, müssen Extrakte konzentriert werden, so dass sie auf TLC-Platten in einem minimalen Volumen angewendet werden. Die Konzentration der Alkohol-Wasser-Extrakte können durch Aufteilung mit Wasser nicht mischbaren organischen Lösungsmitteln 8 oder mit einem Gemisch solcher Lösungsmittel, wie Ethylacetat-Ethylether (1:1, v / v) 10,11 erreicht werden. Verschiedenen Pflanzenmetabolite werden in verschiedenen organischen Lösungsmitteln extrahiert werden, in Abhängigkeit von ihrer Polarität. Um sicherzustellen, dass die Pflanze organischen Säuren oder Basen werden bei dieser Stufe in organischen Lösungsmitteln extrahiert werden, kann der pH-Wert einer Alkohol-Wasser-Extrakt erhöht oder mit einer wasserlöslichen Säure oder Base zu dissoziierten Analyten in ihre nondissociated Formen, die dann konvertiert abgesenkt löslich in organischen Lösungsmitteln 9 neutral. Die organische Phase kann dann e seinunter Vakuum oder unter Stickstoff vaporated und auf das gewünschte Volumen für die DC eingestellt. Der pH-Wert des Extrakts ist unwahrscheinlich letal Bioassay Mikroorganismen aufgrund der Partitionierung des Analyten in neutralen Lösungsmittel, kleine Endvolumen und Eindampfen des Extraktes auf der DC-Platte vor der Trennung ist.
Beide Pilze und Bakterien werden als Test Mikroorganismen in Bioautographie von Pflanzenextrakten eingesetzt 2. Sporen einiger Pilze wie Cladosporium cucumerinum, keimen auf TLC-Platten (abgesehen von den Bereichen mit Inhibitorverbindungen), wenn auf Platten in einer Nährlösung besprüht und in einer feuchten Umgebung für mehrere Tage 3 inkubiert. Die dunkle Myzel von C. cucumerinum auf nichthemmenden Zonen bietet einen scharfen Kontrast zu den Zonen frei von Myzel-Wachstum. Obwohl Bakterien zu Dünnschicht-Chromatographie (DC)-Platten in der gleichen Weise 4,12 angewendet wurde, werden die Bakterien auch über TLC gegossenPlattenoberflächen in Agar überlagert 13,14. Hefen, wie Candida albicans, in Agar-Overlay sowie 14 aufgebracht werden. Alternativ DC-Platten können dem Gesicht nach unten auf Agar mit Bakterien oder Hefe 10,15 8, ein Verfahren, wie Kontakt Bioautographie 2 bekannt geimpft platziert werden.
Wir beschreiben ein Verfahren zur Kontakt Bioautographie für antimikrobielle phenolische Verbindungen aus Rotklee (Trifolium pratense cv. Kenland) zu screenen. Das Testmikroorganismus Clostridium sticklandii eine Pansen hyper Ammoniak-produzierenden Bakterium (HAB) und anaerobe verpflichten. Obwohl die verwendeten Abstände nicht alle Komponenten des Extrakts zu beheben, erleichtern sie die Identifizierung von Bereichen der antimikrobiellen Aktivität, wodurch Verengung der Pool von möglichen antimikrobielle Verbindungen. Das Protokoll nutzt Standardverfahren für die DC ein. Das Protokoll beschreibt auch einige der Techniken zur Kultivierung erforderlichen VerGate Anaerobier für einen solchen Test ein Verwendungskontakt Bioautographie 15 und einer Visualisierungsmethode mit einem Tetrazolium-Salz, das lebende Zellen 2,4 färbt.
Protocol
Representative Results
Discussion
Dieses Protokoll beschreibt ein einfaches Verfahren zum Trennen eines Extrakts in Untergruppen von Verbindungen und Testen dieser Untermengen von Kontakt Bioautographie. Die Methode ist ganz ähnlich wie ein von Chomnawang et al. Verwendet werden, um für 15 Pflanzenstoffe hemmend auf Gonorrhoe-Bakterien zu untersuchen. Die Art der Bioautographie zu Bildschirm für die antimikrobielle Pflanzenstoffe verwendet, hängt von vielen Faktoren, einschließlich der Testmikroorganismus, der Laboraufbau und de…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Wir danken dem späten Dr. Norm Taylor, Abteilung Pflanzen-und Bodenwissenschaften an der Universität von Kentucky, für die Erlaubnis, seine Proben aus Rotklee Grundstücke für diese Studie zu verwenden. Dieses Projekt wurde von der United States Department of Agriculture finanziert.
Materials
| Silica F254 TLC plates, aluminum-backed, 0.2 mm thickness, 20 × 20 cm | EMD Chemicals | 5554/7 | These plates are coated with silica that contains an indicator fluorescing at 254 nm. Compounds absorbing at that wavelength appear dark on a fluorescent green background. Alternative sources include Analtech, Selecto Scientific, Fluka. Adsorbents other than silica may be needed. Plastic-backed plates may be suitable, depending on the solvents to be used. |
| Sharp, heavy-duty scissors | any sewing supply company | similar to Fiskars 175800-1002 | For cutting TLC plates. A paper cutter with a sharp blade can be used as well. Do not inhale silica dust. |
| Drying oven at 100 °C (mechanical convection) | Thermo Scientific | PR305225M | Quincy Lab, Inc, Chicago, IL (www.quincylab.com); Cascade Technical Sciences, Hillsboro, OR (www.cascadetek.com) |
| TLC chamber | Kimble Chase | 416180-0000 | Alternative sources: Aldrich. Pyrex beakers or preserving jars can be used for small plates (i.e. 5 × 10 cm). Cover with aluminum foil (jar lids may contain material extractable by solvent vapors). |
| 50-µL syringe with flat needle tip | Hamilton | 80965 | For loading amounts of standard or sample exceeding 5-10 µL. Alternative sources are equivalent. |
| micropipets | Drummond | 2-000-001 | For loading small amounts of standards or samples. Alternative sources: VWR. Also, Pasteur pipets can be stretched to a thinner diameter with a butane torch. |
| Filter paper (#1 grade) | Whatman | 1001 917 | Serves as a chamber wick. Other grades of filter paper are OK. This size can be trimmed for the chambers holding 20 × 20 cm plates. |
| Beaker tongs | Fisher Scientific | 15-186 | For putting plates in and out of a large TLC chamber. Alternate sources: VWR |
| Flat-edge forceps | Fisher Scientific | 10-275 | For putting plates in and out of a small chamber. Alternate sources: VWR |
| Small portable UV lamp with 4-Watt or 6-Watt bulbs for short- and long-wave UV light illumination (254 and 365 nm, respectively) | Ultraviolet Products | 95-0271-01 | Alternate sources: Spectronics Corporation (www.spectroline.net) |
| Viewing cabinet for use with hand-held UV lamp | Ultraviolet Products | Chromato-Vue C-10E | UV-active bands are more easily circled if plates can be set in here. Alternate sources: Spectronics Corporation. |
| Photodocumentation system with overhead UV lamp and visible lamp | Kodak | Gel Logic 200 | Alternate sources: Ultraviolet Products (www.uvp.com). See protocol for homemade alternative. |
| Anaerobic Chamber, Type A, Vinyl | Coy | 7150000 | This chamber is appropriate for anaerobic bacteria, like Clostridium sticklandii, as described. However, growth conditions must be tailored to organism used in the assay. A biosafety cabinet and other precautions should be taken if pathogenic organisms are used. Alternate sources: Anaerobe Systems, BioRad, Plas Labs, others |
| Tetrazolium red | Sigma-Aldrich | T8877 | Alternate sources: MP Biomedicals, Santa Cruz Biotechnology, Alfa Aesar |
| Ingredients for HAB media | |||
| Pyridoxamine · 2 HCl | Sigma-Aldrich | P9380 | For this and for all the other reagents in this table, alternative sources are equivalent. |
| Riboflavin | Sigma-Aldrich | R4500 | |
| Thiamine HCl | Sigma-Aldrich | T3902 | |
| Nicotinamide | Sigma-Aldrich | N3376 | |
| Calcium D-Pantothenate | Sigma-Aldrich | C8731 | |
| Lipoic Acid | Sigma-Aldrich | T5625 | |
| p-Aminobenzoic acid | Sigma-Aldrich | A9878 | |
| Folic acid | Sigma-Aldrich | F8798 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Cobalamine | Sigma-Aldrich | C3607 | |
| Pyridoxal HCl | Sigma-Aldrich | P9130 | |
| Pyridoxine | Sigma-Aldrich | P5669 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Iron sulfate · 7 H2O | Sigma-Aldrich | F8263 | |
| Zinc sulfate · 7 H2O | Sigma-Aldrich | Z0251 | |
| Manganese chloride · 4 H2O | Sigma-Aldrich | M8054 | |
| Boric acid | Sigma-Aldrich | B6768 | |
| Cobalt chloride · 6 H2O | Sigma-Aldrich | C8661 | |
| Copper chloride · 2 H2O | Sigma-Aldrich | 459097 | |
| Nickel chloride · 6 H2O | Sigma-Aldrich | 203866 | |
| Sodium molybdate · 2 H2O | Sigma-Aldrich | 331058 | |
| Trypticase (Pancreatic digest of casein) | Thermo Fisher | B11921 | |
| Potassium phosphate monobasic anhydrous | Thermo Fisher | P284 | |
| sodium carbonate · H2O | Thermo Fisher | S636 | |
| Agar | Thermo Fisher | 50841063 | |
| Magnesium sulfate · 6 H2O | Thermo Fisher | 7791-18-6 | |
| Calcium chloride · 2 H2O | Thermo Fisher | BP510 | |
| Cysteine HCl | Thermo Fisher | 19464780 | |
| Potassium phosphate dibasic anhydrous | Thermo Fisher | P290 | |
| Sodium chloride | Thermo Fisher | BP358 |
References
- Stahl, E., Ashworth, M. R. F. . Thin-layer chromatography. , (1969).
- Marston, A. Thin-layer chromatography with biological detection in phytochemistry. J. Chromatogr. A. 1218 (19), 2676-2683 .
- Homans, A. L., Fuchs, A. Direct bioautography on thin-layer chromatograms as a method for detecting fungitoxic substances. J. Chromatogr. 51, 327-329 .
- Lund, B. M., Lyon, G. D. Detection of inhibitors of Erwinia carotovora and E. herbicola on thin-layer chromatograms. J. Chromatogr. 110, 193-196 (1975).
- Betina, V. Bioautography in paper and thin-layer chromatography and its scope in the antibiotic field. J. Chromatogr. A. 78, 41-51 (1973).
- Weltzien, H. C. Ein biologischer Test für fungizide Substanzen auf dem Papierchromatogramm. Naturwissenschaften. 45, 288-289 (1958).
- Khurram, M., Khan, A. M., Hameed, A., Abbas, N., Quayum, A., Inayat, H. Antibacterial activities of Dodonaea viscosa using contact bioautography technique. Molecules. 14 (3), 1332-1341 (2009).
- Khurram, M., et al. Evaluation of anticandidal potential of Quercus baloot Griff. using contact bioautography technique. Afr. J. Pharm. Pharmacol. 5 (12), 1538-1542 (2012).
- Robinson, T. . The Organic Constituents of Higher Plants. , (1963).
- Kagan, I. A., Flythe, M. D. Factors affecting the separation and bioactivity of red clover (Trifolium pratense) extracts assayed against Clostridium sticklandii, a ruminal hyper ammonia-producing bacterium. Nat. Prod. Commun. 7 (12), 1605-1608 (2012).
- Mattila, P., Kumpulainen, J. Determination of free and total phenolic acids in plant-derived foods by HPLC with diode-array detection. J. Agric. Food Chem. 50 (13), 3660-3667 (2002).
- Hamburger, M. O., Cordell, G. A. A direct bioautographic TLC assay for compounds possessing antibacterial activity. J. Nat. Prod. 50 (1), 19-22 (1987).
- Flythe, M., Kagan, I. Antimicrobial effect of red clover (Trifolium pratense) phenolic extract on the ruminal hyper ammonia-producing bacterium, Clostridium sticklandii. Curr. Microbiol. 61, 125-131 .
- Rahalison, L., Hamburger, M., Hostettmann, K., Monod, M., Frenk, E. A bioautographic agar overlay method for the detection of antifungal compounds from higher plants. Phytochem. Anal. 2 (5), 199-203 (1991).
- Chomnawang, M. T., Trinapakul, C., Gritsanapan, W. In vitro antigonococcal activity of Coscinium fenestratum stem extract. J. Ethnopharmacol. 122, 445-449 (2009).
- Stahl, E., Kaldewey, H. Spurenanalyse physiologisch aktiver, einfacher Indolderivate. Hoppe-Seyler’s Z. Physiol. Chem. 323, 182-191 .
- Kagan, I. A., Hammerschmidt, R. Arabidopsis ecotype variability in camalexin production and reaction to infection by Alternaria brassicicola. J. Chem. Ecol. 28 (11), 2121-2140 (2002).
- Kline, R. M., Golab, T. A simple technique in developing thin-layer bioautographs. J. Chromatogr. 18, 409-411 (1965).
- Wedge, D. E., Nagle, D. G. A new 2D-TLC bioautography method for the discovery of novel antifungal agents to control plant pathogens. J. Nat. Prod. 63 (8), 1050-1054 (2000).
- Beck, A. B., Knox, J. R. The acylated isoflavone glycosides from subterranean clover and red clover. Aust. J. Chem. 24 (7), 1509-1518 (1971).
- Kahn, R. A., Bak, S., Svendsen, I., Halkier, B. A., Møller, B. L. Isolation and reconstitution of cytochrome P450ox and in vitro reconstitution of the entire biosynthetic pathway of the cyanogenic glucoside dhurrin from sorghum. Plant Physiol. 115 (4), (1997).
- Peterson, C. A., Edgington, L. V. Quantitative estimation of the fungicide benomyl using a bioautograph technique. J. Agr. Food Chem. 17 (4), 898-899 (1969).

