Cromatográfica em camada delgada (TLC) Separações e Bioensaios de extratos de plantas para identificar compostos antimicrobianos
Summary
Métodos são descritos para-cromatografia em camada delgada (TLC) separação de extratos de plantas e contatar bioautografia para identificar metabólitos antibacterianos. Os métodos são aplicados para o rastreio de compostos fenólicos de trevo vermelho que inibem bactérias produtoras de amoníaco hiper (HAB) nativas para o rúmen de bovinos.
Abstract
Um ecrã comum para compostos anti-microbianos de plantas consiste na separação dos extractos de plantas por papel ou por cromatografia em camada fina (TLC ou PC), expondo os cromatogramas para as suspensões microbianas (por exemplo, fungos e bactérias em caldo ou ágar), dando tempo para que os micróbios a crescer em um ambiente úmido e visualizar zonas sem crescimento microbiano. A eficácia deste método de rastreio, conhecido como bioautografia, depende tanto da qualidade da separação cromatográfica e os cuidados com as condições de cultura microbiana. Este artigo descreve os protocolos padrão para TLC e bioautografia contato com uma nova aplicação de aminoácidos bactérias fermentadoras de ácido. O extrato é separado em flexíveis (lastreados em alumínio) placas de sílica TLC, e bandas são visualizados sob luz ultravioleta (UV). As zonas são cortadas e incubadas a face para baixo em ágar inoculado com o microrganismo teste. Bandas de inibição são visualizadas por coloração da placa de ágars com tetrazólio vermelho. O método é aplicado para a separação de trevo vermelho (Trifolium pratense cv. Kenland) compostos fenólicos e seu rastreio quanto à actividade contra Clostridium sticklandii, uma bactéria produtora de amoníaco hiper (HAB) que é nativo ao rúmen de bovinos. Os métodos de TLC aplicar a vários tipos de extractos de plantas e outras espécies bacterianas (aeróbicas ou anaeróbicas), bem como fungos, podem ser usados como organismos de teste, se as condições de cultura são modificados para se ajustar aos requisitos de crescimento das espécies.
Introduction
Ensaio para compostos anti-microbianos em plantas requer a separação dos componentes de um extracto de planta, a exposição de um microorganismo de teste para os componentes, e determinar se o crescimento do microorganismo é inibida por qualquer um dos compostos. Separações por papel ou por cromatografia em camada fina (TLC ou PC) é conveniente, porque muitos compostos podem ser separados sobre uma superfície plana. A separação baseia-se na polaridade, com a ligação de alguns compostos estreitamente ao adsorvente (celulose, no caso de PC, e uma variedade de adsorventes em caso de TLC) e a migração de menos do que os outros 1. Figura 1 fornece um exemplo das posições relativas compostos fenólicos polares e não polares, após separação numa placa de sílica de CCF.
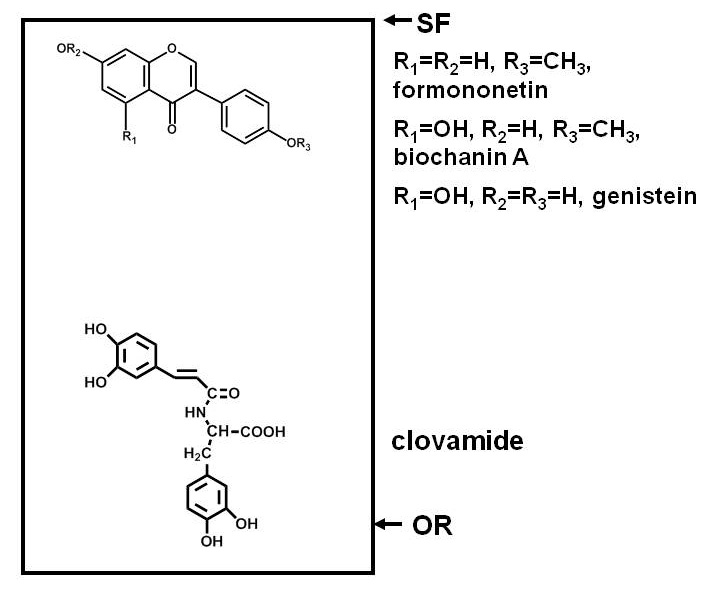
Figura 1. Diagrama que ilustra a distribuição de compostos de diferentes polaridades, após separação num gel de cromatografia de camada fina (TLC) da placa. Compostos fenólicos de trevo vermelho (Trifolium pratense L.), são utilizados como um exemplo. Compostos polares, tais como clovamide, têm uma forte afinidade para um adsorvente polar como sílica e permanecer perto da origem (OR), enquanto que os compostos menos polares, tais como os três isoflavonas perto da frente do solvente (SF), partição mais facilmente em solventes (que são menos polares do que a água a menos de sílica, ácidos ou bases são incluídos) e migra mais longe da placa.
Após a separação de um extracto de uma placa de TLC, os microrganismos de teste podem ser expostos a todos os compostos na placa, acelerando, assim, a identificação dos componentes activos de um extracto 2. Se uma cultura fúngica ou bacteriana é exposta ao cromatograma, o crescimento microbiano irá ocorrer em todos os lugares, excepto em áreas de crescimento com inibidorcompostos y. As zonas de inibição, em seguida, pode ser visualizado pela observação do contraste entre o crescimento micelial e as áreas livres do crescimento de fungos se foram aplicadas 3, ou por pulverização com os compostos que mudam de cor quando reduzido ou hidrolisados pelas células vivas 4. Embora o uso de papel ou de camada fina cromatogramas para ensaios antimicrobianos foi aplicado pela primeira vez aos antibióticos e fungicidas 5 3,6, extratos de plantas já são freqüentemente selecionados para compostos antimicrobianos com este método, muitas vezes referida como bioautografia. Os protocolos aqui descritos aplicam-se a bioautografia dos cromatogramas em camada fina. TLC é amplamente usada porque é relativamente rápida e pode ser realizada em diferentes adsorventes (por exemplo, sílica, amido, alumina), bem como proporcionar boa resolução e sensibilidade 1.
Extractos vegetais podem ser preparados por TLC de muitas maneiras. Os métodos mais comuns incluem material vegetal extração em alcmisturas OHOL em água tais como etanol a 80% 7,8, possivelmente com a adição de ácido ou de base 9. Na sequência de uma extracção em solventes, que contêm água e que são, eventualmente, ácido ou básico, extractos deve ser concentrado de modo a que possam ser aplicadas a placas de TLC em um volume mínimo. A concentração dos extractos de álcool-água pode ser alcançado através da repartição com solventes orgânicos imiscíveis em água 8 ou com uma mistura de tais solventes, tal como acetato de etilo-éter etílico (1:1, v / v) 10,11. Diferentes metabolitos de plantas são extraídos em diferentes solventes orgânicos, dependendo das suas polaridades. Para garantir que os ácidos orgânicos vegetais ou bases são extraídos para solventes orgânicos, nesta fase, o pH de um extracto de álcool e água pode ser aumentado ou reduzido com um ácido solúvel em água ou uma base para converter analitos dissociados em suas formas nondissociated, que são então solúveis em solventes orgânicos neutros 9. A fase orgânica pode então ser evaporated sob pressão reduzida ou sob azoto, e ajustou-se o volume pretendido de TLC. O pH do extracto é improvável que seja letal para os microorganismos bio-ensaio, devido à partição de analitos em dissolventes neutros, pequeno volume final, e a evaporação do extracto sobre a placa de TLC, antes da separação.
Ambos os fungos e bactérias são empregados como microrganismos testes em bioautografia de extratos vegetais 2. Esporos de alguns fungos, tais como Cladosporium cucumerinum, germinar sobre placas de TLC (além de regiões com compostos inibitórios), se for pulverizado sobre placas de uma solução nutriente e incubou-se em um ambiente húmido durante vários dias 3. O micélio escuro da C. cucumerinum em zonas noninhibitory fornece um nítido contraste com as zonas francas de crescimento micelial. Apesar de as bactérias terem sido aplicadas a cromatografia em camada fina (TLC) as placas da mesma forma que 4,12, bactérias também são derramadas sobre TLCsuperfícies da placa de ágar sobrepõe 13,14. Levedura, tais como Candida albicans, pode ser aplicado em sobreposições de agar, bem 14. Alternativamente, placas de TLC pode ser colocado de bruços em ágar inoculadas com bactérias ou leveduras 10,15 8, um método conhecido como contato bioautografia 2.
Nós descrevemos um método para contato bioautografia para triagem de compostos fenólicos antimicrobianos de trevo vermelho (Trifolium pratense cv. Kenland). O microrganismo teste é sticklandii Clostridium, uma produtora de amônia bactéria hiper ruminal (HAB) e obrigar anaeróbio. Embora as separações utilizados não resolve todos os componentes do extracto, que facilitam a identificação de zonas de actividade antimicrobiana, reduzindo, assim, o conjunto de possíveis compostos antimicrobianos. O protocolo utiliza procedimentos padrão para TLC 1. O protocolo também descreve algumas das técnicas necessárias para a cultura obrianaeróbios de corrediça para um tal ensaio, a utilização de contacto bioautografia 15 e um método de visualização com um sal de tetrazólio, que cora as células vivas de 2,4.
Protocol
Representative Results
Discussion
Este protocolo descreve um método simples para a separação de um extrato em subconjuntos de compostos e ensaiando esses subconjuntos por contato bioautografia. O método é bastante semelhante ao utilizado por 15 Chomnawang et al. Seleccionar para os metabolitos de plantas inibidoras para as bactérias causadoras de gonorreia. O tipo de bioautografia empregues para o rastreio de compostos anti-microbianos de plantas depende de muitos factores, incluindo o microorganismo de teste, a configuração …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos ao falecido Dr. Norm Taylor, Departamento de Plantas e Ciência do Solo da Universidade de Kentucky, por nos permitir usar amostras de suas tramas trevo vermelho para este estudo. Este projeto foi financiado pelo Departamento de Agricultura dos Estados Unidos.
Materials
| Silica F254 TLC plates, aluminum-backed, 0.2 mm thickness, 20 × 20 cm | EMD Chemicals | 5554/7 | These plates are coated with silica that contains an indicator fluorescing at 254 nm. Compounds absorbing at that wavelength appear dark on a fluorescent green background. Alternative sources include Analtech, Selecto Scientific, Fluka. Adsorbents other than silica may be needed. Plastic-backed plates may be suitable, depending on the solvents to be used. |
| Sharp, heavy-duty scissors | any sewing supply company | similar to Fiskars 175800-1002 | For cutting TLC plates. A paper cutter with a sharp blade can be used as well. Do not inhale silica dust. |
| Drying oven at 100 °C (mechanical convection) | Thermo Scientific | PR305225M | Quincy Lab, Inc, Chicago, IL (www.quincylab.com); Cascade Technical Sciences, Hillsboro, OR (www.cascadetek.com) |
| TLC chamber | Kimble Chase | 416180-0000 | Alternative sources: Aldrich. Pyrex beakers or preserving jars can be used for small plates (i.e. 5 × 10 cm). Cover with aluminum foil (jar lids may contain material extractable by solvent vapors). |
| 50-µL syringe with flat needle tip | Hamilton | 80965 | For loading amounts of standard or sample exceeding 5-10 µL. Alternative sources are equivalent. |
| micropipets | Drummond | 2-000-001 | For loading small amounts of standards or samples. Alternative sources: VWR. Also, Pasteur pipets can be stretched to a thinner diameter with a butane torch. |
| Filter paper (#1 grade) | Whatman | 1001 917 | Serves as a chamber wick. Other grades of filter paper are OK. This size can be trimmed for the chambers holding 20 × 20 cm plates. |
| Beaker tongs | Fisher Scientific | 15-186 | For putting plates in and out of a large TLC chamber. Alternate sources: VWR |
| Flat-edge forceps | Fisher Scientific | 10-275 | For putting plates in and out of a small chamber. Alternate sources: VWR |
| Small portable UV lamp with 4-Watt or 6-Watt bulbs for short- and long-wave UV light illumination (254 and 365 nm, respectively) | Ultraviolet Products | 95-0271-01 | Alternate sources: Spectronics Corporation (www.spectroline.net) |
| Viewing cabinet for use with hand-held UV lamp | Ultraviolet Products | Chromato-Vue C-10E | UV-active bands are more easily circled if plates can be set in here. Alternate sources: Spectronics Corporation. |
| Photodocumentation system with overhead UV lamp and visible lamp | Kodak | Gel Logic 200 | Alternate sources: Ultraviolet Products (www.uvp.com). See protocol for homemade alternative. |
| Anaerobic Chamber, Type A, Vinyl | Coy | 7150000 | This chamber is appropriate for anaerobic bacteria, like Clostridium sticklandii, as described. However, growth conditions must be tailored to organism used in the assay. A biosafety cabinet and other precautions should be taken if pathogenic organisms are used. Alternate sources: Anaerobe Systems, BioRad, Plas Labs, others |
| Tetrazolium red | Sigma-Aldrich | T8877 | Alternate sources: MP Biomedicals, Santa Cruz Biotechnology, Alfa Aesar |
| Ingredients for HAB media | |||
| Pyridoxamine · 2 HCl | Sigma-Aldrich | P9380 | For this and for all the other reagents in this table, alternative sources are equivalent. |
| Riboflavin | Sigma-Aldrich | R4500 | |
| Thiamine HCl | Sigma-Aldrich | T3902 | |
| Nicotinamide | Sigma-Aldrich | N3376 | |
| Calcium D-Pantothenate | Sigma-Aldrich | C8731 | |
| Lipoic Acid | Sigma-Aldrich | T5625 | |
| p-Aminobenzoic acid | Sigma-Aldrich | A9878 | |
| Folic acid | Sigma-Aldrich | F8798 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Cobalamine | Sigma-Aldrich | C3607 | |
| Pyridoxal HCl | Sigma-Aldrich | P9130 | |
| Pyridoxine | Sigma-Aldrich | P5669 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Iron sulfate · 7 H2O | Sigma-Aldrich | F8263 | |
| Zinc sulfate · 7 H2O | Sigma-Aldrich | Z0251 | |
| Manganese chloride · 4 H2O | Sigma-Aldrich | M8054 | |
| Boric acid | Sigma-Aldrich | B6768 | |
| Cobalt chloride · 6 H2O | Sigma-Aldrich | C8661 | |
| Copper chloride · 2 H2O | Sigma-Aldrich | 459097 | |
| Nickel chloride · 6 H2O | Sigma-Aldrich | 203866 | |
| Sodium molybdate · 2 H2O | Sigma-Aldrich | 331058 | |
| Trypticase (Pancreatic digest of casein) | Thermo Fisher | B11921 | |
| Potassium phosphate monobasic anhydrous | Thermo Fisher | P284 | |
| sodium carbonate · H2O | Thermo Fisher | S636 | |
| Agar | Thermo Fisher | 50841063 | |
| Magnesium sulfate · 6 H2O | Thermo Fisher | 7791-18-6 | |
| Calcium chloride · 2 H2O | Thermo Fisher | BP510 | |
| Cysteine HCl | Thermo Fisher | 19464780 | |
| Potassium phosphate dibasic anhydrous | Thermo Fisher | P290 | |
| Sodium chloride | Thermo Fisher | BP358 |
References
- Stahl, E., Ashworth, M. R. F. . Thin-layer chromatography. , (1969).
- Marston, A. Thin-layer chromatography with biological detection in phytochemistry. J. Chromatogr. A. 1218 (19), 2676-2683 .
- Homans, A. L., Fuchs, A. Direct bioautography on thin-layer chromatograms as a method for detecting fungitoxic substances. J. Chromatogr. 51, 327-329 .
- Lund, B. M., Lyon, G. D. Detection of inhibitors of Erwinia carotovora and E. herbicola on thin-layer chromatograms. J. Chromatogr. 110, 193-196 (1975).
- Betina, V. Bioautography in paper and thin-layer chromatography and its scope in the antibiotic field. J. Chromatogr. A. 78, 41-51 (1973).
- Weltzien, H. C. Ein biologischer Test für fungizide Substanzen auf dem Papierchromatogramm. Naturwissenschaften. 45, 288-289 (1958).
- Khurram, M., Khan, A. M., Hameed, A., Abbas, N., Quayum, A., Inayat, H. Antibacterial activities of Dodonaea viscosa using contact bioautography technique. Molecules. 14 (3), 1332-1341 (2009).
- Khurram, M., et al. Evaluation of anticandidal potential of Quercus baloot Griff. using contact bioautography technique. Afr. J. Pharm. Pharmacol. 5 (12), 1538-1542 (2012).
- Robinson, T. . The Organic Constituents of Higher Plants. , (1963).
- Kagan, I. A., Flythe, M. D. Factors affecting the separation and bioactivity of red clover (Trifolium pratense) extracts assayed against Clostridium sticklandii, a ruminal hyper ammonia-producing bacterium. Nat. Prod. Commun. 7 (12), 1605-1608 (2012).
- Mattila, P., Kumpulainen, J. Determination of free and total phenolic acids in plant-derived foods by HPLC with diode-array detection. J. Agric. Food Chem. 50 (13), 3660-3667 (2002).
- Hamburger, M. O., Cordell, G. A. A direct bioautographic TLC assay for compounds possessing antibacterial activity. J. Nat. Prod. 50 (1), 19-22 (1987).
- Flythe, M., Kagan, I. Antimicrobial effect of red clover (Trifolium pratense) phenolic extract on the ruminal hyper ammonia-producing bacterium, Clostridium sticklandii. Curr. Microbiol. 61, 125-131 .
- Rahalison, L., Hamburger, M., Hostettmann, K., Monod, M., Frenk, E. A bioautographic agar overlay method for the detection of antifungal compounds from higher plants. Phytochem. Anal. 2 (5), 199-203 (1991).
- Chomnawang, M. T., Trinapakul, C., Gritsanapan, W. In vitro antigonococcal activity of Coscinium fenestratum stem extract. J. Ethnopharmacol. 122, 445-449 (2009).
- Stahl, E., Kaldewey, H. Spurenanalyse physiologisch aktiver, einfacher Indolderivate. Hoppe-Seyler’s Z. Physiol. Chem. 323, 182-191 .
- Kagan, I. A., Hammerschmidt, R. Arabidopsis ecotype variability in camalexin production and reaction to infection by Alternaria brassicicola. J. Chem. Ecol. 28 (11), 2121-2140 (2002).
- Kline, R. M., Golab, T. A simple technique in developing thin-layer bioautographs. J. Chromatogr. 18, 409-411 (1965).
- Wedge, D. E., Nagle, D. G. A new 2D-TLC bioautography method for the discovery of novel antifungal agents to control plant pathogens. J. Nat. Prod. 63 (8), 1050-1054 (2000).
- Beck, A. B., Knox, J. R. The acylated isoflavone glycosides from subterranean clover and red clover. Aust. J. Chem. 24 (7), 1509-1518 (1971).
- Kahn, R. A., Bak, S., Svendsen, I., Halkier, B. A., Møller, B. L. Isolation and reconstitution of cytochrome P450ox and in vitro reconstitution of the entire biosynthetic pathway of the cyanogenic glucoside dhurrin from sorghum. Plant Physiol. 115 (4), (1997).
- Peterson, C. A., Edgington, L. V. Quantitative estimation of the fungicide benomyl using a bioautograph technique. J. Agr. Food Chem. 17 (4), 898-899 (1969).

