シグナル伝達タンパク質の機能を模倣:人工シグナル伝達療法に向けて
Summary
We present guidelines for developing synthetic ‘chemical transducers’ that can induce communication between naturally unrelated proteins. In addition, detailed protocols are presented for synthesizing and testing a specific ‘transducer’ that enables a growth factor to activate a detoxifying enzyme and consequently, to regulate the cleavage of an anticancer prodrug.
Abstract
Signal transduction pathways, which control the response of cells to various environmental signals, are mediated by the function of signaling proteins that interact with each other and activate one other with high specificity. Synthetic agents that mimic the function of these proteins might therefore be used to generate unnatural signal transduction steps and consequently, alter the cell’s function. We present guidelines for designing ‘chemical transducers’ that can induce artificial communication between native proteins. In addition, we present detailed protocols for synthesizing and testing a specific ‘transducer’, which can induce communication between two unrelated proteins: platelet-derived growth-factor (PDGF) and glutathione-S-transferase (GST). The way by which this unnatural PDGF-GST communication could be used to control the cleavage of an anticancer prodrug is also presented, indicating the potential for using such systems in ‘artificial signal transduction therapy’. This work is intended to facilitate developing additional ‘transducers’ of this class, which may be used to mediate intracellular protein-protein communication and consequently, to induce artificial cell signaling pathways.
Introduction
シグナル伝達経路は、事実上すべての細胞プロセスにおいて重要な役割を果たし、細胞が急速に環境シグナルに応答することができます。1これらの経路は、多くの場合、細胞内酵素の活性化をもたらす細胞外受容体へのシグナル伝達分子の結合によってトリガされます。細胞内でこの信号の増幅及び伝播は酵素が可逆的に高い特異性で活性化されたタンパク質 – タンパク質相互作用のネットワークを形成するタンパク質のシグナル伝達機能によって媒介されます。これらのネットワークの調節不全は、しばしば癌の発生につながるので、薬は悪性のシグナル伝達経路を破壊するように設計されていることにより、2 '癌のシグナル伝達療法」を確立する上で多くの関心が集まっています。我々は最近、不自然なシグナル伝達経路を生成する薬物の能力に依存している形質導入療法をシグナリングするための代替的なアプローチを提案しています。 <su特に、P>図3は、我々は、シグナル伝達タンパク質の機能を模倣する合成薬剤を設計することによって、間接的に、細胞の機能を調節することが可能であると考えています。例えば、これらの人工的なネットワークは、プロドラッグを切断する酵素を活性化するタンパク質バイオマーカーを使用可能にすることができます。あるいは、これらのシグナル伝達タンパク質の模倣物は、治療効果が得られ、不自然な細胞シグナル伝達経路を活性化することができるかもしれません。
このアプローチの実現可能性を実証するために、我々は最近であるグルタチオン-S-トランスフェラーゼ(GST)を、活性化することによって抗癌プロドラッグの切断を誘発する血小板由来増殖因子(PDGF)を可能にする合成「化学変換器4 ' を作成しましたない、その天然の結合パートナー。この「トランスデューサー」の構造は、GSTのための二価阻害剤で修飾されている抗PDGFのDNAアプタマーで構成されています。したがって、この合成剤は、への結合部位を有する分子のファミリーに属し異なるタンパク質、二量体化の5-7のような化学誘導物質(のCID)8-10と、オリゴヌクレオチド合成分子複合体に基づいてタンパク質-結合剤のグループに。11月21日
そのようなシステムの設計の基礎となる一般的な原理は、本明細書に記載されており、合成及び従来の酵素アッセイを使用してこの「変換器」の機能を試験するための詳細なプロトコルが提供されます。この作業は、細胞内のタンパク質 – タンパク質の通信を仲介し、その結果として、人工的な細胞シグナル伝達経路を誘導するために使用することができるこのクラスの追加の「変換器」を、開発を促進することを意図しています。
図1は、不自然なタンパク質-タンパク質の通信を媒介することができる合成「化学変換器」の動作原理を説明しています。 protのための合成バインダーを統合し、この図では、「化学変換器」では、アインスIおよびII(バインダーIおよびII)は、その天然の結合相手ではないタンパク質の触媒活性Iを、トリガするタンパク質IIを可能にします。タンパク質IIの非存在下では、トランスデューサは、酵素(タンパク質I)の触媒部位に結合した ( 図1、状態II)の活性を阻害します。タンパク質IIに「トランスデューサ」の結合が、その結果の有効濃度をタンパク質I.向かってその親和性を低下させるバインダーIおよびIIタンパク質の表面( 図1、状態III)の間の相互作用を促進します」溶液中の遊離」トランスデューサは、私は複雑で、タンパク質I( 図1、状態IV)の再活性化にトランスデューサタンパク質の解離につながる、減少します。 (1)「トランスデューサー」はタンパク質標的のそれぞれについて具体的なバインダーを持っている必要があり、(2)相互作用betwe:まとめると、これらの手順は、効率的な「変換器」の設計の基礎となる3つの基本的な原則を強調表示しましたバインダーIIおよびタンパク質II専用私はタンパク質IIの表面と相互作用することができなければならないIおよびタンパク質I、および(3)バインダーバインダーとの間の相互作用よりも強いでなければなりません。この最後の原則は必ずしもバインダーは、単独で私はタンパク質IIに対して高い親和性と選択性を有することは必要ありません。その代わりに、それは、タンパク質の近傍に合成分子をもたらすことは、この分子とタンパク質表面との間の相互作用を促進する可能性があることを示した我々の最近の研究に基づいている。19,22,23
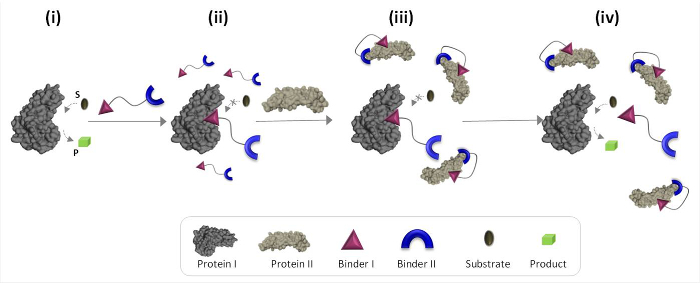
図1:「化学トランスデューサは'I(状態I)活性タンパク質に付加されている場合「化学変換器」の動作原理は 、それがバインダーIを介して、その活性部位に結合し、その活性(状態II)を阻害します。タンパク質II、但し、結合していない「化学Tの存在下でransducerは「バインダーI及びタンパク質IIの表面との間の相互作用を促進するバインダーIIを通じてタンパク質IIと相互作用します。この誘導された結合剤I-タンパク質IIの相互作用は、私は、複雑な「transducer'タンパク質の解離につながるバインダーの有効濃度Iを、減少させ、タンパク質に私が再活性化(状態IV)。 この図の拡大版をご覧になるにはこちらをクリックしてください。 。
Protocol
Representative Results
Discussion
We presented a method for designing and testing of a ‘chemical transducer’ that can induce artificial communication between two naturally unrelated proteins, GST and PDGF, without modifying the native proteins. The unnatural GST-PDGF communications could be detected in real time by using enzymatic assays that follow the changes in the activity of GST in the presence of the ‘chemical transducer’ and increasing the concentrations of PDGF. In addition to detecting the activation of GST by PDGF, these assays were used to fol…
Disclosures
The authors have nothing to disclose.
Acknowledgements
この研究はミネルバ財団、HFSP組織、および欧州研究評議会助成金(グラント338265を開始する)によってサポートされていました。
Materials
| 1-chloro-2,4-dinitrobenzene | Sigma-Aldrich | 237329 | |
| Acetic acid | Bio Lab | 01070521 | |
| Acetnitrile | J.T.Baker | 9017-03 | |
| Ascorbic acid | Sigma-Aldrich | A4544 | |
| Copper(II) Sulfate pentahydrate | Merck-Millipore | 102790 | |
| Dimethyl sulfoxide | Merck-Millipore | 802912 | |
| Dulbecco's Phosphate Buffered Saline | Biological Industries | 02-023-5A | |
| Ethacrynic acid | Tokyo Chemical Industry Co. Ltd | E0526 | |
| Glutathione-s-transferase M1-1 | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| JS-K | Sigma-Aldrich | J4137 | |
| L-glutathione reduced | Sigma-Aldrich | G4251 | |
| Magnesium Chloride | J.T.Baker | 0162 | |
| nitrate/nitrite colorimetric assay kit | Cayman Chemical | 780001 | |
| Oligonucleotides | W. M. Keck Foundation Biotechnology at Yale University | custom order | |
| PDGF-BB | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| TBTA | Sigma-Aldrich | 678937 | |
| Triethylamine | Sigma-Aldrich | T0886 | |
| Desalting column | GE Healthcare | illustra MicroSpin G-25 Columns | |
| HPLC | Waters | 2695 separation module | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 4.6 mm × 50 mm) | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5μM, 10 mm × 50 mm) | |
| Plate reader | BioTek | synergy H4 hybrid |
References
- Hunter, T. Signaling—2000 and Beyond. Cell. 100, 113-127 (2000).
- Levitzki, A., Klein, S. Signal transduction therapy of cancer. Mol Aspects Med. 31, 287-329 (2010).
- Peri-Naor, R., Motiei, L., Margulies, D. Artificial signal transduction therapy: a futuristic approach to disease treatment. Future Med. Chem. 7, 2091-2093 (2015).
- Peri-Naor, R., Ilani, T., Motiei, L., Margulies, D. Protein-Protein Communication and Enzyme Activation Mediated by a Synthetic Chemical Transducer. J. Am. Chem. Soc. 137, 9507-9510 (2015).
- Corson, T. W., Aberle, N., Crews, C. M. Design and Applications of Bifunctional Small Molecules: Why Two Heads Are Better Than One. ACS Chem. Biol. 3, 677-692 (2008).
- Rutkowska, A., Schultz, C. Protein Tango: The Toolbox to Capture Interacting Partners. Angew. Chem. Int. Ed. 51, 8166-8176 (2012).
- Meyer, C., Köhn, M. A Molecular Tête-à-Tête Arranged by a Designed Adaptor Protein. Angew. Chem. Int. Ed. 51, 8160-8162 (2012).
- Klemm, J. D., Schreiber, S. L., Crabtree, G. R. Dimerization as a Regulatory Mechanism in Signal Transduction. Annu. Rev. Immunol. 16, 569-592 (1998).
- DeRose, R., Miyamoto, T., Inoue, T. Manipulating signaling at will: chemically-inducible dimerization (CID) techniques resolve problems in cell biology. Pflugers Arch. 465, 409-417 (2013).
- Gestwicki, J. E., Marinec, P. S. Chemical control over protein-protein interactions: beyond inhibitors. Comb. Chem. High Throughput. Screen. 10, 667-675 (2007).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. 25, 848-862 (2013).
- Diezmann, F., Seitz, O. DNA-guided display of proteins and protein ligands for the interrogation of biology. Chem. Soc. Rev. 40, 5789-5801 (2011).
- Röglin, L., Ahmadian, M. R., Seitz, O. DNA-Controlled Reversible Switching of Peptide Conformation and Bioactivity. Angew. Chem. Int. Ed. 46, 2704-2707 (2007).
- Röglin, L., Altenbrunn, F., Seitz, O. DNA and RNA-Controlled Switching of Protein Kinase Activity. ChemBioChem. 10, 758-765 (2009).
- Harris, D. C., Chu, X., Jayawickramarajah, J. DNA-Small Molecule Chimera with Responsive Protein-Binding Ability. J. Am. Chem. Soc. 130, 14950-14951 (2008).
- Harris, D. C., Saks, B. R., Jayawickramarajah, J. Protein-Binding Molecular Switches via Host-Guest Stabilized DNA Hairpins. J. Am. Chem. Soc. 133, 7676-7679 (2011).
- Kim, Y., Cao, Z., Tan, W. Molecular assembly for high-performance bivalent nucleic acid inhibitor. Proc. Nat. Acad. Sci. U.S.A. 105, 5664-5669 (2008).
- Han, D., et al. A Logical Molecular Circuit for Programmable and Autonomous Regulation of Protein Activity Using DNA Aptamer-Protein Interactions. J. Am. Chem. Soc. 134, 20797-20804 (2012).
- Motiei, L., Pode, Z., Koganitsky, A., Margulies, D. Targeted Protein Surface Sensors as a Tool for Analyzing Small Populations of Proteins in Biological Mixtures. Angew. Chem. Int. Ed. 53, 9289-9293 (2014).
- Ranallo, S., Rossetti, M., Plaxco, K. W., Vallée-Bélisle, A., Ricci, F. A Modular, DNA-Based Beacon for Single-Step Fluorescence Detection of Antibodies and Other Proteins. Angew. Chem. Int. Ed. 54, 13214-13218 (2015).
- Franzini, R. M., et al. Identification of Structure-Activity Relationships from Screening a Structurally Compact DNA-Encoded Chemical Library. Angew. Chem. Int. Ed. 54, 3927-3931 (2015).
- Unger-Angel, L., et al. Protein recognition by bivalent, ‘turn-on’ fluorescent molecular probes. Chem. Sci. 6, 5419-5425 (2015).
- Nissinkorn, Y., et al. Sensing Protein Surfaces with Targeted Fluorescent Receptors. Chem. Eur. J. 21, 15981-15987 (2015).
- Huber, C. G., Oefner, P. J., Bonn, G. K. High-Resolution Liquid Chromatography of Oligonucleotides on Nonporous Alkylated Styrene-Divinylbenzene Copolymers. Anal. Biochem. 212, 351-358 (1993).
- Lyon, R. P., Hill, J. J., Atkins, W. M. Novel class of bivalent glutathione S-transferase inhibitors. Biochemistry. 42, 10418-10428 (2003).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. , 1-16 (2013).

