Подражая функции сигнальных белков: на пути к искусственному трансдукции сигнала терапии
Summary
We present guidelines for developing synthetic ‘chemical transducers’ that can induce communication between naturally unrelated proteins. In addition, detailed protocols are presented for synthesizing and testing a specific ‘transducer’ that enables a growth factor to activate a detoxifying enzyme and consequently, to regulate the cleavage of an anticancer prodrug.
Abstract
Signal transduction pathways, which control the response of cells to various environmental signals, are mediated by the function of signaling proteins that interact with each other and activate one other with high specificity. Synthetic agents that mimic the function of these proteins might therefore be used to generate unnatural signal transduction steps and consequently, alter the cell’s function. We present guidelines for designing ‘chemical transducers’ that can induce artificial communication between native proteins. In addition, we present detailed protocols for synthesizing and testing a specific ‘transducer’, which can induce communication between two unrelated proteins: platelet-derived growth-factor (PDGF) and glutathione-S-transferase (GST). The way by which this unnatural PDGF-GST communication could be used to control the cleavage of an anticancer prodrug is also presented, indicating the potential for using such systems in ‘artificial signal transduction therapy’. This work is intended to facilitate developing additional ‘transducers’ of this class, which may be used to mediate intracellular protein-protein communication and consequently, to induce artificial cell signaling pathways.
Introduction
Трансдукции сигнала пути играют важную роль практически во всех клеточных процессов и позволяют клетке быстро реагировать на внешние сигналы. 1 Эти пути часто вызываются связывание сигнальной молекулы с внеклеточным рецептором, что приводит к активации внутриклеточных ферментов. Усиление и распространение этого сигнала внутри клетки опосредовано функцией сигнальных белков, которые образуют сеть белок-белковых взаимодействий, в котором ферменты обратимо активированную с высокой специфичностью. Поскольку дисрегуляция этих сетей часто приводит к развитию рака, наблюдается большой интерес к созданию "сигнальной трансдукции терапии рака ', 2 ' в результате чего препараты предназначены для разрушения злокачественных сигнальных путей. Недавно мы предложили альтернативный подход к сигнальной трансдукции терапии, который зависит от способности препаратов генерировать неестественные пути передачи сигнала. <suр> 3 В частности, мы считаем , что при разработке синтетических агентов , которые имитируют функцию сигнальных белков, можно было бы модулировать функцию клетки косвенно. Например, эти искусственные сети могут позволить белка биомаркеров активировать ферменты, расщепляющие пролекарств. В качестве альтернативы, эти сигнальные белковые миметики могут быть способны активировать неестественные сигнальных путей клеток, в результате чего терапевтический эффект.
Для того, чтобы продемонстрировать возможность такого подхода, мы недавно создали синтетический 'химический датчик' 4 , который позволяет тромбоцитарный фактор роста (PDGF) , чтобы вызвать расщепление противоопухолевого пролекарства путем активации глутатион-S-трансферазы (GST), который не его естественный партнер по связыванию. Структура этого «датчика» состоит из анти-PDGF ДНК аптамеров, который модифицирован с ингибитором двухвалентной для GST. Следовательно, этот синтетический агент принадлежит к семейству молекул с сайтами связывания дляразличные белки, 5-7 , таких как химические индукторы димеризации (ИДС) 8-10 , а также к группе белков-связующие на основе олигонуклеотидных конъюгатов-синтетической молекулы. 11-21
Общие принципы, лежащие в основе конструкции таких систем описаны здесь и подробные протоколы для синтеза и тестирования функции этого «датчика» с обычными ферментативных анализов предоставляются. Эта работа предназначена для облегчения разработки дополнительных «преобразователей» этого класса, который может быть использован в качестве посредника внутриклеточный связи белок-белок, и, следовательно, для индукции искусственных сигнальных путей клеток.
На рисунке 1 схематически описывает принципы работы синтетических «химических преобразователей» , которые могут опосредовать неестественные белок-белковые связи. На этой иллюстрации, а 'химический преобразователь », который объединяет синтетические связующие вещества для PROTEins I и II (связующие вещества I и II), позволяет белок II, чтобы вызвать каталитическую активность белка I, который не является ее естественным партнером связывания. При отсутствии белка II, преобразователь связывает каталитический участок фермента (белка I) и ингибирует его активность (Рисунок 1, стенд II). Связывание "преобразователя" к белку II, тем не менее, обеспечивает взаимодействие между связующей I и поверхностью белка II (рис 1, стенд III), что снижает его сродство к белковой I. В результате эффективная концентрация ' свободный 'датчик в растворе уменьшается, что приводит к диссоциации преобразователя-белка I комплекса и реактивации белка I (рис 1, состояние IV). Взятые вместе, эти шаги выделить три основные принципы, лежащие в основе создания эффективных 'преобразователей': (1) 'датчик' должен иметь конкретное связующее для каждого из белковых мишеней, (2) взаимодействие betweен вяжущего II и белка II должен быть сильнее, чем взаимодействие между связующей I и белка I, и (3) вяжущего я должен иметь возможность взаимодействовать с поверхностью белка II. Этот последний принцип не обязательно требует, чтобы связующее только я бы высокое сродство и избирательность по отношению к белку II. Вместо этого, оно основано на наших недавних исследований , которые показали , что в результате чего синтетическую молекулу , в непосредственной близости к белку может способствовать взаимодействие между этой молекулой и поверхностью белка. 19,22,23
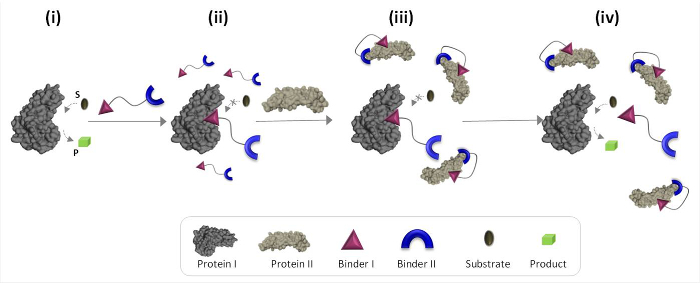
Рисунок 1:. Принцип работы технологии 'химических преобразователей "Когда" химический преобразователь' добавляется в активный белок I (состояние I), он связывается с его активным сайтом через связующее I и ингибирует его активность (состояние II). В присутствии белка II, однако, несвязанный "химический тransducer 'взаимодействует с белком II через вяжущего II, который обеспечивает взаимодействие между связующей I и поверхностью белка II. Это побудило связующее I-II белок взаимодействие снижает эффективную концентрацию связующего вещества I, что приводит к диссоциации "transducer'-белка I комплекса и белка I реактивации (состояние IV). Пожалуйста , нажмите здесь , чтобы посмотреть большую версию этой фигуры ,
Protocol
Representative Results
Discussion
We presented a method for designing and testing of a ‘chemical transducer’ that can induce artificial communication between two naturally unrelated proteins, GST and PDGF, without modifying the native proteins. The unnatural GST-PDGF communications could be detected in real time by using enzymatic assays that follow the changes in the activity of GST in the presence of the ‘chemical transducer’ and increasing the concentrations of PDGF. In addition to detecting the activation of GST by PDGF, these assays were used to fol…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Это исследование было поддержано Минерва, Фондом HFSP организации, и научно-исследовательского гранта Европейского Совета (Начиная Грант 338265).
Materials
| 1-chloro-2,4-dinitrobenzene | Sigma-Aldrich | 237329 | |
| Acetic acid | Bio Lab | 01070521 | |
| Acetnitrile | J.T.Baker | 9017-03 | |
| Ascorbic acid | Sigma-Aldrich | A4544 | |
| Copper(II) Sulfate pentahydrate | Merck-Millipore | 102790 | |
| Dimethyl sulfoxide | Merck-Millipore | 802912 | |
| Dulbecco's Phosphate Buffered Saline | Biological Industries | 02-023-5A | |
| Ethacrynic acid | Tokyo Chemical Industry Co. Ltd | E0526 | |
| Glutathione-s-transferase M1-1 | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| JS-K | Sigma-Aldrich | J4137 | |
| L-glutathione reduced | Sigma-Aldrich | G4251 | |
| Magnesium Chloride | J.T.Baker | 0162 | |
| nitrate/nitrite colorimetric assay kit | Cayman Chemical | 780001 | |
| Oligonucleotides | W. M. Keck Foundation Biotechnology at Yale University | custom order | |
| PDGF-BB | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| TBTA | Sigma-Aldrich | 678937 | |
| Triethylamine | Sigma-Aldrich | T0886 | |
| Desalting column | GE Healthcare | illustra MicroSpin G-25 Columns | |
| HPLC | Waters | 2695 separation module | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 4.6 mm × 50 mm) | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5μM, 10 mm × 50 mm) | |
| Plate reader | BioTek | synergy H4 hybrid |
References
- Hunter, T. Signaling—2000 and Beyond. Cell. 100, 113-127 (2000).
- Levitzki, A., Klein, S. Signal transduction therapy of cancer. Mol Aspects Med. 31, 287-329 (2010).
- Peri-Naor, R., Motiei, L., Margulies, D. Artificial signal transduction therapy: a futuristic approach to disease treatment. Future Med. Chem. 7, 2091-2093 (2015).
- Peri-Naor, R., Ilani, T., Motiei, L., Margulies, D. Protein-Protein Communication and Enzyme Activation Mediated by a Synthetic Chemical Transducer. J. Am. Chem. Soc. 137, 9507-9510 (2015).
- Corson, T. W., Aberle, N., Crews, C. M. Design and Applications of Bifunctional Small Molecules: Why Two Heads Are Better Than One. ACS Chem. Biol. 3, 677-692 (2008).
- Rutkowska, A., Schultz, C. Protein Tango: The Toolbox to Capture Interacting Partners. Angew. Chem. Int. Ed. 51, 8166-8176 (2012).
- Meyer, C., Köhn, M. A Molecular Tête-à-Tête Arranged by a Designed Adaptor Protein. Angew. Chem. Int. Ed. 51, 8160-8162 (2012).
- Klemm, J. D., Schreiber, S. L., Crabtree, G. R. Dimerization as a Regulatory Mechanism in Signal Transduction. Annu. Rev. Immunol. 16, 569-592 (1998).
- DeRose, R., Miyamoto, T., Inoue, T. Manipulating signaling at will: chemically-inducible dimerization (CID) techniques resolve problems in cell biology. Pflugers Arch. 465, 409-417 (2013).
- Gestwicki, J. E., Marinec, P. S. Chemical control over protein-protein interactions: beyond inhibitors. Comb. Chem. High Throughput. Screen. 10, 667-675 (2007).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. 25, 848-862 (2013).
- Diezmann, F., Seitz, O. DNA-guided display of proteins and protein ligands for the interrogation of biology. Chem. Soc. Rev. 40, 5789-5801 (2011).
- Röglin, L., Ahmadian, M. R., Seitz, O. DNA-Controlled Reversible Switching of Peptide Conformation and Bioactivity. Angew. Chem. Int. Ed. 46, 2704-2707 (2007).
- Röglin, L., Altenbrunn, F., Seitz, O. DNA and RNA-Controlled Switching of Protein Kinase Activity. ChemBioChem. 10, 758-765 (2009).
- Harris, D. C., Chu, X., Jayawickramarajah, J. DNA-Small Molecule Chimera with Responsive Protein-Binding Ability. J. Am. Chem. Soc. 130, 14950-14951 (2008).
- Harris, D. C., Saks, B. R., Jayawickramarajah, J. Protein-Binding Molecular Switches via Host-Guest Stabilized DNA Hairpins. J. Am. Chem. Soc. 133, 7676-7679 (2011).
- Kim, Y., Cao, Z., Tan, W. Molecular assembly for high-performance bivalent nucleic acid inhibitor. Proc. Nat. Acad. Sci. U.S.A. 105, 5664-5669 (2008).
- Han, D., et al. A Logical Molecular Circuit for Programmable and Autonomous Regulation of Protein Activity Using DNA Aptamer-Protein Interactions. J. Am. Chem. Soc. 134, 20797-20804 (2012).
- Motiei, L., Pode, Z., Koganitsky, A., Margulies, D. Targeted Protein Surface Sensors as a Tool for Analyzing Small Populations of Proteins in Biological Mixtures. Angew. Chem. Int. Ed. 53, 9289-9293 (2014).
- Ranallo, S., Rossetti, M., Plaxco, K. W., Vallée-Bélisle, A., Ricci, F. A Modular, DNA-Based Beacon for Single-Step Fluorescence Detection of Antibodies and Other Proteins. Angew. Chem. Int. Ed. 54, 13214-13218 (2015).
- Franzini, R. M., et al. Identification of Structure-Activity Relationships from Screening a Structurally Compact DNA-Encoded Chemical Library. Angew. Chem. Int. Ed. 54, 3927-3931 (2015).
- Unger-Angel, L., et al. Protein recognition by bivalent, ‘turn-on’ fluorescent molecular probes. Chem. Sci. 6, 5419-5425 (2015).
- Nissinkorn, Y., et al. Sensing Protein Surfaces with Targeted Fluorescent Receptors. Chem. Eur. J. 21, 15981-15987 (2015).
- Huber, C. G., Oefner, P. J., Bonn, G. K. High-Resolution Liquid Chromatography of Oligonucleotides on Nonporous Alkylated Styrene-Divinylbenzene Copolymers. Anal. Biochem. 212, 351-358 (1993).
- Lyon, R. P., Hill, J. J., Atkins, W. M. Novel class of bivalent glutathione S-transferase inhibitors. Biochemistry. 42, 10418-10428 (2003).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. , 1-16 (2013).

