التسامي DAN مصفوفة للكشف والتخيل من Gangliosides في الجرذ أنسجة المخ لMALDI التصوير قياس الطيف الكتلي
Summary
A protocol for the sublimation of DAN matrix onto rat brain tissue for the detection of gangliosides using MALDI Imaging Mass Spectrometry is presented.
Abstract
إعداد العينات هو المفتاح للكشف عن الأمثل والتصور من التحاليل في الليزر الامتزاز / التأين (MALDI) التصوير الطيف الكتلي (IMS) التجارب بمساعدة مصفوفة. يمكن تحديد البروتوكول المناسب لمتابعة جميع مراحل عملية إعداد العينات من الصعب كما يجب أن يكون الأمثل كل خطوة ليتوافق مع خصائص فريدة من التحاليل من الفائدة. وتنطوي هذه العملية ليس فقط إيجاد مصفوفة متوافقة يمكن أن يلتفظ وتأيين جزيئات ذات الاهتمام بكفاءة، ولكن أيضا اختيار تقنية المصفوفة ترسب المناسبة. على سبيل المثال، وهي تقنية المصفوفة ترسب الرطب، الذي ينطوي على حل مصفوفة في المذيبات، هو الافضل لالامتزاز من معظم البروتينات والببتيدات، في حين أن تقنيات المصفوفة ترسب الجافة فعالة بشكل خاص للتأين من الدهون. تم الإبلاغ عن التسامي كوسيلة فعالة للغاية من ترسب مصفوفة الجاف للكشف عن نسبة الدهون في الأنسجة عن طريق MALDI IMS بسبب homogeneiتي واي لترسب مصفوفة الكريستال والحد الأدنى من عدم تمركز تحليلها بالمقارنة مع العديد من الأساليب ترسب الرطب 1 و 2. على نطاق واسع، فإنه ينطوي على وضع عينة ومصفوفة مسحوق في غرفة مختومة فراغ مع العينات الضغط على سطح بارد. ثم يتم إنزال الجهاز في حمام ساخن (الرمل أو النفط)، مما أدى إلى التسامي مصفوفة مسحوق على سطح عينة الأنسجة تبريده. نحن هنا وصف بروتوكول التسامي باستخدام 1،5-diaminonaphthalene (DAN) مصفوفة للكشف وتصور gangliosides في الدماغ الفئران باستخدام MALDI IMS.
Introduction
مصفوفة بمساعدة الليزر الامتزاز / التأين (MALDI) التصوير الطيف الكتلي (IMS) أصبحت سعى للغاية بعد تقنية لرؤية التوزيع المكاني للدهون، والببتيدات والبروتينات عبر السطوح عينة سليمة. MALDI IMS كان يعرف سابقا باسم تقنية تحليلية لالتحاليل تنقيته قبل، ولكن في السنوات الأخيرة، فقد كان لافتا الانتباه في العديد من التخصصات الأخرى بسبب القدرة على الجمع بين دقة قياس الطيف الكتلي مع ارتفاع القرار نقاط مرجعية التشريحية / البصرية دون تحتاج لأي وضع العلامات الخارجي. مع استمرار تجمع علمي من الباحثين الاستفادة من هذه التقنية في النمو، وهناك زيادة الحاجة إلى بروتوكولات سهلة لمتابعة موحدة للمساعدة في تطوير وتعظيم الاستفادة من التجارب IMS. Gangliosides، مجموعة من الدهون غشاء فيرة للغاية في النظام العصبي المركزي، وتعتبر مثالية لإجراء التجارب MALDI IMS كما مواقعها، وجزءا لا يتجزأ من داخل الغشاء، يجعل SPECI معينوفاق المستحيل للكشف عن استخدام التقليدية المناعي وضع العلامات. بالإضافة إلى ذلك، لقد أظهرنا، وذلك باستخدام MALDI IMS، أن هذه الدهون، التي تعمل كما جهري من الإشارات الخلوية، من بين أمور أخرى، لديها أنماط التوزيع التشريحي فريدة من نوعها في الدماغ القوارض الصحي التي يتم تعديلها بعد إصابات الدماغ 3، 4، 5. تقع Gangliosides في مجموعة والشامل أعلى بالمقارنة مع معظم أنواع الدهون، وبالتالي فهي أكثر ملاءمة لمنصة MALDI التصوير.
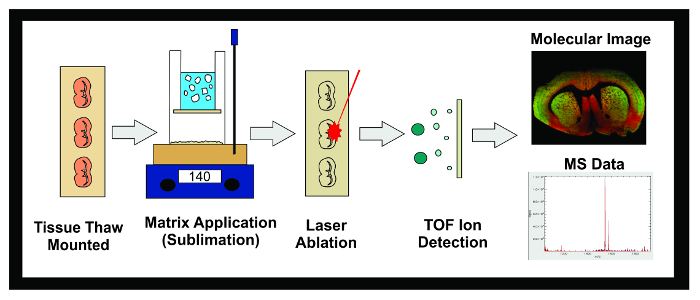
الشكل 1: سير العمل من MALDI IMS تجربة. الرسم البياني لسير العمل العام من تجربة MALDI IMS باستخدام التسامي. هو مقطوع الأنسجة المجمدة في -80 درجة مئوية في ناظم البرد و 10 ميكرومتر أقسام هي التي شنت ذوبان الجليد على الشرائح ايتو موصل. ثم يتم وضع الشريحة في مجفف حتى التسامي. سليتندس دي في جهاز التسامي ويتم تطبيق طبقة حتى من مصفوفة على سطح عينة الأنسجة. يتم تجميد عينات بين عشية وضحاها في الثلاجة -20 درجة مئوية ثم توضع في مجفف لمدة 10 دقيقة. مرة واحدة وقد تم تطبيق المعايير، يتم إدراج العينات في الصك MALDI حيث يتم توجيه الليزر عبر الأنسجة مما تسبب جزيئات المستوعبة في مصفوفة لتأيين. السفر الأيونات أسفل أنبوب الطيران ومنفصلة على أساس كتلتها (الوقت من الطيران / TOF) حتى وصولها إلى كاشف. يتم عرض المعلومات على وفرة الأيونية في التحاليل ضمن الكتلة للتهمة (م / ض) مجموعة محددة سلفا على حد سواء صورة الجزيئية والطيف الشامل. ويمكن استخدام هذه البيانات لكلا تصور وقياس وفرة الأيونية الحليلة المصالح داخل الأنسجة المصورة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
إعداد عينةلMALDI IMS غير متغيرة بصورة كبيرة حيث أن كل خطوة من خطوات العملية يجب أن تكون مخصصة للالتحاليل من الفائدة. والسمة المميزة لتجاربه التي تستند MALDI-هو استخدام طلاء مصفوفة المتوضعة على سطح العينة قبل التحليل. بالإضافة إلى دور امتصاص ونقل الطاقة من الإشعاع من الليزر أثناء عملية الاجتثاث، مصفوفة يخدم أيضا لعزل التحاليل المختلفة من العينة، مما يسهل تحليل المركبات من الفائدة 6 و 7. تطبيق متجانس من مصفوفة لسطح العينة هي الخطوة الأكثر أهمية في عملية إعداد العينات. غير لائق مصفوفة ترسب يمكن أن يؤدي إلى كبيرة تشكيلات غير متجانسة مصفوفة الكريستال وتطوير الأعمال الفنية، وانخفاض ايون إشارة، وضعف استنساخ 7.
نظرا لتقارب بعض المصفوفات لعزل التحاليل محددة، ونوع من مصفوفة اختيار لتجربة يمكنتغيير كبير في النتيجة. المصفوفات المستخدمة في التصوير من البروتينات والببتيدات غالبا ما تختلف عن تلك المستخدمة لنسبة الدهون في التصوير وعملية تعقيدا بسبب الحاجة إلى إجراءات إضافية مثل الغسيل والإماهة الخطوات من أجل الكشف عن إشارات بنجاح من الأنسجة. على الرغم من وجود غسل خطوات لتعزيز الإشارات الدهون 8، فهي ليست شرطا مسبقا للكشف عن معظم أنواع الدهون. عند اختيار مصفوفة لتجربة الدهون التصوير، فمن المهم النظر في قطبية الدهون من الاهتمام حيث سيؤدي ذلك إلى تضييق نطاق المصفوفات مناسبة. على سبيل المثال، gangliosides تحتوي على بقايا حمض اللعابي الذي منحهم الاستقطاب السلبي العام. وهناك عدد من المصفوفات التي يمكن أن يلتفظ بفعالية وتأيين gangliosides من الأنسجة. ومع ذلك، هناك عوامل مثل قمم المشتقة من مصفوفة في الطيف والاستقرار في المصفوفة تحت فراغ يجب أن تؤخذ قيد النظر. 1،5-diaminonapthalene (DAN) مصفوفة مستقرة بما فيه الكفاية في ظل ظروف أداة فراغ بالنسبة لغالبية تطبيقات التصوير وأظهرت درجة عالية من الحساسية لالامتزاز الدهون، ويمكن استخدامها لتحليل الدهون في كل من وسائط أيون الإيجابية والسلبية 2. DAN مصفوفة، بالمقارنة مع غيرها من المصفوفات السلبي الدهون تقارب مثل حمض dihydroxybenzoic (DHB)، 9-aminoacridine (9-AA)، و5-كلورو-2-mercaptobenzothiazole (CMBT)، وكان قادرا على يلتفظ gangliosides من دماغ الفئران أكثر كفاءة الأنسجة في وضع الأيونات السالبة (مخطوطة قيد الإعداد).
اختيار الطريقة الملائمة لترسب مصفوفة غير ذات أهمية متساوية للاختيار المصفوفة نفسها. طرق مصفوفة ترسب الرطب حيث يذوب المصفوفة الصلبة في المذيبات العضوية، وأودعت التي تعمل بالهواء المضغوط أو آليا الرشاشات أو راصدي، هي فعالة بشكل خاص لالامتزاز من البروتينات والببتيدات كسائل يتخلل العينة للسماح للخارجction من المركبات وشارك في بلورة مع المصفوفة. على الرغم من أن هذه التقنيات يمكن أن تستخدم أيضا لتطبيقات الدهون، عدم التمركز تحليلها ومصفوفة متفاوتة تشكيلات الكريستال والحدوث بسبب وفرة عالية وقابلية ذوبان الدهون في المذيبات، وخاصة في الأنسجة 2 و 9. لأن الدهون هي المتأينة بسهولة من الأنسجة الجافة التقنيات ترسب مصفوفة مثل التسامي، وتقديم بسيط، والتكلفة بديل فعال للرشاشات في حين التحايل على العديد من العيب من هذه التقنيات. ويعزى نجاح التسامي في التجارب MALDI IMS إلى ميزات مثل التشكل الجريزوفولفين المصفوفة مما يزيد من مساحة السطح لمصفوفة الحليلة ملزمة، وزيادة نقاء مصفوفة، ومتجانسة ترسب مصفوفة مما يؤدي إلى زيادة استنساخ مقارنة مع تقنيات المصفوفة الرطب 1 و 10.
التسامي invoالتلاميذ تسخين مصفوفة مسحوق تحت فراغ تحت سطح العينة تبريد مما أدى إلى الحالة الصلبة إلى غاز مرحلة الانتقال من مصفوفة مسحوق تليها ترسب على سطح عينات الأنسجة على الفور. خلال التسامي، ويمكن التحكم ترسب مصفوفة بعوامل مختلفة مثل الساعة ودرجة الحرارة والضغط لتقديم نتائج استنساخه للغاية. تجربة التسامي واحدة يمكن أن تتخذ في أي مكان 5-20 دقيقة اعتمادا على نوع من مصفوفة محددة، والتي يمكن إعادة استخدامها عدة مرات قبل التخلص منها. جهاز يمكن شراؤها تجاريا في جزء صغير من سعر الرشاشات الآلية ويسهل تفكيكها للتنظيف والصيانة. منخفضة التكلفة والبساطة النسبية لهذه التقنية ترسب مصفوفة تجعله مثاليا للباحثين بداية أو التوسع فيها تطبيقات الدهون التصوير في MALDI IMS. على الرغم من أن المعلومات بالتفصيل بروتوكولات للتسامي من الأنسجة لIMS تم الإبلاغ عن 11، وعدد قليل بروتوكولات موحدة توجد ثهيك التركيز على العمل الأساسية المعنية مع إجراء تجربة التسامي لتصوير الدهون كتلة عالية في وضع الأيونات السالبة، مما يجعل من الصعب تحديد الأسلوب دون محاكمة واسعة والخطأ. ما يلي هو بروتوكول تجريبي يهدف إلى سد هذه الفجوة من أجل التسامي DAN مصفوفة على أقسام دماغ الفئران للتصوير عالية الدقة والكشف عن gangliosides.
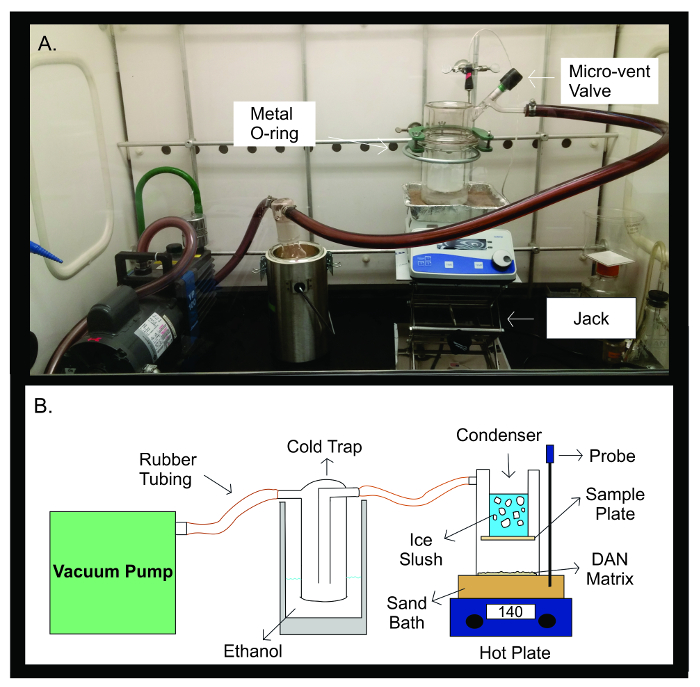
الشكل 2: التسامي جهاز. صورة (A) والرسم التخطيطي (ب) من جهاز التسامي. توصيل مضخة الفراغ أنابيب المطاط إلى فخ بارد مليئة 300 مل من الايثانول. فخ البارد ثم يتم توصيلها عن طريق أنابيب المطاط إلى جهاز التسامي. يتكون الجهاز يتكون من قطعتين منفصلتين من الأواني الزجاجية التي مختومة مع المعدن U-المفصل. النصف العلوي من sublimatorيحتوي المكثف وهي مليئة طين الجليد. وسجلت لوحة العينة على الجزء السفلي من المكثف، داخل جهاز والزجاج مغلق. يحتوي على النصف السفلي من جهاز التسامي مصفوفة DAN، انتشرت التي تواجه بالتساوي لوحة عينة. خلال التسامي، يتم وضع جهاز والزجاج على حمام الرمل تسخينه إلى 140 درجة مئوية بحلول طبق ساخن أسفله مباشرة. مسبار درجة الحرارة يساعد على الحفاظ على درجة حرارة ثابتة طوال التجربة التسامي من خلال ردود الفعل لدرجة حرارة حمام الرمل بالمقارنة مع درجة الحرارة مسبقا للتجربة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
تفاصيل هذا العمل بروتوكول موحد من التسامي مصفوفة على الأنسجة للكشف عن الدهون سالبة الشحنة، مثل gangliosides، في التجارب MALDI IMS. إعداد نموذج لMALDI IMS متغير بدرجة كبيرة، ويجب أن تكون مخصصة لتتناسب مع خصائص فريدة من نوعها لتحليلها من الفائدة. تطبيق مصفوفة على سطح عينة الأنسجة هو…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge the technical assistance of Kristina Jurcic in the University of Western Ontario MALDI MS facility, as well as the National Sciences and Engineering Council (NSERC) for funding this work. The authors would also like to acknowledge the Caprioli group (Vanderbilt University, TN) and Chaurand group (Université de Montreal, QC) for their advice in optimizing the sublimation technique presented in this manuscript.
Materials
| Sublimator | Chemglass Life Sciences | CG3038-01 | |
| 1,5- Diaminonapthalene (DAN) matrix | Sigma-Aldrich | D21200 | 100 G |
| Cryostat | Thermo-Fisher Scientific | CryoStar NX50 | |
| Hot plate with temperature feedback | Thermo-Fisher Scientific | HP88857290 | Isotemp ADVD 7×7 HP 100-120v |
| Stainless Steel Jack | Thermo-Fisher Scientific | 2216479 | 10×10 |
| Cold Trap | Custom built on site | ||
| Vacuum Pump | Franklin Electric | 1102180403 | Savant VP100 Two Stage |
| Indium-tin-oxide (ITO) Slides | Hudson Surface Technology | PSI 1111000 | type II, 1.1mm/25 each |
| MALDI TOF/TOF 5800 Instrument | AB Sciex | ||
| Desiccator | Sigma-Aldrich | D2797 | tabletop desiccator |
References
- Hankin, J. A., Barkley, R. M., Murphy, R. C. Sublimation as a method of matrix application for mass spectrometric imaging. J. Am. Soc. Mass Spectrom. 18, 1646-1652 (2007).
- Thomas, A., Charbonneau, J. L., Fournaise, E., Chaurand, P. Sublimation of new matrix candidates for high spatial resolution imaging mass spectrometry of lipids: enhanced information in both positive and negative polarities after 1,5-diaminonapthalene deposition. Anal. Chem. 84, 2048-2054 (2012).
- Caughlin, S., et al. Increased Expression of Simple Ganglioside Species GM2 and GM3 Detected by MALDI Imaging Mass Spectrometry in a Combined Rat Model of Aβ Toxicity and Stroke. PLoS ONE. 10, 0130364 (2015).
- Weishaupt, N., Caughlin, S., Yeung, K., Whitehead, S. Differential Anatomical Expression of Ganglioside GM1 Species Containing d18:1 or d20:1 Sphingosine Detected by MALDI Imaging Mass Spectrometry in Mature Rat Brain. Front Neuroanatomy. 9 (155), (2015).
- Whitehead, S., et al. Imaging Mass Spectrometry Detection of Gangliosides Species in the Mouse Brain following Transient Focal Cerebral Ischemia and Long-Term Recovery. PLoS ONE. 6 (6), 20808 (2011).
- Fuchs, B., Süß, R., Schiller, J. An update of MALDI-TOF mass spectrometry in lipid research. Progress in Lipid Research. 49, 450-475 (2010).
- Barceló-Coblijn, G., Fernández, J. A. Mass spectrometry coupled to imaging techniques: the better the view the greater the challenge. Front Physiol. 6 (3), 1-5 (2015).
- Angel, P. M., Spraggins, J. M., Baldwin, H. S., Caprioli, R. Enhanced sensitivity for high spatial resolution lipid analysis by negative ion mode matrix assisted laser desorption ionization imaging mass spectrometry. Anal. Chem. 84, 1557-1564 (2012).
- Murphy, R. C., Hankin, J. A., Barkley, R. M., Zemski Berry, K. A. MALDI imaging of lipids after matrix sublimation/deposition. Biochim. Biophys. Acta. 1811, 970-975 (2011).
- Jaskolla, T. W., Karas, M., Roth, U., Steinert, K. Comparison between vacuum sublimed matrices and conventional dried droplet preparation in MALDI-TOF mass spectrometry. J. Am. Soc. Mass Spectrom. 20, 1104-1115 (2009).
- O’Rourke, M. B., Raymond, B. B., Djordjevic, S. P., Padula, M. P. A versatile cost-effective method for the analysis of fresh frozen tissue sections via matrix-assisted laser desorption/ionisation imaging mass spectrometry. Rapid Commun. Mass Spectrom. 29, 637-644 (2015).
- Patterson, N. H., Thomas, A., Chaurand, P. Monitoring time-dependent degradation of phospholipids in sectioned tissues by MALDI imaging mass spectrometry. J Mass Spectrom. 49, 622-627 (2014).
- Cheng, H., Sun, G., Yang, K., Gross, R. W., Han, X. Selective desorption/ionization of sulfatides by MALDI-MS facilitated using 9-aminoacridine as matrix. J. Lipid Res. 51, 1599-1609 (2010).
- Puolitaival, S. M., Burnum, K. E., Cornett, D. S., Caprioli, R. M. Solvent-free matrix dry-coating for MALDI imaging of phospholipids. J. Am. Soc. Mass Spectrom. 19, 882-886 (2008).
- Chaurand, P., Cornett, D., Angel, P., Caprioli, R. From Whole-body Sections Down to Cellular Level, Multiscale Imaging of Phospholipids by MALDI Mass Spectrometry. Mol Cell Proteomics. 10, (2011).
- Grove, K. J., Frappier, S. L., Caprioli, R. M. Matrix pre-coated MALDI MS targets for small molecule imaging in tissues. J. Am. Soc. Mass Spectrom. 22, 192-195 (2011).
- Yang, J., Caprioli, R. M. Matrix precoated targets for direct lipid analysis and imaging of tissue. Anal. Chem. 85, 2907-2912 (2013).
- Gemperline, E., Rawson, S., Li, L. Optimization and comparison of multiple MALDI matrix application methods for small molecule mass spectrometric imaging. Anal. Chem. 86, 10030-10035 (2014).

