DAN矩阵升华为神经节苷脂对大鼠脑组织的检测和可视化MALDI成像质谱
Summary
A protocol for the sublimation of DAN matrix onto rat brain tissue for the detection of gangliosides using MALDI Imaging Mass Spectrometry is presented.
Abstract
样品制备为最佳检测和基质辅助激光解吸/电离(MALDI)成像质谱(IMS)的实验分析物的可视键。确定适当的协议遵循整个试样制备过程中可能是困难的,因为每个步骤必须进行优化以符合与所关注分析物的独特的特点。这一过程不仅涉及发现能解吸和有效地电离感兴趣的分子相容的基质,而且选择合适的基质沉积技术。例如,一个湿基质沉积技术,这需要在溶剂中的基体溶解,优于大多数蛋白质和肽的解吸,而干燥基质沉积技术对于脂质的电离特别有效。升华已被报告为干燥基质沉积用于检测通过MALDI IMS在组织脂类的一种高效的方法,因为该homogenei相比于许多湿沉降方法1,2基质晶体沉积和最小的离域分析的TY。广泛地说,它包括将一个样品和粉状基质与按压冷的表面的采样的真空密封室中。然后该装置被降低到加热浴(砂或油),结果在粉状基质的升华到冷却组织样品表面。在这里,我们描述了使用1,5-二氨基萘(DAN)矩阵为使用MALDI IMS在大鼠脑神经节苷脂的检测和可视化升华协议。
Introduction
基质辅助激光解吸/电离(MALDI)成像质谱(IMS)正在成为一种高度寻求技术为脂质,肽和蛋白质穿过完好样品表面的空间分布的可视化之后。 MALDI IMS的以前被称为预纯化的分析物的分析技术,但在最近几年中,已经在因为具有高分辨率视觉/解剖参考点,而质谱的精确度结合的能力许多其他学科提请注意需要任何外部标记。作为利用这种技术的研究的科学池继续增长,所需要增加的标准化,易于后续的协议,以协助IMS实验开发和优化。神经节苷脂,一组膜脂质在中枢神经系统高度丰富的,是理想的MALDI IMS实验作为它们的位置,嵌入在膜中,使某些特定上课不可能使用常规的免疫标记以检测。此外,我们已经表明,使用MALDI IMS中,这些脂质,其充当细胞信号的调节剂,除其他事项外,有在被脑损伤3,4,5后改变了健康啮齿动物脑独特的解剖分布模式。神经节苷脂位于较高质量范围相比,大多数脂质种类,并因此最适合于MALDI成像平台。
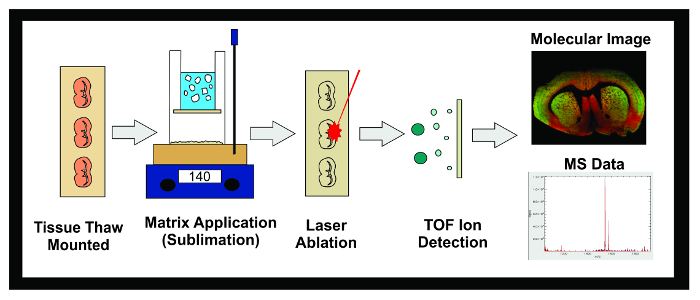
图1:MALDI IMS实验的工作流程。使用升华在MALDI IMS实验的一般流程的图。组织在-80℃冷冻于低温恒温器被分段和10微米的部分是安装在导电的ITO载玻片解冻。然后将载玻片置于干燥器直到升华。 SLIDES插入升华装置和偶数层矩阵施加到组织样本表面。样品在-20℃冷冻然后置于干燥器中10分钟,冷冻过夜。一旦标准被应用,将样品插入到其中激光跨越引起解吸分子在基质中以电离所述组织指示MALDI仪器。离子行进向下根据它们的质量(时间飞行/ TOF)直到它们到达了检测器的飞行管和分离。上一个预定的质量 – 电荷(M / Z)范围内的离子丰度分析物的信息显示为两个分子图像和质谱。这个数据可以用来既可视化和量化的成像组织内感兴趣的分析物的离子丰度。 请点击此处查看该图的放大版本。
样品制备用于MALDI IMS是高度可变的过程的每个步骤必须进行定制,以所关注的分析物。基于MALDI-实验限定特征是使用沉积到分析前的样品表面上的基质的涂层。除了吸收和在消融过程中从激光转印辐射能量的作用,该基质也用于各种分析物从样品中分离,从而有利于感兴趣6,7化合物的分析。基质样品表面的均匀的应用是在样品制备过程中最关键的步骤。不正确的基质沉积可导致大量异构基质晶体形态和文物的发展,低离子信号,重复性差7。
由于某些矩阵的亲和力来分离特定的分析物,被选择用于实验矩阵的类型可以显著改变的结果。用于蛋白质和肽的成像矩阵常常不同于用于成像脂质不同,此过程是通过需要额外的方法,如为了从组织成功地检测信号的洗涤和再水合步骤进一步复杂化。虽然脂质信号8的增强存在洗涤步骤,它们不是用于检测最脂质种类的一个先决条件。当选择的脂成像实验的矩阵,它考虑的兴趣,因为这脂质的极性将缩小合适矩阵的范围是重要的。例如,神经节苷脂含有唾液酸残基这给他们一个整体的负极性。有许多的矩阵,可以有效地解吸和电离来自组织神经节苷脂;然而,因素,如在频谱并在真空下基质的稳定性基质衍生的峰必须在考虑服用。 1,5-diaminonapthalene(DAN)矩阵是仪器的真空条件对于大多数成像应用下足够稳定,并表现出高度的脂质解吸灵敏度和可用于在正和负离子模式2脂质的分析。 DAN基质,相对于其他负脂质亲和基质如二羟基苯甲酸(DHB),9-氨基吖啶(9-AA)和5-氯-2-巯基苯并(CMBT)时,能够最有效地解吸从大鼠脑神经节苷脂组织在负离子模式(手稿准备中)。
选择基质沉积的适当的方法是同等重要选择矩阵本身。湿基质沉积方法,其中所述固体基质溶解在有机溶剂中,并通过气动沉积或自动喷雾器或检举,作为液体渗透的样品,以允许额外的用于蛋白质和肽的解吸特别有效化合物和共结晶与基质的ction。尽管这些技术也可用于脂质应用,分析物离域和不均匀的基质晶体地层是屡见不鲜由于脂质的在溶剂中的高丰度和溶解度,特别是在组织2,9。因为脂质易于从组织电离,干燥基质沉积技术,如升华,提供一种简单的,成本效益的替代喷雾器而绕过许多这些技术的缺点的。升华的MALDI IMS实验的成功归功于功能,如微晶矩阵的形态这增加了矩阵分析物结合的表面面积,增加基质纯度和均匀的基质的沉积,从而增加可重复性比较潮湿的矩阵技术1,10。
升华invoLVES正下方产生的固体,粉状基质随后沉积在组织样品表面的气相过渡冷却的样品表面加热真空下粉状基质。期间升华,基质沉积可通过改变因素例如时间,温度和压力,以提供高度可重复的结果来控制。单个升华试验可以在任何地方需要5至20分钟取决于矩阵的选择的类型,处理前可重复使用数次。该装置可商购于自动喷雾器的价格的几分之一处购买,并且很容易被拆开进行清洁和维护。成本低,这种基质沉积技术相对简单使其非常适用于开始后,或MALDI IMS脂质成像应用拓展的研究人员。虽然详细说明了组织对IMS的升华协议的信息已报告11,少数标准化协议存在W¯¯HICH重点涉及进行升华实验在负离子模式成像高质量脂质,使得难以建立的技术中没有广泛的试验和错误的基本工作流程。下面是一个试验性协议旨在填补DAN矩阵的升华到大鼠脑切片用于高分辨率成像和神经节苷脂的检测该间隙。
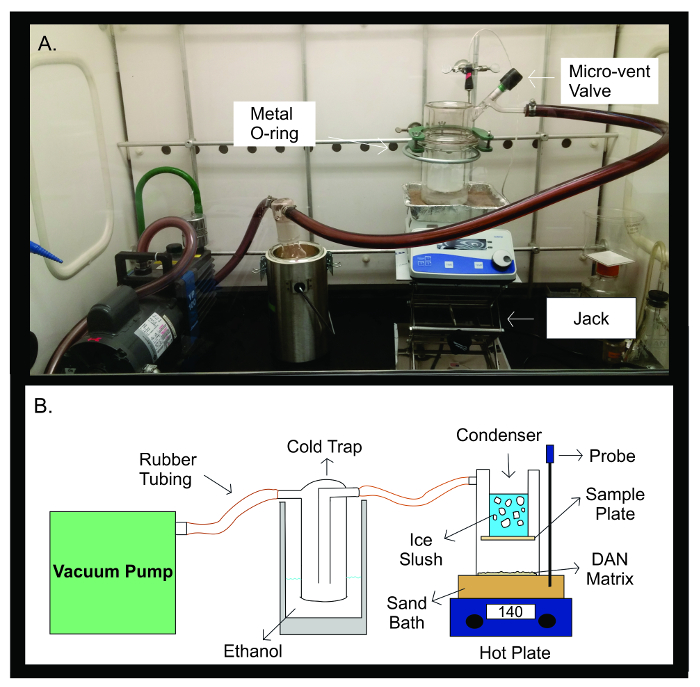
图2:升华设备。照片(A)和升华装置的示意图( 二 )。真空泵由橡胶管连接到冷阱充满300毫升乙醇。冷阱,然后由橡胶管的升华装置相连。该装置是由两个独立的玻璃器皿的件所用的金属U形接头密封在一起。升华器的上半部分包含填充有冰凌冷凝器。该样品板贴到所述冷凝器的底部,所述密封的玻璃装置内。升华设备的下半部分包含DAN矩阵,摊开均匀面临的样板。期间升华,玻璃装置被放置在砂浴中加热至140℃用热板正下方。温度探头有助于维持整个升华试验通过沙浴温度的反馈相比为实验的预设温度稳定的温度。 请点击此处查看该图的放大版本。
Protocol
Representative Results
Discussion
这项工作细节矩阵升华对组织的标准化协议,用于检测带负电荷的脂类,如神经节苷脂,在MALDI IMS实验。用于MALDI IMS的样品制备是高度可变的,并且必须被定制,以适应所关注分析物的独特性能。矩阵的上组织样品表面上的应用程序是在样品制备过程的与问候结果在IMS中的质量的一个关键方面。应特别注意选择矩阵时,确保该矩阵是与所关注的分析物相容并且是自由的频谱矩阵衍生工件作出。升?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge the technical assistance of Kristina Jurcic in the University of Western Ontario MALDI MS facility, as well as the National Sciences and Engineering Council (NSERC) for funding this work. The authors would also like to acknowledge the Caprioli group (Vanderbilt University, TN) and Chaurand group (Université de Montreal, QC) for their advice in optimizing the sublimation technique presented in this manuscript.
Materials
| Sublimator | Chemglass Life Sciences | CG3038-01 | |
| 1,5- Diaminonapthalene (DAN) matrix | Sigma-Aldrich | D21200 | 100 G |
| Cryostat | Thermo-Fisher Scientific | CryoStar NX50 | |
| Hot plate with temperature feedback | Thermo-Fisher Scientific | HP88857290 | Isotemp ADVD 7×7 HP 100-120v |
| Stainless Steel Jack | Thermo-Fisher Scientific | 2216479 | 10×10 |
| Cold Trap | Custom built on site | ||
| Vacuum Pump | Franklin Electric | 1102180403 | Savant VP100 Two Stage |
| Indium-tin-oxide (ITO) Slides | Hudson Surface Technology | PSI 1111000 | type II, 1.1mm/25 each |
| MALDI TOF/TOF 5800 Instrument | AB Sciex | ||
| Desiccator | Sigma-Aldrich | D2797 | tabletop desiccator |
References
- Hankin, J. A., Barkley, R. M., Murphy, R. C. Sublimation as a method of matrix application for mass spectrometric imaging. J. Am. Soc. Mass Spectrom. 18, 1646-1652 (2007).
- Thomas, A., Charbonneau, J. L., Fournaise, E., Chaurand, P. Sublimation of new matrix candidates for high spatial resolution imaging mass spectrometry of lipids: enhanced information in both positive and negative polarities after 1,5-diaminonapthalene deposition. Anal. Chem. 84, 2048-2054 (2012).
- Caughlin, S., et al. Increased Expression of Simple Ganglioside Species GM2 and GM3 Detected by MALDI Imaging Mass Spectrometry in a Combined Rat Model of Aβ Toxicity and Stroke. PLoS ONE. 10, 0130364 (2015).
- Weishaupt, N., Caughlin, S., Yeung, K., Whitehead, S. Differential Anatomical Expression of Ganglioside GM1 Species Containing d18:1 or d20:1 Sphingosine Detected by MALDI Imaging Mass Spectrometry in Mature Rat Brain. Front Neuroanatomy. 9 (155), (2015).
- Whitehead, S., et al. Imaging Mass Spectrometry Detection of Gangliosides Species in the Mouse Brain following Transient Focal Cerebral Ischemia and Long-Term Recovery. PLoS ONE. 6 (6), 20808 (2011).
- Fuchs, B., Süß, R., Schiller, J. An update of MALDI-TOF mass spectrometry in lipid research. Progress in Lipid Research. 49, 450-475 (2010).
- Barceló-Coblijn, G., Fernández, J. A. Mass spectrometry coupled to imaging techniques: the better the view the greater the challenge. Front Physiol. 6 (3), 1-5 (2015).
- Angel, P. M., Spraggins, J. M., Baldwin, H. S., Caprioli, R. Enhanced sensitivity for high spatial resolution lipid analysis by negative ion mode matrix assisted laser desorption ionization imaging mass spectrometry. Anal. Chem. 84, 1557-1564 (2012).
- Murphy, R. C., Hankin, J. A., Barkley, R. M., Zemski Berry, K. A. MALDI imaging of lipids after matrix sublimation/deposition. Biochim. Biophys. Acta. 1811, 970-975 (2011).
- Jaskolla, T. W., Karas, M., Roth, U., Steinert, K. Comparison between vacuum sublimed matrices and conventional dried droplet preparation in MALDI-TOF mass spectrometry. J. Am. Soc. Mass Spectrom. 20, 1104-1115 (2009).
- O’Rourke, M. B., Raymond, B. B., Djordjevic, S. P., Padula, M. P. A versatile cost-effective method for the analysis of fresh frozen tissue sections via matrix-assisted laser desorption/ionisation imaging mass spectrometry. Rapid Commun. Mass Spectrom. 29, 637-644 (2015).
- Patterson, N. H., Thomas, A., Chaurand, P. Monitoring time-dependent degradation of phospholipids in sectioned tissues by MALDI imaging mass spectrometry. J Mass Spectrom. 49, 622-627 (2014).
- Cheng, H., Sun, G., Yang, K., Gross, R. W., Han, X. Selective desorption/ionization of sulfatides by MALDI-MS facilitated using 9-aminoacridine as matrix. J. Lipid Res. 51, 1599-1609 (2010).
- Puolitaival, S. M., Burnum, K. E., Cornett, D. S., Caprioli, R. M. Solvent-free matrix dry-coating for MALDI imaging of phospholipids. J. Am. Soc. Mass Spectrom. 19, 882-886 (2008).
- Chaurand, P., Cornett, D., Angel, P., Caprioli, R. From Whole-body Sections Down to Cellular Level, Multiscale Imaging of Phospholipids by MALDI Mass Spectrometry. Mol Cell Proteomics. 10, (2011).
- Grove, K. J., Frappier, S. L., Caprioli, R. M. Matrix pre-coated MALDI MS targets for small molecule imaging in tissues. J. Am. Soc. Mass Spectrom. 22, 192-195 (2011).
- Yang, J., Caprioli, R. M. Matrix precoated targets for direct lipid analysis and imaging of tissue. Anal. Chem. 85, 2907-2912 (2013).
- Gemperline, E., Rawson, S., Li, L. Optimization and comparison of multiple MALDI matrix application methods for small molecule mass spectrometric imaging. Anal. Chem. 86, 10030-10035 (2014).

