Sublimazione di DAN Matrix per la rilevazione e visualizzazione dei gangliosidi nel cervello di ratto Tissue per MALDI Imaging Mass Spectrometry
Summary
A protocol for the sublimation of DAN matrix onto rat brain tissue for the detection of gangliosides using MALDI Imaging Mass Spectrometry is presented.
Abstract
La preparazione del campione è la chiave per la rilevazione ottimale e la visualizzazione di analiti a laser desorbimento / ionizzazione (MALDI) Imaging Mass Spectrometry (IMS) esperimenti di Matrix-assistita. Determinare il protocollo appropriato per seguire tutto il processo di preparazione del campione può essere difficile in quanto ogni passo deve essere ottimizzato per rispettare le caratteristiche uniche di analiti di interesse. Questo processo implica non solo trovare una matrice compatibile che può desorbire e ionizza le molecole di interesse in modo efficiente, ma anche selezionando la tecnica di deposizione matrice appropriata. Ad esempio, una tecnica di deposizione di matrice bagnata, che comporta sciogliendo una matrice in solvente, è superiore per desorbimento maggior parte delle proteine e peptidi, che secchi tecniche di deposizione di matrice sono particolarmente efficaci per la ionizzazione di lipidi. Sublimazione stato segnalato come un metodo altamente efficiente di deposizione di matrice secca per la rilevazione di lipidi nei tessuti di MALDI IMS causa della homogeneity di deposizione di cristalli di matrice e minimale delocalizzazione analita rispetto a molti metodi di deposizione bagnata 1, 2. In generale, si prevede che il campione e la matrice in polvere in una camera sottovuoto con i campioni pressati contro una superficie fredda. L'apparecchiatura viene quindi abbassata in un bagno riscaldato (sabbia o olio), risultando in sublimazione della matrice polvere sulla superficie del campione di tessuto raffreddata. Qui si descrive un protocollo sublimazione usando matrice 1,5-diamminonaftalene (DAN) per il rilevamento e la visualizzazione dei gangliosidi nel cervello di ratto utilizzando MALDI IMS.
Introduction
Matrix-Assisted Laser desorbimento / ionizzazione (MALDI) Imaging Mass Spectrometry (IMS) sta diventando una tecnica molto ricercato per la visualizzazione della distribuzione spaziale dei lipidi, peptidi e proteine su superfici campione intatte. MALDI IMS era precedentemente conosciuto come una tecnica analitica per analiti pre-purificato, ma negli ultimi anni, ha attirato l'attenzione in molte altre discipline causa della capacità di combinare la precisione della spettrometria di massa ad alta risoluzione punti di riferimento anatomici / visivi senza bisogno di alcuna etichettatura esterna. Come la piscina scientifica dei ricercatori che utilizzano questa tecnica continua a crescere, vi è una maggiore necessità di standardizzati, protocolli facili da seguire per assistere nello sviluppo e ottimizzazione di esperimenti IMS. I gangliosidi, un gruppo di lipidi di membrana altamente abbondanti nel sistema nervoso centrale, sono ideali per esperimenti MALDI IMS come loro ubicazione, incorporato all'interno della membrana, rende certi species impossibile da rilevare con i convenzionali Immuno-etichettatura. Inoltre, abbiamo dimostrato, utilizzando MALDI IMS, che questi lipidi, che funzionano come modulatori di segnalazione cellulare, tra le altre cose, hanno modelli di distribuzione anatomica unici nel cervello dei roditori sani che vengono modificate dopo lesione cerebrale 3, 4, 5. I gangliosidi sono situati in un range di massa più elevata rispetto alla maggior parte delle specie di lipidi, e sono quindi più adatto alla piattaforma di imaging MALDI.
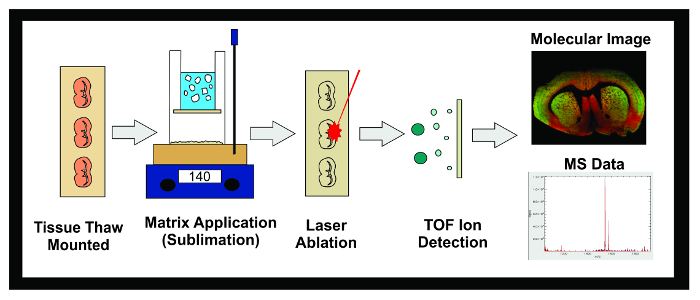
Figura 1: Flusso di lavoro di MALDI IMS Experiment. Diagramma dello schema generale di un esperimento MALDI IMS tramite sublimazione. Tessuti congelati a -80 ° C è sezionato in un criostato e 10 sezioni micron sono disgelo montato su vetrini ITO conduttivo. Il vetrino viene quindi posto in un essiccatore fino sublimazione. Slides sono inseriti nell'apparecchiatura sublimazione e uno strato uniforme di matrice viene applicata alla superficie del campione di tessuto. I campioni sono congelati durante la notte in un congelatore C -20 ° poi messo in essiccatore per 10 minuti. Una volta applicate norme, i campioni vengono inseriti nello strumento MALDI cui un laser è diretto attraverso il tessuto causando molecole desorbiti nella matrice a ionizzare. Gli ioni viaggiano lungo un tubo di volo e separati in base alla loro massa (tempo di volo / TOF) fino a raggiungere il rilevatore. Le informazioni sulla abbondanza ionica di analiti in un intervallo predeterminato di massa-carica (m / z) viene visualizzata come sia un'immagine molecolare e spettro di massa. Questi dati possono essere utilizzati sia per visualizzare e quantificare l'abbondanza ionica dell'analita di interesse all'interno del tessuto con immagini stampate. Clicca qui per vedere una versione più grande di questa figura.
preparazione del campioneper MALDI IMS è molto variabile in ogni fase del processo deve essere personalizzato per gli analiti di interesse. La caratteristica distintiva di esperimenti MALDI-base è l'uso di un rivestimento a matrice depositata sulla superficie del campione prima dell'analisi. Oltre al ruolo di assorbire e trasferire energia di radiazione dal laser durante il processo di ablazione, la matrice serve anche ad isolare vari analiti dal campione, facilitando così l'analisi di composti di interesse 6, 7. applicazione omogenea della matrice alla superficie del campione è il passo più importante nel processo di preparazione del campione. Deposizione di matrice non corretta può portare a grandi formazioni eterogenee cristallo matrice e lo sviluppo di artefatti, ionico segnale basso, e scarsa riproducibilità 7.
A causa della affinità di alcune matrici per isolare analiti specifici, il tipo di matrice selezionata per un esperimento puòalterare in modo significativo l'esito. Le matrici utilizzate per l'imaging di proteine e peptidi spesso differiscono da quelli utilizzati per i lipidi di imaging e il processo è ulteriormente complicata dalla necessità di procedure aggiuntive come lavaggio e reidratazione passaggi per rilevare correttamente i segnali dal tessuto. Sebbene esistano fasi di lavaggio per la valorizzazione dei segnali lipidi 8, non sono un prerequisito per la rilevazione della maggior parte delle specie di lipidi. Quando si seleziona una matrice per un esperimento di imaging lipidi, è importante considerare la polarità del lipide di interesse come questo restringere la gamma di matrici adatte. Ad esempio, gangliosidi contengono residui di acido sialico che conferiscono loro una polarità negativa complessiva. Ci sono una serie di matrici che possono efficacemente desorbire e ionizzare gangliosidi dal tessuto; Tuttavia, fattori come picchi matrice derivata nello spettro e stabilità della matrice sotto vuoto devono essere presi in considerazione. 1,5-diaminonapthalene (DAN matrice) è sufficientemente stabile in condizioni di vuoto strumento per la maggior parte delle applicazioni di imaging e ha dimostrato un alto grado di sensibilità per lipidi desorbimento e può essere utilizzato per l'analisi dei lipidi in entrambe le modalità di ioni positivi e negativi 2. matrix DAN, rispetto ad altre matrici negative lipidico affinità come acido diidrossibenzoico (DHB), 9-aminoacridine (9-AA), e 5-cloro-2-mercaptobenzotiazolo (CMBT), era in grado di desorbire più efficiente gangliosidi di cervello di ratto tessuto in modalità ioni negativi (manoscritto in preparazione).
Selezione del metodo appropriato di deposizione di matrice è di uguale importanza alla selezione matrice stessa. Wet metodi di deposizione di matrice in cui la matrice solida viene disciolto in un solvente organico, e depositato dal pneumatico o spruzzatori o spotters automatizzate, sono particolarmente efficaci per il desorbimento di proteine e peptidi come liquido permea il campione per consentire supplementarection di composti e co-cristallizzazione con la matrice. Sebbene queste tecniche possono essere usate anche per applicazioni lipidici, analita delocalizzazione e formazioni cristalline matrice irregolare sono fenomeni comuni a causa della grande abbondanza e la solubilità dei lipidi in solventi, particolarmente nel tessuto 2, 9. Poiché i lipidi sono facilmente ionizzati dal tessuto, secco tecniche di deposizione di matrice, come sublimazione, offrono una semplice, economica alternativa alla irroratrici che aggirano molti lo svantaggio di queste tecniche. Il successo di sublimazione in esperimenti MALDI IMS è attribuita a caratteristiche quali la morfologia matrice microcristallina che aumenta la superficie di matrice analita vincolante, maggiore purezza della matrice, e la deposizione di matrice omogenea che aumentano la riproducibilità rispetto alle tecniche matrice umido 1, 10.
sublimazione involves riscaldamento di una matrice di polvere sotto vuoto immediatamente sotto una superficie del campione raffreddato con conseguente solida transizione in fase gas della matrice polvere seguita dalla deposizione sulla superficie del campione di tessuto. Durante sublimazione, deposizione di matrice può essere controllata da diversi fattori quali tempo, temperatura e pressione per fornire risultati altamente riproducibili. Un singolo esperimento sublimazione può richiedere da 5 a 20 min a seconda del tipo di matrice selezionata, che può essere riutilizzato più volte prima dello smaltimento. L'apparecchio può essere acquistato commercialmente ad una frazione del prezzo delle irroratrici automatizzate ed è facilmente smontato per pulizia e manutenzione. Il basso costo e la relativa semplicità di questa tecnica di deposizione di matrice rendono ideale per i ricercatori che iniziano o in espansione su applicazioni di imaging di lipidi in MALDI IMS. Anche se le informazioni in dettaglio i protocolli per sublimazione dei tessuti per IMS sono stati riportati 11, alcuni protocolli standardizzati esistono which concentrarsi sul flusso di lavoro di base coinvolto con la realizzazione di un esperimento di sublimazione per l'imaging lipidi alta massa in modalità di ioni negativi, il che rende difficile stabilire la tecnica senza vasta tentativi ed errori. Il seguente è un protocollo sperimentale che mira a colmare questa lacuna per la sublimazione della matrice di DAN su sezioni di cervello di ratto per imaging ad alta risoluzione e la rilevazione dei gangliosidi.
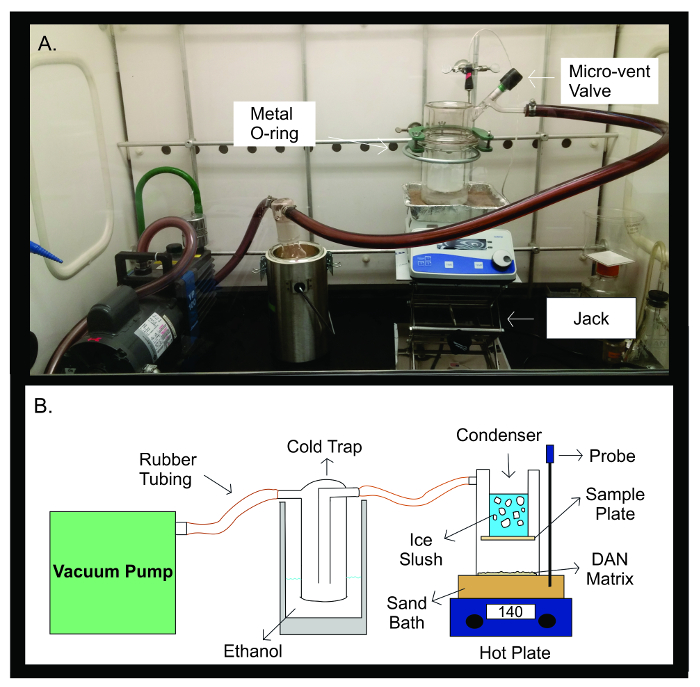
Figura 2: sublimazione Apparatus. Fotografico (A) e schema (B) dell'apparecchiatura sublimazione. La pompa per vuoto è collegata con un tubo in gomma per una trappola a freddo riempito con 300 mL di etanolo. La trappola fredda è poi collegata con un tubo in gomma per l'apparato sublimazione. L'apparecchiatura è costituita da due pezzi separati di vetro che sono sigillati insieme con un metallo giunto cardanico. La metà superiore della sublimatorecontiene il condensatore che è riempito di fanghiglia di ghiaccio. La piastra campione viene registrato sul fondo del condensatore, all'interno dell'apparato di vetro sigillato. La metà inferiore del dispositivo sublimazione contiene la matrice DAN, distribuite in modo uniforme di fronte al piatto del campione. Durante sublimazione, l'apparecchio di vetro è posto su un bagno di sabbia riscaldata a 140 ° C da una piastra calda direttamente sotto di esso. La sonda di temperatura aiuta a mantenere una temperatura stabile durante l'esperimento sublimazione attraverso il feedback della temperatura del bagno di sabbia rispetto alla temperatura preimpostata per l'esperimento. Clicca qui per vedere una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Dettagli Questo lavoro un protocollo standardizzato di matrice sublimazione sul tessuto per la rilevazione di lipidi carichi negativamente, come gangliosidi, in esperimenti MALDI IMS. Preparazione del campione per MALDI IMS è altamente variabile e deve essere personalizzato per soddisfare le proprietà uniche del analita di interesse. L'applicazione della matrice sulla superficie del campione di tessuto è un aspetto cruciale del processo di preparazione del campione per quanto riguarda la qualità dei risultati in…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge the technical assistance of Kristina Jurcic in the University of Western Ontario MALDI MS facility, as well as the National Sciences and Engineering Council (NSERC) for funding this work. The authors would also like to acknowledge the Caprioli group (Vanderbilt University, TN) and Chaurand group (Université de Montreal, QC) for their advice in optimizing the sublimation technique presented in this manuscript.
Materials
| Sublimator | Chemglass Life Sciences | CG3038-01 | |
| 1,5- Diaminonapthalene (DAN) matrix | Sigma-Aldrich | D21200 | 100 G |
| Cryostat | Thermo-Fisher Scientific | CryoStar NX50 | |
| Hot plate with temperature feedback | Thermo-Fisher Scientific | HP88857290 | Isotemp ADVD 7×7 HP 100-120v |
| Stainless Steel Jack | Thermo-Fisher Scientific | 2216479 | 10×10 |
| Cold Trap | Custom built on site | ||
| Vacuum Pump | Franklin Electric | 1102180403 | Savant VP100 Two Stage |
| Indium-tin-oxide (ITO) Slides | Hudson Surface Technology | PSI 1111000 | type II, 1.1mm/25 each |
| MALDI TOF/TOF 5800 Instrument | AB Sciex | ||
| Desiccator | Sigma-Aldrich | D2797 | tabletop desiccator |
References
- Hankin, J. A., Barkley, R. M., Murphy, R. C. Sublimation as a method of matrix application for mass spectrometric imaging. J. Am. Soc. Mass Spectrom. 18, 1646-1652 (2007).
- Thomas, A., Charbonneau, J. L., Fournaise, E., Chaurand, P. Sublimation of new matrix candidates for high spatial resolution imaging mass spectrometry of lipids: enhanced information in both positive and negative polarities after 1,5-diaminonapthalene deposition. Anal. Chem. 84, 2048-2054 (2012).
- Caughlin, S., et al. Increased Expression of Simple Ganglioside Species GM2 and GM3 Detected by MALDI Imaging Mass Spectrometry in a Combined Rat Model of Aβ Toxicity and Stroke. PLoS ONE. 10, 0130364 (2015).
- Weishaupt, N., Caughlin, S., Yeung, K., Whitehead, S. Differential Anatomical Expression of Ganglioside GM1 Species Containing d18:1 or d20:1 Sphingosine Detected by MALDI Imaging Mass Spectrometry in Mature Rat Brain. Front Neuroanatomy. 9 (155), (2015).
- Whitehead, S., et al. Imaging Mass Spectrometry Detection of Gangliosides Species in the Mouse Brain following Transient Focal Cerebral Ischemia and Long-Term Recovery. PLoS ONE. 6 (6), 20808 (2011).
- Fuchs, B., Süß, R., Schiller, J. An update of MALDI-TOF mass spectrometry in lipid research. Progress in Lipid Research. 49, 450-475 (2010).
- Barceló-Coblijn, G., Fernández, J. A. Mass spectrometry coupled to imaging techniques: the better the view the greater the challenge. Front Physiol. 6 (3), 1-5 (2015).
- Angel, P. M., Spraggins, J. M., Baldwin, H. S., Caprioli, R. Enhanced sensitivity for high spatial resolution lipid analysis by negative ion mode matrix assisted laser desorption ionization imaging mass spectrometry. Anal. Chem. 84, 1557-1564 (2012).
- Murphy, R. C., Hankin, J. A., Barkley, R. M., Zemski Berry, K. A. MALDI imaging of lipids after matrix sublimation/deposition. Biochim. Biophys. Acta. 1811, 970-975 (2011).
- Jaskolla, T. W., Karas, M., Roth, U., Steinert, K. Comparison between vacuum sublimed matrices and conventional dried droplet preparation in MALDI-TOF mass spectrometry. J. Am. Soc. Mass Spectrom. 20, 1104-1115 (2009).
- O’Rourke, M. B., Raymond, B. B., Djordjevic, S. P., Padula, M. P. A versatile cost-effective method for the analysis of fresh frozen tissue sections via matrix-assisted laser desorption/ionisation imaging mass spectrometry. Rapid Commun. Mass Spectrom. 29, 637-644 (2015).
- Patterson, N. H., Thomas, A., Chaurand, P. Monitoring time-dependent degradation of phospholipids in sectioned tissues by MALDI imaging mass spectrometry. J Mass Spectrom. 49, 622-627 (2014).
- Cheng, H., Sun, G., Yang, K., Gross, R. W., Han, X. Selective desorption/ionization of sulfatides by MALDI-MS facilitated using 9-aminoacridine as matrix. J. Lipid Res. 51, 1599-1609 (2010).
- Puolitaival, S. M., Burnum, K. E., Cornett, D. S., Caprioli, R. M. Solvent-free matrix dry-coating for MALDI imaging of phospholipids. J. Am. Soc. Mass Spectrom. 19, 882-886 (2008).
- Chaurand, P., Cornett, D., Angel, P., Caprioli, R. From Whole-body Sections Down to Cellular Level, Multiscale Imaging of Phospholipids by MALDI Mass Spectrometry. Mol Cell Proteomics. 10, (2011).
- Grove, K. J., Frappier, S. L., Caprioli, R. M. Matrix pre-coated MALDI MS targets for small molecule imaging in tissues. J. Am. Soc. Mass Spectrom. 22, 192-195 (2011).
- Yang, J., Caprioli, R. M. Matrix precoated targets for direct lipid analysis and imaging of tissue. Anal. Chem. 85, 2907-2912 (2013).
- Gemperline, E., Rawson, S., Li, L. Optimization and comparison of multiple MALDI matrix application methods for small molecule mass spectrometric imaging. Anal. Chem. 86, 10030-10035 (2014).

