סובלימציה של DAN מטריקס עבור איתור ויזואליזציה של Gangliosides רקמות מוח החולדה עבור MALDI הדמיה ספקטרומטריית מסה
Summary
A protocol for the sublimation of DAN matrix onto rat brain tissue for the detection of gangliosides using MALDI Imaging Mass Spectrometry is presented.
Abstract
להכנת דגימות הוא המפתח לגילוי אופטימלי וויזואליזציה של analytes ב Desorption לייזר בסיוע מטריקס / יינון (MALDI) ספקטרומטריית מסה הדמיה (IMS) ניסויים. קביעת הפרוטוקול המתאים לעקוב לאורך כל תהליך הכנת המדגם יכול להיות קשה כמו כל צעד חייב להיות מותאם על מנת לקיים את המאפיינים הייחודיים של analytes עניין. תהליך זה כרוך לא רק במציאת מטריצה תואמת שיכול desorb ו ליינן המולקולות של עניין ביעילות, אלא גם בחירת הטכניקה בתצהיר המטריצה המתאימה. לדוגמא, טכניקה בתצהיר מטריצה רטובה, שמשמעותה המסה מטריצה ממסה, היא מעולה עבור desorption של רוב החלבונים ופפטידים, ואילו טכניקות בתצהיר מטריצה יבשות יעילות במיוחד יינון של שומנים. סובלימציה דווחה כשיטה היעילה ביותר של בתצהיר מטריצה יבש לצורך זיהוי של שומנים ברקמות ידי MALDI IMS בשל homogeneity של בתצהיר קריסטל מטריקס delocalization אנליטי מזערי בהשוואה לשיטות בתצהיר רטוב רבות 1, 2. באופן כללי, זה מתבצע על ידי צבת מדגם מטריקס אבקה בתא אטום ואקום עם הדגימות נלחצו משטח קר. המנגנון הוא הוריד ואז לתוך אמבט מחומם (חול או שמן), וכתוצאה מכך סובלימציה של מטריקס אבק על שטח מדגם רקמות המקורר. כאן אנו מתארים פרוטוקול סובלימציה באמצעות 1,5-diaminonaphthalene (DAN) מטריקס לאיתור להדמיה של gangliosides במוח החולדה באמצעות MALDI IMS.
Introduction
מטריקס בסיוע לייזר Desorption / יינון (MALDI) ספקטרומטריית מסה הדמיה (IMS) הופכת מאד מבוקש טכניקה להדמיה של הפריסה המרחבית של שומנים, פפטידים וחלבונים על פני משטחים מדגם שלמים. MALDI IMS היה ידוע בעבר בתור שיטה אנליטית עבור analytes מראש מטוהרים, אך בשנים האחרונות, זה כבר למשוך תשומת לב בתחומים רבים אחרים בגלל היכולת לשלב את הדיוק של ספקטרומטריית מסה עם נקודות התייחסות אנטומית / וידאו ברזולוציה גבוהה ללא צריך עבור כל תיוג חיצוני. כמו הברכה המדעית של חוקרי שימוש בטכניקה זו ממשיכה לגדול, שם הוא גדל צורך סטנדרטי, קלים לעקוב פרוטוקולים כדי לסייע בפיתוח ואופטימיזציה של ניסויי IMS. Gangliosides, קבוצה של ליפידים קרום בהיקף נרחב ביותר במערכת העצבים המרכזית, הם אידיאליים עבור ניסויים MALDI IMS כמו מיקומם, מוטבע בתוך הממברנה, גורם ספציפי מסויםes בלתי אפשרי לזהות באמצעות תיוג חיסוני קונבנציונלי. בנוסף, הראינו, באמצעות MALDI IMS, כי שומנים אלו, אשר מתפקדים מאפננים של איתות תאית, בין יתר, יש דפוסי תפוצה אנטומי ייחודיים במוח המכרסם הבריא כי הם שינו לאחר פגיעה מוחית 3, 4, 5. Gangliosides ממוקם מגוון מסה גבוה יותר בהשוואה למיני השומנים ביותר, ועל כן הם מתאימים ביותר פלטפורמת הדמית MALDI.
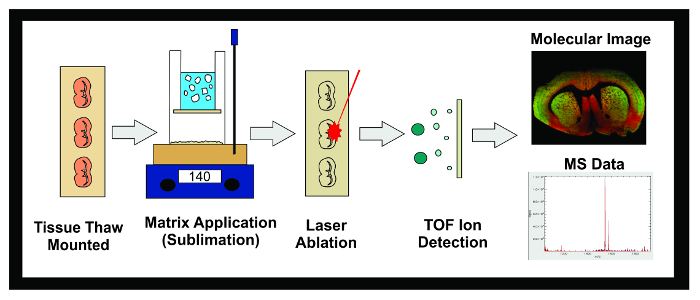
איור 1: Workflow של ניסוי MALDI IMS. תרשים של זרימת העבודה הכללית של ניסוי IMS MALDI באמצעות סובלימציה. רקמות קפואות ב -80 ° C מחולקות בתוך cryostat ו -10 מיקרומטר חלקים הם הפשרה רכובה על גבי שקופיות איטו מוליך. השקופית ממוקמת אז ייבוש עד סובלימציה. SLIdes מוכנס לתוך מנגנון סובלימציה וכן גם שכבה של מטריקס מוחלת על פני שטח מדגם רקמות. דוגמאות מוקפא לילה במקפיא -20 מעלות צלזיוס ממוקם אז ייבוש במשך 10 דקות. לאחר סטנדרטים יושמו, הדגימות מוכנסות לתוך מכשיר MALDI שבו ליזר מכוון על פני הרקמה גורמת מולקולות desorbed במטריצה כדי ליינן. היונים לנסוע במורד צינור טיסה ונפרד מבוסס על המסה שלהם (זמן של טיסה / TOF) עד שהם מגיעים אל הגלאי. המידע על השפע היוני של analytes בתוך מסה-אל-תשלום קבוע מראש (m / z) טווח מוצג גם תמונה מולקולרית ספקטרום המוני. נתונים אלה יכולים לשמש הם לחזות ולכמת את השפע היוני של אנליטי של עניין בתוך רקמת ההדמיה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
להכנת דגימותעבור MALDI IMS הוא משתנה מאוד כמו כל שלב של התהליך חייב להיות מותאם אישית אל analytes עניין. התכונה המגדירה של ניסויים מבוססים MALDI היא השימוש ציפוי מטריקס מופקד על פני השטח המדגמים לפני הניתוח. בנוסף לתפקיד של קליטה והעברת אנרגית קרינה מהליזר במהלך תהליך אבלציה, המטריצה משמשת גם כדי לבודד analytes השונה מן המדגם, ובכך מקלות על הניתוח של תרכובות של עניין 6, 7. יישום אחיד של המטריצה אל פני שטח המדגם הוא הצעד החיוני ביותר בתהליך הכנת המדגם. בתצהיר מטריצה לא נכון יכול להוביל תצורות גביש מטריקס הטרוגניות גדולה בפיתוח של חפצים, אות-יון נמוך, ו -7 שחזור עניים.
בשל הזיקה של מטריצות מסוימות לבודד analytes הספציפי, הסוג של מטריקס נבחר לניסוי יכוללשנות את התוצאה באופן משמעותי. המטריצות המשמשות הדמיה של חלבונים ופפטידים לעתים קרובות שונות מאלה המשמשים שומני הדמיה והתהליך מסתבך עוד יותר על ידי הצורך בהליכים נוספים כגון צעדי כביסה להחזרת נוזלים כדי לזהות אותות בהצלחה מרקמות. למרות צעדי כביסה להתקיים להגברת אותות שומנים 8, הם לא תנאים הכרחיים לצורך זיהוי של רוב מיני שומנים. בעת בחירת מטריקס עבור ניסוי הדמית שומנים, חשוב לשקול את הקוטביות של השומנים של עניין כמו זה יהיה לצמצם את הטווח של מטריצות מתאימות. לדוגמא, gangliosides להכיל שאריות חומצת sialic המקנות להם קוטביות שלילית הכוללת. ישנם מספר של מטריצות שיכולים desorb ביעילות ליינן gangliosides מרקמות; עם זאת, גורמים כגון פסגות הנגזרות מטריקס בספקטרום והיציבות של מטריקס תחת ואקום חייבים יילקחו בחשבון. 1,5-diaminonapthalene (DAN) מטריקס היא יציבה מספיק בתנאי ואקום מכשיר עבור רוב יישומי הדמיה הוכיחה רמה גבוהה של רגישות desorption שומנים ויכולה לשמש לניתוח של שומנים הם מצבי יון חיוביים ושליליים 2. DAN מטריקס, בהשוואה מטריצות זיקה השומנים שליליות אחרות כגון חומצה dihydroxybenzoic (DHB), 9-aminoacridine (9-AA), ו -5 כלורו-2-mercaptobenzothiazole (CMBT), הצליח desorb gangliosides ביעילות ביותר מהמוח חולדה רקמות במצב יונים שליליים (כתב יד בהכנה).
בחירת השיטה המתאימה של בתצהיר מטריצה היא בעלת חשיבות שווה בחירת המטריצה עצמה. שיטות בתצהיר מטריצה רטובות שבו המטריצה המוצקה מומסת ממס אורגני, ותופקדנה על פנאומטי או אוטומטית מתזים או תצפיתנים, יעילות במיוחד עבור desorption של חלבונים ופפטידים בעוד הנוזל מחלחל המדגם כדי לאפשר תוספתction של תרכובות ושיתוף התגבשות עם מטריקס. למרות ששיטות אלה יכולים לשמש גם עבור יישומי שומנים, delocalization אנליטי ותצורות קריסטל מטריקס אחידה היא תופעה נפוצה בשל שפע המסיסות הגבוה של שומנים ממסים, במיוחד ברקמה 2, 9. בגלל שומנים הופכים להיות מיוננים בקלות מרקמות, טכניקות בתצהיר מטריצה יבשות, כגון סובלימציה, להציע אלטרנטיבה יעילה פשוטה, עלות מתזים תוך עקיפת רבי החסרון של טכניקות אלה. ההצלחה של סובלימציה בניסויים MALDI IMS מיוחסת תכונות כגון מורפולוגיה מטריקס מיקרו דבר המגדיל את שטח הפנים החשוף-אנליטי מטריצה מחייב, טוהר מטריקס גדל, בתצהיר מטריצה הומוגנית המוביל שחזור מוגברת בהשוואה לטכניקות מטריקס רטוב 1, 10.
סובלימציה involves חימום מטריצת אבקה תחת ואקום מייד מתחת לפני שטח מדגם מקורר וכתוצאה מכך מוצק המעבר לשלב גז של מטריקס האבקה ואחריו בתצהיר על פני שטח מדגם רקמות. במהלך סובלימציה, בתצהיר מטריקס יכול להיות נשלט על ידי גורמים שונים כגון זמן, טמפרטורה ולחץ כדי לספק תוצאות מאוד לשחזור. ניסוי סובלימציה יחיד יכול לקחת בין 5 ל 20 דקות, תלוי בסוג של מטריקס נבחרה, אשר ניתן להשתמש בהן שוב ושוב כמה פעמים לפני סילוק. המנגנון ניתן לרכוש מסחרי בכל חלק של המחיר של מתזים אוטומטיים נלקח בקלות בנפרד לניקוי ותחזוקה. עלות נמוכה הפשטות היחסית של טכניקה בתצהיר מטריצה זו להפוך אותו אידיאלי עבור חוקרים מתחילים או הרחבת על יישומי הדמיה ליפיד MALDI IMS. אף כי מידע המפרט פרוטוקולים סובלימציה של רקמות עבור IMS דווחו 11, כמה פרוטוקולים סטנדרטיים קיימים which להתמקד העבודה הבסיסית מעורבת עם ביצוע ניסוי סובלימציה הדמית שומני מסה גבוהים במצב יונים שלילי, ולכן קשה לקבוע את הטכניקה ללא ניסוי וטעייה נרחבים. להלן פרוטוקול הניסוי במטרה למלא את החלל עבור סובלימציה של מטריקס DAN על חלקים במוח החולדה הדמיה ברזולוציה גבוהה וזיהוי של gangliosides.
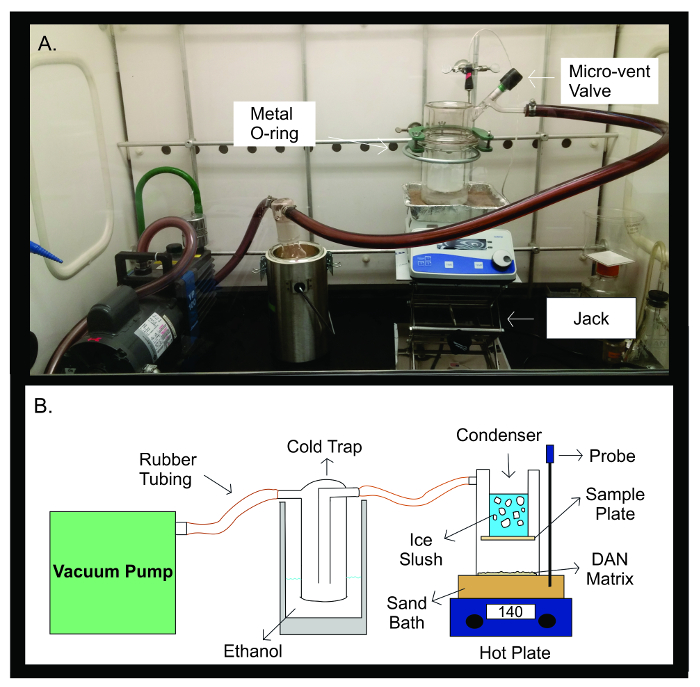
איור 2: מכשירי סובלימציה. תצלום (א) ו תרשים סכמטי (B) של מנגנון סובלימציה. משאבת הוואקום מחוברת באמצעות צינור גומי ל מלכודת קרה מלאה 300 מיליליטר של אתנול. המלכודת הקרה מחוברת אז על ידי צינורות גומי למנגנון סובלימציה. המנגנון הוא מורכב משני חלקים נפרדים של כלי זכוכית שאינם חתומים יחד עם מתכת U-משותף. המחצית העליונה של sublimatorמכיל הקבל אשר מתמלא רפש קרח. צלחת המדגם היא מודבקת על החלק התחתון של הקבל, בתוך התקן הזכוכית האטום. המחצית התחתונה של מנגנון סובלימציה מכילה מטריצת DAN, פרושים מול צלחת המדגם באופן שווה. במהלך סובלימציה, מנגנון הזכוכית מושם על אמבט חול מחומם ל -140 מעלות צלזיוס על ידי פלטה חשמלית ישירות מתחתיה. חללית הטמפרטורה עוזרת לשמור על טמפרטורה יציבה לאורך ניסוי סובלימציה באמצעות משוב של טמפרטורת חול האמבטיה לעומת הטמפרטורה מראש עבור הניסוי. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Protocol
Representative Results
Discussion
עבודה זו מפרטת פרוטוקול סטנדרטי של סובלימציה מטריקס על רקמות לצורך זיהוי של שומנים טעונים שלילית, כגון gangliosides, בניסויים MALDI IMS. לדוגמא כהכנה MALDI IMS הוא משתנה מאוד וחייב להיות מותאם אישית כדי להתאים את המאפיינים הייחודיים של אנליטי של עניין. היישום של מטריקס על גבי משטח …
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge the technical assistance of Kristina Jurcic in the University of Western Ontario MALDI MS facility, as well as the National Sciences and Engineering Council (NSERC) for funding this work. The authors would also like to acknowledge the Caprioli group (Vanderbilt University, TN) and Chaurand group (Université de Montreal, QC) for their advice in optimizing the sublimation technique presented in this manuscript.
Materials
| Sublimator | Chemglass Life Sciences | CG3038-01 | |
| 1,5- Diaminonapthalene (DAN) matrix | Sigma-Aldrich | D21200 | 100 G |
| Cryostat | Thermo-Fisher Scientific | CryoStar NX50 | |
| Hot plate with temperature feedback | Thermo-Fisher Scientific | HP88857290 | Isotemp ADVD 7×7 HP 100-120v |
| Stainless Steel Jack | Thermo-Fisher Scientific | 2216479 | 10×10 |
| Cold Trap | Custom built on site | ||
| Vacuum Pump | Franklin Electric | 1102180403 | Savant VP100 Two Stage |
| Indium-tin-oxide (ITO) Slides | Hudson Surface Technology | PSI 1111000 | type II, 1.1mm/25 each |
| MALDI TOF/TOF 5800 Instrument | AB Sciex | ||
| Desiccator | Sigma-Aldrich | D2797 | tabletop desiccator |
References
- Hankin, J. A., Barkley, R. M., Murphy, R. C. Sublimation as a method of matrix application for mass spectrometric imaging. J. Am. Soc. Mass Spectrom. 18, 1646-1652 (2007).
- Thomas, A., Charbonneau, J. L., Fournaise, E., Chaurand, P. Sublimation of new matrix candidates for high spatial resolution imaging mass spectrometry of lipids: enhanced information in both positive and negative polarities after 1,5-diaminonapthalene deposition. Anal. Chem. 84, 2048-2054 (2012).
- Caughlin, S., et al. Increased Expression of Simple Ganglioside Species GM2 and GM3 Detected by MALDI Imaging Mass Spectrometry in a Combined Rat Model of Aβ Toxicity and Stroke. PLoS ONE. 10, 0130364 (2015).
- Weishaupt, N., Caughlin, S., Yeung, K., Whitehead, S. Differential Anatomical Expression of Ganglioside GM1 Species Containing d18:1 or d20:1 Sphingosine Detected by MALDI Imaging Mass Spectrometry in Mature Rat Brain. Front Neuroanatomy. 9 (155), (2015).
- Whitehead, S., et al. Imaging Mass Spectrometry Detection of Gangliosides Species in the Mouse Brain following Transient Focal Cerebral Ischemia and Long-Term Recovery. PLoS ONE. 6 (6), 20808 (2011).
- Fuchs, B., Süß, R., Schiller, J. An update of MALDI-TOF mass spectrometry in lipid research. Progress in Lipid Research. 49, 450-475 (2010).
- Barceló-Coblijn, G., Fernández, J. A. Mass spectrometry coupled to imaging techniques: the better the view the greater the challenge. Front Physiol. 6 (3), 1-5 (2015).
- Angel, P. M., Spraggins, J. M., Baldwin, H. S., Caprioli, R. Enhanced sensitivity for high spatial resolution lipid analysis by negative ion mode matrix assisted laser desorption ionization imaging mass spectrometry. Anal. Chem. 84, 1557-1564 (2012).
- Murphy, R. C., Hankin, J. A., Barkley, R. M., Zemski Berry, K. A. MALDI imaging of lipids after matrix sublimation/deposition. Biochim. Biophys. Acta. 1811, 970-975 (2011).
- Jaskolla, T. W., Karas, M., Roth, U., Steinert, K. Comparison between vacuum sublimed matrices and conventional dried droplet preparation in MALDI-TOF mass spectrometry. J. Am. Soc. Mass Spectrom. 20, 1104-1115 (2009).
- O’Rourke, M. B., Raymond, B. B., Djordjevic, S. P., Padula, M. P. A versatile cost-effective method for the analysis of fresh frozen tissue sections via matrix-assisted laser desorption/ionisation imaging mass spectrometry. Rapid Commun. Mass Spectrom. 29, 637-644 (2015).
- Patterson, N. H., Thomas, A., Chaurand, P. Monitoring time-dependent degradation of phospholipids in sectioned tissues by MALDI imaging mass spectrometry. J Mass Spectrom. 49, 622-627 (2014).
- Cheng, H., Sun, G., Yang, K., Gross, R. W., Han, X. Selective desorption/ionization of sulfatides by MALDI-MS facilitated using 9-aminoacridine as matrix. J. Lipid Res. 51, 1599-1609 (2010).
- Puolitaival, S. M., Burnum, K. E., Cornett, D. S., Caprioli, R. M. Solvent-free matrix dry-coating for MALDI imaging of phospholipids. J. Am. Soc. Mass Spectrom. 19, 882-886 (2008).
- Chaurand, P., Cornett, D., Angel, P., Caprioli, R. From Whole-body Sections Down to Cellular Level, Multiscale Imaging of Phospholipids by MALDI Mass Spectrometry. Mol Cell Proteomics. 10, (2011).
- Grove, K. J., Frappier, S. L., Caprioli, R. M. Matrix pre-coated MALDI MS targets for small molecule imaging in tissues. J. Am. Soc. Mass Spectrom. 22, 192-195 (2011).
- Yang, J., Caprioli, R. M. Matrix precoated targets for direct lipid analysis and imaging of tissue. Anal. Chem. 85, 2907-2912 (2013).
- Gemperline, E., Rawson, S., Li, L. Optimization and comparison of multiple MALDI matrix application methods for small molecule mass spectrometric imaging. Anal. Chem. 86, 10030-10035 (2014).

