Sublimação da DAN Matrix para a Detecção e Visualização de gangliosídeos no cérebro de um rato do tecido por MALDI imagem Espectrometria de Massa
Summary
A protocol for the sublimation of DAN matrix onto rat brain tissue for the detection of gangliosides using MALDI Imaging Mass Spectrometry is presented.
Abstract
A preparação da amostra é a chave para a detecção e a visualização de analitos em experiências com laser assistida por matriz de Dessorção / ionização (MALDI) Imagiologia espectrometria de massa (IMS) óptima. Determinação do protocolo apropriado para seguir em todo o processo de preparação da amostra pode ser difícil já que cada passo tem de ser optimizado para satisfazer as características únicas dos analitos de interesse. Este processo envolve não só em encontrar uma matriz compatível que pode desorver e ionizam as moléculas de interesse de forma eficiente, mas também seleccionar a técnica de deposição de matriz apropriada. Por exemplo, uma técnica de deposição húmida da matriz, o que implica a dissolução de uma matriz no solvente, é superior para a dessorção da maior parte das proteínas e péptidos, enquanto que as técnicas de deposição de matriz secas são particularmente eficazes para a ionização de lípidos. A sublimação foi classificado como um método altamente eficiente de deposição da matriz seco para a detecção de lípidos no tecido por MALDI IMS devido à homogeneity de deposição de cristais de matriz e mínima deslocalização analito, em comparação com muitos métodos de deposição molhadas 1, 2. Em termos gerais, que envolve colocar uma amostra em pó e a matriz em uma câmara de vácuo com as amostras pressionada contra uma superfície fria. O aparelho é então reduzido para um banho aquecido (areia ou óleo), resultando em sublimação da matriz em pó sobre a superfície da amostra de tecido arrefecida. Descrevemos aqui um protocolo de sublimação utilizando 1,5-diaminonaftaleno matriz (DAN) para a detecção e a visualização de gangliósidos no cérebro de rato utilizando MALDI IMS.
Introduction
laser assistida por matriz de Dessorção / ionização (MALDI) Imagiologia espectrometria de massa (IMS) está a tornar-se uma técnica muito procurado para a visualização da distribuição espacial dos lípidos, péptidos e proteínas através de superfícies intactas de amostra. MALDI IMS foi anteriormente conhecido como uma técnica analítica para analitos pré-purificado, mas em anos recentes, tem-se chamar a atenção em muitas outras disciplinas por causa da capacidade de combinar a precisão de espectrometria de massa com pontos de referência de alta resolução visuais / anatómicas sem a precisa para qualquer rotulagem externo. Como a associação científica dos investigadores que utilizam esta técnica continua a crescer, há um aumento da necessidade de protocolos, fácil de seguir normalizados para auxiliar no desenvolvimento e optimização das experiências IMS. Os gangliósidos, um grupo de lípidos da membrana altamente abundantes no sistema nervoso central, são ideais para experiências MALDI IMS como a sua localização, incorporado no interior da membrana, faz certa especificidadees impossível detectar utilizando Imuno-rotulagem convencional. Adicionalmente, temos mostrado, utilizando MALDI IMS, de que estes lípidos, que funcionam como moduladores da sinalização celular, entre outras coisas, têm perfis de distribuição anatómica original no cérebro de roedores saudáveis que são modificadas após a lesão cerebral 3, 4, 5. Os gangliósidos estão localizados a uma gama de massa mais elevada em comparação com a maioria das espécies de lípidos, e são, assim, mais adequado para a plataforma de imagem MALDI.
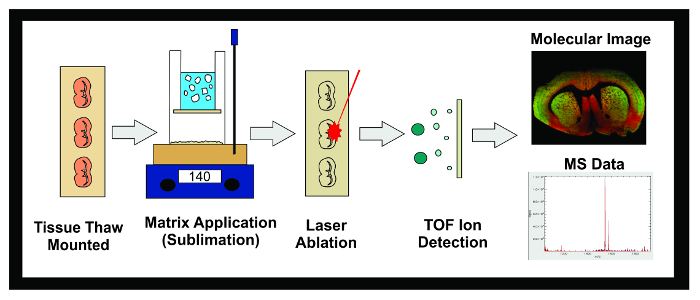
Figura 1: Fluxo de trabalho de MALDI IMS Experiment. Diagrama do fluxo de trabalho geral de uma experiência MALDI IMS usando sublimação. Tecido congelado a -80 ° C é seccionado num criostato e 10 uM secções são montadas em lâminas de degelo ITO condutoras. A lâmina é então colocado num excicador até sublimação. Slides são inseridas no aparelho de sublimação e mesmo uma camada de matriz é aplicada à superfície da amostra de tecido. As amostras são congeladas durante a noite num congelador a -20 ° C e depois colocada num excicador durante 10 minutos. Uma vez que tenham sido aplicados os padrões, as amostras são inseridas no instrumento MALDI onde um laser é dirigido através do tecido, causando moléculas dessorvidas na matriz para ionizar. Os íons de viajar para baixo um tubo de vôo e separada com base em sua massa (time-of-flight / TOF) até chegar ao detector. A informação sobre a abundância iónica de analitos num (m / z) gama predeterminada de massa-carga é apresentada como uma imagem de ambos molecular e espectro de massa. Estes dados podem ser utilizados para visualizar e quantificar tanto a abundância iónica do analito de interesse dentro do tecido impressa. Por favor clique aqui para ver uma versão maior desta figura.
Preparação de amostrapara MALDI IMS é altamente variável à medida que cada etapa do processo deve ser personalizado para os analitos de interesse. A característica definidora de experiências baseadas em MALDI é o uso de um revestimento de matriz depositada sobre a superfície da amostra antes da análise. Em adição à função de absorver e transferir energia de radiação do laser durante o processo de ablação, a matriz também serve para isolar vários analitos a partir da amostra, facilitando assim a análise de compostos de interesse 6, 7. aplicação homogénea da matriz para a superfície da amostra é a etapa mais importante no processo de preparação de amostras. Deposição de matriz inadequada pode levar a grandes formações heterogêneas cristal matriz e o desenvolvimento de artefatos, sinal de iões de baixa e pouca reprodutibilidade 7.
Devido à afinidade de certas matrizes para isolar analitos específicos, do tipo de matriz seleccionado de um experimento podealterar significativamente o resultado. As matrizes utilizadas para geração de imagens de proteínas e péptidos são muitas vezes diferentes das utilizadas para a lípidos de imagem e o processo é ainda mais complicado pela necessidade de procedimentos adicionais, tais como passos de lavagem e re-hidratação, a fim de detectar sinais com sucesso a partir de tecido. Embora existam etapas de lavagem para o reforço de sinais de lipídios 8, eles não são um pré-requisito para a detecção da maioria das espécies de lipídios. Ao seleccionar uma matriz para uma experiência de imagem de lípidos, é importante ter em conta a polaridade do lípido de interesse como isso vai limitar a gama de matrizes adequadas. Por exemplo, gangliósidos contêm resíduos de ácido siálico, que lhes dão uma polaridade negativa global. Há um certo número de matrizes que podem eficazmente de s sorver e ionizar gangliósidos de tecido; No entanto, factores tais como picos de matriz derivada do espectro e estabilidade da matriz sob vácuo deve ser levado em consideração. 1,5-diaminonapthalene (DUma matriz) é suficientemente estável sob condições de vácuo instrumento para a maioria das aplicações de imagem e demonstrou um elevado grau de sensibilidade para a dessorção lipídica e pode ser utilizado para a análise de lípidos em ambos os modos de iões positivos e negativos 2. matriz DAN, quando comparada com outras matrizes de afinidade lipídica negativa, tais como o ácido di-hidroxibenzóico (DHB), 9-aminoacridina (9-AA), e 5-cloro-2-mercaptobenzotiazole (CMBT), foi capaz de dessorver mais eficientemente gangliosidos de cérebro de rato tecido no modo de iões negativos (manuscrito em preparação).
Selecionando o método adequado para a deposição de matriz é de igual importância para a seleção da própria matriz. métodos de deposição de matriz molhado em que a matriz sólida é dissolvido num solvente orgânico, e depositadas por pneumático ou pulverizadores ou observadores automatizadas, são particularmente eficazes para a dessorção de proteínas e péptidos como o líquido penetra a amostra para permitir adicionalcção de compostos e de co-cristalização com a matriz. Embora estas técnicas também podem ser usados para aplicações de lipídios, deslocalização de analitos e formações de cristal da matriz irregular são ocorrências comuns devido à grande abundância e solubilidade de lipídios na solventes, particularmente no tecido 2, 9. Porque os lípidos são prontamente ionizadas a partir de tecidos, técnicas de deposição de matriz seco, tal como a sublimação, oferecem uma alternativa de custo simples, eficaz para pulverizadores, contornando muitos dos desvantagem destas técnicas. O sucesso da sublimação em experiências MALDI IMS é atribuído a funções tais como a morfologia da matriz microcristalina que aumenta a área de superfície para a matriz de ligação para a substância analisável, o aumento da pureza da matriz, e deposição de matriz homogénea que conduzem ao aumento da reprodutibilidade da matriz em comparação com as técnicas sanitária 1, 10.
invo sublimaçãoLves aquecimento de uma matriz em pó sob vácuo imediatamente abaixo de uma superfície de uma amostra arrefecida resultante em sólido de transição de fase gasosa da matriz em pó seguido de deposição sobre a superfície da amostra de tecido. Durante a sublimação, a deposição de matriz pode ser controlada por factores variáveis, tais como tempo, temperatura e pressão para proporcionar resultados altamente reprodutíveis. Uma experiência única sublimação pode levar de 5 a 20 minutos, dependendo do tipo de matriz seleccionado, o qual pode ser re-utilizada várias vezes antes da sua eliminação. O aparelho pode ser adquirido comercialmente a uma fracção do preço de pulverizadores automáticos e é facilmente desmontado para limpeza e manutenção. O baixo custo e relativa simplicidade dessa técnica deposição de matriz tornam ideal para pesquisadores iniciantes ou expandindo aplicações de imagem lipídico em MALDI IMS. Embora a informação detalhando protocolos para a sublimação dos tecidos para IMS foram relatados 11, alguns protocolos padronizados existem which focar o fluxo de trabalho básico envolvido com a realização de um experimento de sublimação para imagiologia lipídios de alta massa no modo de iões negativos, o que torna difícil estabelecer a técnica sem extensa tentativa e erro. O que se segue é um protocolo experimental com o objetivo de preencher essa lacuna para a sublimação da matriz DAN em secções de cérebro de rato para imagens de alta resolução e detecção de gangliosídeos.
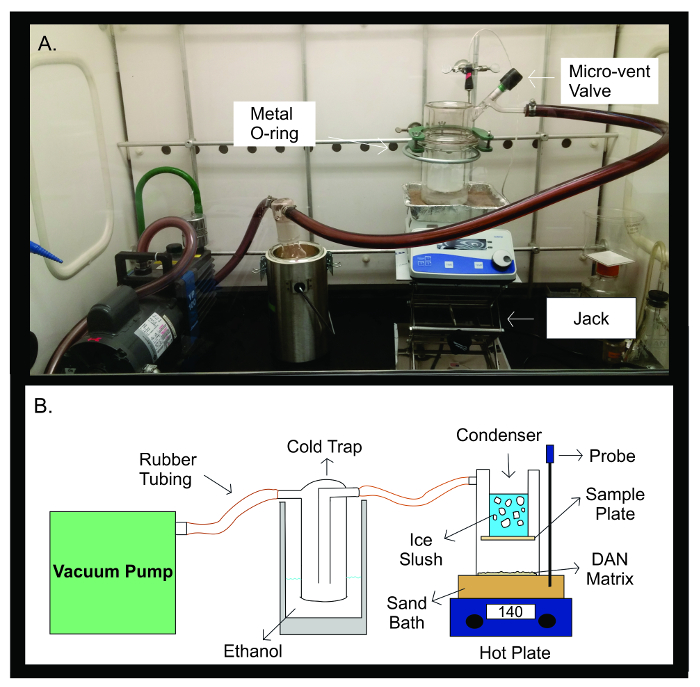
Figura 2: A sublimação Aparelho. A fotografia (A) e diagrama esquemático (B) do aparelho de sublimação. A bomba de vácuo ligada a um tubo de borracha para uma armadilha fria cheio com 300 ml de etanol. A câmara de frio é então ligado por tubos de borracha para o aparelho de sublimação. O aparelho é constituído por duas peças separadas de material de vidro que são seladas juntamente com um metal de L-articular. A metade superior da sublimadorcontém o condensador que é enchido com lama de gelo. A placa de amostra é gravado na parte inferior do condensador, no interior do aparelho de vidro selado. A metade inferior do aparelho de sublimação contém a matriz DAN, espalhar-se uniformemente em frente da placa de amostra. Durante a sublimação, o aparelho de vidro é colocada sobre um banho de areia aquecida a 140 ° C por uma placa quente directamente por baixo dele. A sonda de temperatura ajuda a manter uma temperatura estável durante todo o experimento sublimação através de realimentação da temperatura do banho de areia em comparação com a temperatura predefinida para o experimento. Por favor clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Este trabalho detalha um protocolo padronizado de sublimação matriz em tecidos para a detecção de lípidos carregados negativamente, tais como gangliósidos, em experimentos MALDI IMS. A preparação da amostra para MALDI IMS é altamente variável e deve ser personalizado para atender as propriedades únicas do analito de interesse. A aplicação da matriz sobre a superfície da amostra de tecido é um aspecto essencial do processo de preparação da amostra que diz respeito à qualidade dos resultados em IMS. Um c…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge the technical assistance of Kristina Jurcic in the University of Western Ontario MALDI MS facility, as well as the National Sciences and Engineering Council (NSERC) for funding this work. The authors would also like to acknowledge the Caprioli group (Vanderbilt University, TN) and Chaurand group (Université de Montreal, QC) for their advice in optimizing the sublimation technique presented in this manuscript.
Materials
| Sublimator | Chemglass Life Sciences | CG3038-01 | |
| 1,5- Diaminonapthalene (DAN) matrix | Sigma-Aldrich | D21200 | 100 G |
| Cryostat | Thermo-Fisher Scientific | CryoStar NX50 | |
| Hot plate with temperature feedback | Thermo-Fisher Scientific | HP88857290 | Isotemp ADVD 7×7 HP 100-120v |
| Stainless Steel Jack | Thermo-Fisher Scientific | 2216479 | 10×10 |
| Cold Trap | Custom built on site | ||
| Vacuum Pump | Franklin Electric | 1102180403 | Savant VP100 Two Stage |
| Indium-tin-oxide (ITO) Slides | Hudson Surface Technology | PSI 1111000 | type II, 1.1mm/25 each |
| MALDI TOF/TOF 5800 Instrument | AB Sciex | ||
| Desiccator | Sigma-Aldrich | D2797 | tabletop desiccator |
References
- Hankin, J. A., Barkley, R. M., Murphy, R. C. Sublimation as a method of matrix application for mass spectrometric imaging. J. Am. Soc. Mass Spectrom. 18, 1646-1652 (2007).
- Thomas, A., Charbonneau, J. L., Fournaise, E., Chaurand, P. Sublimation of new matrix candidates for high spatial resolution imaging mass spectrometry of lipids: enhanced information in both positive and negative polarities after 1,5-diaminonapthalene deposition. Anal. Chem. 84, 2048-2054 (2012).
- Caughlin, S., et al. Increased Expression of Simple Ganglioside Species GM2 and GM3 Detected by MALDI Imaging Mass Spectrometry in a Combined Rat Model of Aβ Toxicity and Stroke. PLoS ONE. 10, 0130364 (2015).
- Weishaupt, N., Caughlin, S., Yeung, K., Whitehead, S. Differential Anatomical Expression of Ganglioside GM1 Species Containing d18:1 or d20:1 Sphingosine Detected by MALDI Imaging Mass Spectrometry in Mature Rat Brain. Front Neuroanatomy. 9 (155), (2015).
- Whitehead, S., et al. Imaging Mass Spectrometry Detection of Gangliosides Species in the Mouse Brain following Transient Focal Cerebral Ischemia and Long-Term Recovery. PLoS ONE. 6 (6), 20808 (2011).
- Fuchs, B., Süß, R., Schiller, J. An update of MALDI-TOF mass spectrometry in lipid research. Progress in Lipid Research. 49, 450-475 (2010).
- Barceló-Coblijn, G., Fernández, J. A. Mass spectrometry coupled to imaging techniques: the better the view the greater the challenge. Front Physiol. 6 (3), 1-5 (2015).
- Angel, P. M., Spraggins, J. M., Baldwin, H. S., Caprioli, R. Enhanced sensitivity for high spatial resolution lipid analysis by negative ion mode matrix assisted laser desorption ionization imaging mass spectrometry. Anal. Chem. 84, 1557-1564 (2012).
- Murphy, R. C., Hankin, J. A., Barkley, R. M., Zemski Berry, K. A. MALDI imaging of lipids after matrix sublimation/deposition. Biochim. Biophys. Acta. 1811, 970-975 (2011).
- Jaskolla, T. W., Karas, M., Roth, U., Steinert, K. Comparison between vacuum sublimed matrices and conventional dried droplet preparation in MALDI-TOF mass spectrometry. J. Am. Soc. Mass Spectrom. 20, 1104-1115 (2009).
- O’Rourke, M. B., Raymond, B. B., Djordjevic, S. P., Padula, M. P. A versatile cost-effective method for the analysis of fresh frozen tissue sections via matrix-assisted laser desorption/ionisation imaging mass spectrometry. Rapid Commun. Mass Spectrom. 29, 637-644 (2015).
- Patterson, N. H., Thomas, A., Chaurand, P. Monitoring time-dependent degradation of phospholipids in sectioned tissues by MALDI imaging mass spectrometry. J Mass Spectrom. 49, 622-627 (2014).
- Cheng, H., Sun, G., Yang, K., Gross, R. W., Han, X. Selective desorption/ionization of sulfatides by MALDI-MS facilitated using 9-aminoacridine as matrix. J. Lipid Res. 51, 1599-1609 (2010).
- Puolitaival, S. M., Burnum, K. E., Cornett, D. S., Caprioli, R. M. Solvent-free matrix dry-coating for MALDI imaging of phospholipids. J. Am. Soc. Mass Spectrom. 19, 882-886 (2008).
- Chaurand, P., Cornett, D., Angel, P., Caprioli, R. From Whole-body Sections Down to Cellular Level, Multiscale Imaging of Phospholipids by MALDI Mass Spectrometry. Mol Cell Proteomics. 10, (2011).
- Grove, K. J., Frappier, S. L., Caprioli, R. M. Matrix pre-coated MALDI MS targets for small molecule imaging in tissues. J. Am. Soc. Mass Spectrom. 22, 192-195 (2011).
- Yang, J., Caprioli, R. M. Matrix precoated targets for direct lipid analysis and imaging of tissue. Anal. Chem. 85, 2907-2912 (2013).
- Gemperline, E., Rawson, S., Li, L. Optimization and comparison of multiple MALDI matrix application methods for small molecule mass spectrometric imaging. Anal. Chem. 86, 10030-10035 (2014).

