Sublimering av DAN Matrix för detektion och visualisering av gangliosider i råtthjärnvävnad för MALDI Imaging Mass Spectrometry
Summary
A protocol for the sublimation of DAN matrix onto rat brain tissue for the detection of gangliosides using MALDI Imaging Mass Spectrometry is presented.
Abstract
Provberedning är nyckeln för optimal detektion och visualisering av analyter i Matrix-assisted laser desorption / jonisering (MALDI) Imaging masspektrometri (IMS) experiment. Fastställande av lämpligt protokoll för att följa hela provberedningsprocessen kan vara svårt eftersom varje steg måste optimeras för att uppfylla de unika egenskaperna hos de analyter av intresse. Denna process innebär inte bara att hitta en kompatibel matris som kan desorbera och jonisera molekylerna av intresse effektivt, men också välja lämplig matris nedfall teknik. Till exempel, en våt matris avsättningsteknik, som innebär upplösning av en matris i lösningsmedel, är överlägsen för desorption av de flesta proteiner och peptider, medan torra matrisavsättningstekniker är särskilt effektiva för jonisering av lipider. Sublimering har rapporterats som en mycket effektiv metod för torr matrixdeposition för detektion av lipider i vävnad genom MALDI IMS grund av homogeneity matriskristallavsättning och minimal analyt omlokalisering jämfört med många våta deponeringsmetoder 1, 2. I stora drag innebär det att placera ett prov och pulvriserat matris i en vakuumförseglad kammare med proverna pressade mot en kall yta. Anordningen sänkes därefter in i ett uppvärmt bad (sand eller olja), vilket resulterar i sublimering av den pulverformiga matrisen på den kylda vävnadsprovytan. Här beskriver vi en sublime protokoll med 1,5-diaminonaftalen (DAN) matris för detektion och visualisering av gangliosider i råtthjärna med hjälp av MALDI IMS.
Introduction
Matrix-assisterad laserdesorption / jonisering (MALDI) Imaging masspektrometri (IMS) har blivit en eftertraktad teknik för visualisering av den geografiska fördelningen av lipider, peptider och proteiner över intakta provytorna. MALDI IMS var tidigare känd som en analytisk teknik för pre-renade analyter, men under de senaste åren har det varit uppmärksamma på många andra discipliner på grund av möjligheten att kombinera riktigheten i masspektrometri med hög upplösning visuella / anatomiska referenspunkter utan behov av någon extern märkning. Som den vetenskapliga pool av forskare som använder denna teknik fortsätter att växa, är det ökade behovet av standardiserade, enkla att följa protokoll för att underlätta utveckling och optimering av IMS experiment. Gangliosider, en grupp av membranlipider mycket rikligt i det centrala nervsystemet, är idealiska för MALDI IMS experiment som de befinner sig, inbäddade i membranet, gör vissa species omöjligt att detektera med användning av konventionell Immuno-märkning. Dessutom har vi visat, med hjälp av MALDI IMS att dessa lipider, som fungerar som modulatorer av cellsignalering, bland annat, har unika anatomiska fördelningsmönster i friska gnagare hjärnan som förändras efter hjärnskada 3, 4, 5. Gangliosider är belägna på ett högre massområde jämfört med de flesta fettarter, och är därför mest lämpade för MALDI imaging plattform.
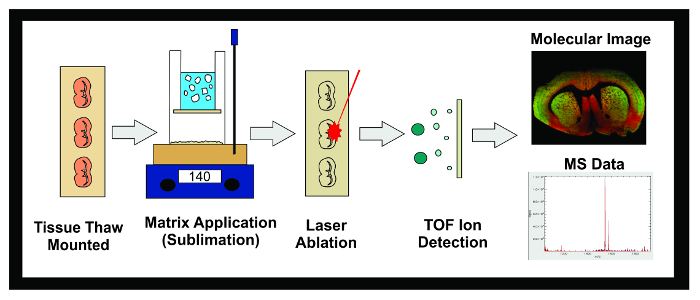
Figur 1: Workflow av MALDI IMS experiment. Diagram över det generella arbetsflödet av en MALDI IMS experiment med sublimering. Vävnaden frystes vid -80 ° C är sektionerad i en kryostat och 10 | j, m sektioner är tö monterade på ledande ITO diabilder. Objektglaset placeras därefter i en exsickator tills sublimering. Slides är införda i sublimeringsapparat och ett jämnt lager av matris appliceras på vävnadsprovytan. Proverna fryses över natt i en -20 ° C frys placerades sedan i en torkapparat under 10 min. När standarder har tillämpats, är proverna insattes i MALDI instrumentet där en laser riktas tvärs vävnaden orsakar desorberade molekylerna i matrisen för att jonisera. Jonerna resa ned en flygning rör och separat baserat på deras massa (time-of-flight / TOF) tills de når detektorn. Informationen på den joniska överflöd av analyter inom ett förutbestämt massa-till-laddning (m / z) området visas som både en molekyl bilden och masspektrum. Dessa data kan användas för att både visualisera och kvantifiera den joniska överflöd av analyten av intresse i den avbildade vävnaden. Klicka här för att se en större version av denna siffra.
provberedningför MALDI IMS är mycket varierande eftersom varje steg i processen måste anpassas till analyter av intresse. Det utmärkande drag för MALDI-baserade experiment är användningen av ett matrisbeläggning avsattes på provytan före analys. Utöver rollen att absorbera och överföra strålningsenergi från lasern under ablationsprocessen, matrisen tjänar också till att isolera olika analyter från provet och därigenom underlätta analysen av föreningar av intresse 6, 7. Enhetlig tillämpning av matrisen till provytan är det mest avgörande steget i provberedningsprocessen. Felaktig matrisavsättning kan leda till stora heterogena matris kristall formationer och utvecklingen av artefakter, låg jon-signal, och dålig reproducerbarhet 7.
På grund av affiniteten av vissa matriser för att isolera specifika analyter, typen av matris ut för ett experiment kansignifikant förändra resultatet. Matriserna som används för avbildning av proteiner och peptider skiljer sig ofta från dem som används för avbildning lipider och processen kompliceras ytterligare av behovet av ytterligare förfaranden såsom tvätt- och rehydrering åtgärder för att framgångsrikt detektera signaler från vävnad. Även tvättsteg finns för att höja lipid signaler 8, är de inte en förutsättning för att upptäcka de flesta lipid arter. Vid val av en matris för en lipid avbildningsexperiment, är det viktigt att beakta polariteten hos lipiden av intresse eftersom detta kommer att begränsa området av lämpliga matriser. Till exempel, gangliosider innehåller sialinsyrarester som ger dem en total negativ polaritet. Det finns ett antal matriser som effektivt kan desorbera och joniserar gangliosider från vävnad; måste emellertid faktorer såsom matrishärledda toppar i spektrum och stabilitet hos matrisen under vakuum tas under övervägande. 1,5-diaminonaftalen (DAN) matrisen är tillräckligt stabil under instrumentvakuumförhållanden för de flesta av bildprogram och har visat en hög grad av känslighet för lipid desorption och kan användas för analys av lipider i både positiva och negativa joner lägen 2. DAN matris, jämfört med andra negativa lipid affinitetsmatriser såsom dihydroxibensoesyra (DHB), 9-aminoakridin (9-AA), och 5-kloro-2-merkaptobensotiazol (CMBT), kunde mest effektivt desorbera gangliosider från råtthjärna vävnad i negativ jon-läge (manuskript under utarbetande).
Välja lämplig metod för matrixdeposition är lika viktigt att välja själva matrisen. Våta matrisdeponeringsmetoder varvid den fasta matrisen är lösta i ett organiskt lösningsmedel, och som deponeras av pneumatisk eller automatiserade sprutor eller spotters, är särskilt effektiva för desorption av proteiner och peptider när vätskan tränger provet för att möjliggöra för extraInsatser av föreningar och sam-kristallisation med matrisen. Även om dessa tekniker kan också användas för lipid-applikationer, analytdelokalise och ojämn matriskristallformationer är vanligt förekommande på grund av den höga förekomst och lösligheten av lipider i lösningsmedel, särskilt i vävnad 2, 9. Eftersom lipider lätt joniseras från vävnad, torra matrisavsättningstekniker, såsom sublimering, erbjuder en enkel, kostnadseffektiv alternativ till sprutor samtidigt som den kringgår många av nackdelen av dessa tekniker. Framgången för sublimering i MALDI IMS experiment tillskrivs funktioner såsom mikromatris morfologi, vilket ökar ytan för matrisanalytbindande, ökad matris renhet och homogen matris nedfall leder till ökad reproducerbarhet jämfört med våta matristeknik 1, 10.
sublime involves uppvärmning av en pulveriserad matris under vakuum omedelbart under en kyld provytan vilket resulterar i fast till gas-fas övergång av den pulveriserade matrisen följt av avsättning på vävnadsprov ytan. Under sublimering, kan matrixdeposition styras genom varierande faktorer såsom tid, temperatur och tryck för att ge mycket reproducerbara resultat. En enda sublime experiment kan ta allt från 5 till 20 minuter, beroende på vilken typ av matris vald, som kan återanvändas flera gånger innan den kasseras. Apparaten kan köpas i handeln till en bråkdel av priset för automatiserade sprutor och lätt tas isär för rengöring och underhåll. Den låga kostnaden och den relativa enkelheten i denna matris nedfall teknik gör den idealisk för forskare börjar eller expandera på lipid bildprogram i MALDI IMS. Även uppgifter med uppgifter protokoll för sublimering av vävnader för IMS har rapporterats 11, några standardiserade protokoll finns which fokusera på den grundläggande arbetsflöde som arbetar med att genomföra en sublimeringsexperiment för avbildning med hög mass lipider i negativ jon-läge, vilket gör det svårt att fastställa tekniken utan omfattande försök och misstag. Följande är ett experimentellt protokoll som syftar till att fylla denna lucka för sublimering av DAN matris på råtthjärnsektioner för högupplösande avbildning och detektering av gangliosider.
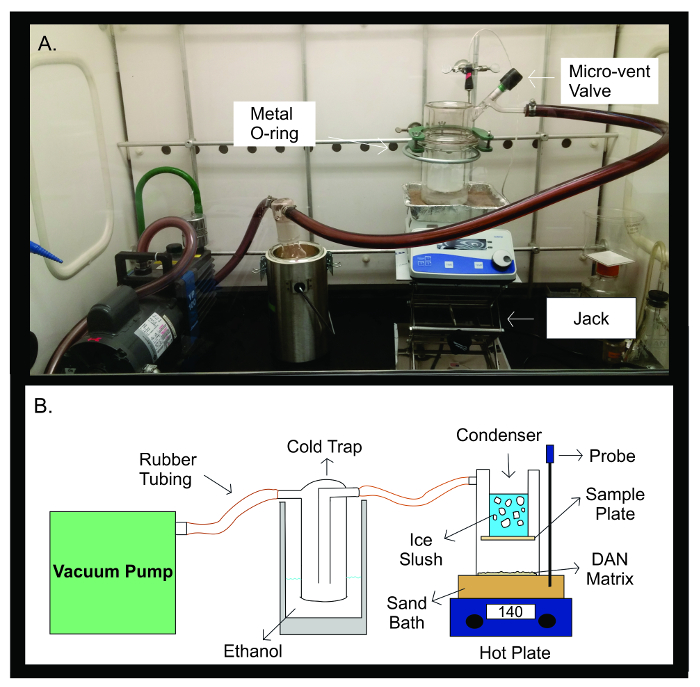
Figur 2: Sublimerings Apparatus. Fotografi (A) och schematiskt diagram (B) i sublimeringsapparaten. Vakuumpumpen är ansluten med gummislangen till en köldfälla fylld med 300 ml etanol. Köldfällan ansluts sedan genom gummislangen till sublimeringsapparaten. Anordningen består av två separata delar av glasvaror som har förseglats tillsammans med en metall U-fog. Den övre halvan av den sublimatorinnehåller kondensorn som är fylld med issörja. Provplattan är tejpade på botten av kondensorn, inuti den förslutna glasapparaturen. Den nedre halvan av den sublimeapparaten innehåller den DAN matrisen, utspridda jämnt vänd mot provplattan. Under sublimering, är glasapparaturen placeras på ett sandbad upphettades till 140 ° C med en värmeplatta direkt under den. Temperatursonden hjälper till att bibehålla en stabil temperatur under sublimeringsexperiment genom återkoppling av sandbadet temperatur jämfört med den förinställda temperaturen för experimentet. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
Detta arbete detaljer ett standardiserat protokoll av matrissublime på vävnad för detektering av negativt laddade lipider, såsom gangliosider, i MALDI IMS experiment. Provberedning för MALDI IMS är mycket varierande och måste anpassas för att passa de unika egenskaperna hos målanalyten. Tillämpningen av matris på vävnadsprov ytan är en viktig aspekt av provberedningsprocessen med avseende på kvaliteten på resultaten i IMS. Särskild försiktighet bör iakttas vid val av matriser, se till att matrisen är …
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge the technical assistance of Kristina Jurcic in the University of Western Ontario MALDI MS facility, as well as the National Sciences and Engineering Council (NSERC) for funding this work. The authors would also like to acknowledge the Caprioli group (Vanderbilt University, TN) and Chaurand group (Université de Montreal, QC) for their advice in optimizing the sublimation technique presented in this manuscript.
Materials
| Sublimator | Chemglass Life Sciences | CG3038-01 | |
| 1,5- Diaminonapthalene (DAN) matrix | Sigma-Aldrich | D21200 | 100 G |
| Cryostat | Thermo-Fisher Scientific | CryoStar NX50 | |
| Hot plate with temperature feedback | Thermo-Fisher Scientific | HP88857290 | Isotemp ADVD 7×7 HP 100-120v |
| Stainless Steel Jack | Thermo-Fisher Scientific | 2216479 | 10×10 |
| Cold Trap | Custom built on site | ||
| Vacuum Pump | Franklin Electric | 1102180403 | Savant VP100 Two Stage |
| Indium-tin-oxide (ITO) Slides | Hudson Surface Technology | PSI 1111000 | type II, 1.1mm/25 each |
| MALDI TOF/TOF 5800 Instrument | AB Sciex | ||
| Desiccator | Sigma-Aldrich | D2797 | tabletop desiccator |
References
- Hankin, J. A., Barkley, R. M., Murphy, R. C. Sublimation as a method of matrix application for mass spectrometric imaging. J. Am. Soc. Mass Spectrom. 18, 1646-1652 (2007).
- Thomas, A., Charbonneau, J. L., Fournaise, E., Chaurand, P. Sublimation of new matrix candidates for high spatial resolution imaging mass spectrometry of lipids: enhanced information in both positive and negative polarities after 1,5-diaminonapthalene deposition. Anal. Chem. 84, 2048-2054 (2012).
- Caughlin, S., et al. Increased Expression of Simple Ganglioside Species GM2 and GM3 Detected by MALDI Imaging Mass Spectrometry in a Combined Rat Model of Aβ Toxicity and Stroke. PLoS ONE. 10, 0130364 (2015).
- Weishaupt, N., Caughlin, S., Yeung, K., Whitehead, S. Differential Anatomical Expression of Ganglioside GM1 Species Containing d18:1 or d20:1 Sphingosine Detected by MALDI Imaging Mass Spectrometry in Mature Rat Brain. Front Neuroanatomy. 9 (155), (2015).
- Whitehead, S., et al. Imaging Mass Spectrometry Detection of Gangliosides Species in the Mouse Brain following Transient Focal Cerebral Ischemia and Long-Term Recovery. PLoS ONE. 6 (6), 20808 (2011).
- Fuchs, B., Süß, R., Schiller, J. An update of MALDI-TOF mass spectrometry in lipid research. Progress in Lipid Research. 49, 450-475 (2010).
- Barceló-Coblijn, G., Fernández, J. A. Mass spectrometry coupled to imaging techniques: the better the view the greater the challenge. Front Physiol. 6 (3), 1-5 (2015).
- Angel, P. M., Spraggins, J. M., Baldwin, H. S., Caprioli, R. Enhanced sensitivity for high spatial resolution lipid analysis by negative ion mode matrix assisted laser desorption ionization imaging mass spectrometry. Anal. Chem. 84, 1557-1564 (2012).
- Murphy, R. C., Hankin, J. A., Barkley, R. M., Zemski Berry, K. A. MALDI imaging of lipids after matrix sublimation/deposition. Biochim. Biophys. Acta. 1811, 970-975 (2011).
- Jaskolla, T. W., Karas, M., Roth, U., Steinert, K. Comparison between vacuum sublimed matrices and conventional dried droplet preparation in MALDI-TOF mass spectrometry. J. Am. Soc. Mass Spectrom. 20, 1104-1115 (2009).
- O’Rourke, M. B., Raymond, B. B., Djordjevic, S. P., Padula, M. P. A versatile cost-effective method for the analysis of fresh frozen tissue sections via matrix-assisted laser desorption/ionisation imaging mass spectrometry. Rapid Commun. Mass Spectrom. 29, 637-644 (2015).
- Patterson, N. H., Thomas, A., Chaurand, P. Monitoring time-dependent degradation of phospholipids in sectioned tissues by MALDI imaging mass spectrometry. J Mass Spectrom. 49, 622-627 (2014).
- Cheng, H., Sun, G., Yang, K., Gross, R. W., Han, X. Selective desorption/ionization of sulfatides by MALDI-MS facilitated using 9-aminoacridine as matrix. J. Lipid Res. 51, 1599-1609 (2010).
- Puolitaival, S. M., Burnum, K. E., Cornett, D. S., Caprioli, R. M. Solvent-free matrix dry-coating for MALDI imaging of phospholipids. J. Am. Soc. Mass Spectrom. 19, 882-886 (2008).
- Chaurand, P., Cornett, D., Angel, P., Caprioli, R. From Whole-body Sections Down to Cellular Level, Multiscale Imaging of Phospholipids by MALDI Mass Spectrometry. Mol Cell Proteomics. 10, (2011).
- Grove, K. J., Frappier, S. L., Caprioli, R. M. Matrix pre-coated MALDI MS targets for small molecule imaging in tissues. J. Am. Soc. Mass Spectrom. 22, 192-195 (2011).
- Yang, J., Caprioli, R. M. Matrix precoated targets for direct lipid analysis and imaging of tissue. Anal. Chem. 85, 2907-2912 (2013).
- Gemperline, E., Rawson, S., Li, L. Optimization and comparison of multiple MALDI matrix application methods for small molecule mass spectrometric imaging. Anal. Chem. 86, 10030-10035 (2014).

