Anvendelse av høyhastighets super-oppløsning hastighet mikroskopi i Live primære Flimmerhår
Summary
Nylig kartlagt vi tredimensjonale (3D) romlige plasseringen av transportveier for ulike proteiner translocating inne primære flimmerhårene i lever celler. Her live denne papir detaljer eksperimentelle oppsett, prosessen med biologiske prøver og data-analyser for 3D super-oppløsning fluorescens imaging tilnærming nylig brukt i primære flimmerhårene.
Abstract
Den primære Flimmerhår er en microtubule-baserte protrusion på overflaten av mange eukaryote celler og inneholder et unikt tilbud av proteiner som fungerer kritisk i cellen motilitet og signalering. Siden flimmerhårene er i stand til å syntetisere sin egen protein, må nesten 200 unike ciliary proteiner være trafikkerte mellom stoffer og primære flimmerhårene. Men det er fortsatt en teknisk utfordring å kartlegge tredimensjonale (3D) steder av transport for disse proteinene i live primære flimmerhårene på grunn av begrensningene av aktuelle eksisterende teknikker. For å erobre utfordringen, har nylig vi utviklet og ansatt en høyhastighets virtuelle 3D super-oppløsning mikroskopi, kalt ett-punkts kanten-eksitasjon sub Diffraksjon (hastighet) mikroskopi, for å finne transport trasé for 3D romlige hvor begge cytosolic og membran proteiner i primære flimmerhårene levende celler. I denne artikkelen vil vi vise detaljert oppsett av hastighet mikroskopi, utarbeidelse av celler som uttrykker fluorescens-protein-merket ciliary proteiner, enkelt-molekylet sanntidssporing av personlige proteiner i live Flimmerhår og prestasjoner 3D romlige sannsynlighet tetthet kart av transportveier for ciliary proteiner.
Introduction
Siden oppgitt av Ernst Abbe i 1873, har oppløsningen av konvensjonelle * lys vært antatt å være begrenset til ca 200 nm på grunn av lys Diffraksjon fra objektive1,2. Foreløpig super-oppløsning * lys teknikker bryte denne begrensningen og tillate fangst av dynamiske bilder med sub Diffraksjon (< 200 nm) oppløsning. Teknikkene generelt faller inn i to hovedkategorier: stimulert utslipp nedbryting (STED) mikroskopi basert tilnærminger, som genererer sub Diffraksjon belysning volum på grunn av lineære optisk reaksjon av fluorophores i prøver3; og photoactivated * lys (PALM) og Stokastisk optisk rekonstruksjon mikroskopi (STORM)-basert super-oppløsning teknikker, som bruker matematiske funksjoner for å lokalisere centroids av fluorophores og deretter gjeninnføre disse centroids til super-oppløsning bilder4,5. For tiden, på grunn av relativt ukomplisert optisk stilling, er PALM og STORM mye ansatt av bare en undergruppe av fluorophores i hvert en lang video av en biologisk forberedelse. Dette gir mer nøyaktig lokalisering av 2D Gaussian montering av lysrør stedet, kalt funksjonen Poenget spredning (PSF), fluorescently-merket proteiner i rammene av videoen. 2D plasseringen av hver fluorescently-merket molekyl kan deretter bli oppå et enkelt tenkelig fly å produsere en super-oppløsning bildet av biologiske forberedelse1,2. Mens disse single-molekylet lokalisering, super-oppløsning tilnærminger til mikroskopi sikkert revolusjonert hvordan avbilding av biologiske prøver ble utført, det er fortsatt utfordringer å overvinne. For eksempel kan STORM og PALM oppnå sine beste romlig oppløsning etter fiksering av biologiske prøver og dermed presentere en statisk fremstilling av fluorescently-merket proteiner, som er en lignende begrensning av elektronmikroskop. I tillegg for å oppnå høy romlig oppløsning for hver fluorescently-merket protein i lever celler, må prøver avbildes på svært lang framerates som ikke kan fange protein dynamics. Derfor er det nødvendig å overvinne disse viktigste tekniske hindrene.
For å oppnå en høy spatiotemporal oppløsning som er velegnet for å oppdage raske proteiner eller RNAs i levende celler, har vi utviklet super-oppløsning mikroskopi hastighet i vårt laboratorium (figur 1)6,7, 8. flere store tekniske fremskritt i hastighet mikroskopi tidligere har aktivert oss å spore nucleocytoplasmic transport av små molekyler, proteiner, mRNA og virus igjennom innfødt kjernefysiske pore komplekser (NPC)6, 7 , 8. kort, følgende funksjoner i hastighet mikroskopi brukes til å spore raske makromolekyler gjennom sub mikrometer rotasjons symmetrisk strukturer i levende celler, for eksempel NPCer og primære flimmerhårene: (1) en tilbøyelig eller vertikal belysning PSF gjør magnetisering av enkelt molekyler innenfor et lite Diffraksjon limit volum i fokalplanet (figur 1). (2) tilbøyelig PSF kan unngå sterkt ut-av-fokus fluorescens og dermed forbedre signal-til-støy-forhold. (3) optisk tetthet på 100-500 kW / cm2 i belysning PSF lar tusenvis av fotoner inn fra enkelt fluorophores med rask oppdagelsen hastigheter (> 500 Hz). (4) rask oppdagelsen hastighet også reduserer single-molekylet romlige lokalisering feilen (< 10 nm) å bestemme romlige baner av flytte fluorescerende molekyler i levende celler, fordi Diffusjon er en av viktigste faktorene forårsaker feil av enkelt-molekylet lokalisering for å flytte molekyler. (5) well-established 2D til 3D transformasjon algoritmer gir oss å gi 3D romlige sannsynlighet tetthet kart av transportveier for molekyler i NPC eller den primære Flimmerhår. Det er bemerkelsesverdig at våre konverteringen mellom det kartesiske og sylindriske koordinering systemet brukes til å generere en 3D romlige sannsynlighet tetthet kart i stedet for 3D single-molekylet sporing (figur 2). Tidligere har elektronmikroskop data avdekket at NPC9,10 og primære Flimmerhår11 begge har en rotasjons symmetrisk struktur. I prinsippet bør tilfeldig spre molekyler flytte gjennom NPC eller primære Flimmerhår også ha rotasjons symmetrisk distribusjoner. Som vist i figur 2, et høyt antall tilfeldig spre molekyler inne i sylinderen vil generere rotasjons symmetrisk distribusjoner på tverrsnittvisningen som i NPC, ytterligere resulterer i en ca uniform romlige distribusjon i hver liten sub region mellom to nabokommunene ringene (figur 2E). Denne jevn fordeling fører at den romlige fordelingen langs θ dimensjon i sylindriske systemet er konstant. Deretter kan 3D-koordinatene (R, X, θ) forenkles skal 2D-koordinater (R, X, konstant). Egentlig er vår konverteringen mellom det kartesiske og sylindriske systemer fra 2D (X, Y) til 2D (R, X, konstant). Den konstant θ, refererer til de romlige tetthet p i figur 2E, beregnes ved hjelp av ligning A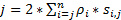 .
.
Til slutt, enkelt-molekylet sporing har bred anvendelse i biologiske, dermed er det naturlig at en mengde teknikker vil bli utviklet for å fylle spesifikke biologiske nisjer12,13,14. Slik er tilfellet med hastighet mikroskopi. Tidligere, når kombinert med en 3D transformasjon algoritme, denne teknikken ble utviklet for å løse 3D transport ruter av transitt molekyler gjennom NPCer, en sub-diffraction-størrelse og rotasjons symmetrisk biologiske struktur6. I dette papiret vist primære flimmerhårene å være utmerket modell organeller også. Primære flimmerhårene er sylindrisk, antenne-lignende organelles (~ 125 nm radius) at prosjektet fra overflaten av mest pattedyr celler15,16,17. De er ansvarlig for å motta eksterne signaler og oversender en intracellulær respons vanligvis assosiert med vekst og metabolisme15,16. Derfor flux strukturelle proteiner, resirkulering av transmembrane reseptorer, og overføring av intracellulær budbringere er viktig ansvar primære flimmerhårene. Tidspunktet mellom primære flimmerhårene og celle kroppen er en kritisk selektivitet barriere, kalt overgang sone eller TZ, som alle denne protein transporten må være11,18,19, 20. I tillegg til TZ gating funksjon antas minst to transport prosesser, intraflagellar transport og passiv diffusjon, å være ansvarlig for flytting av protein gjennom denne regionen16,21, 22. fra en helse-synspunkt, tap av primære flimmerhårene og påfølgende dereguleringen nedstrøms signalnettverk er karakteristisk for mange kreft. I tillegg er mange genetiske sykdommer, som Bardet-Biedl syndrom og polycystic nyresykdom, forbundet med defekt protein transport23. Både sub Diffraksjon grensen størrelse og den komplekse prosessen med selektiv protein transport gjennom til TZ gjør primære flimmerhårene en ettertraktet mål for denne teknikken. I denne metoder papir, vil vi vise sporing av en ciliary transmembrane protein, somatostatin reseptor 3 (SSTR3)24, merket eksternt med Alexa Fluor 647 og en del av IFT, IFT2025, merket med et smeltet GFP molekyl.
Protocol
Representative Results
Discussion
Denne protokollen beskriver bruken av hastighet mikroskopi til den primære Flimmerhår, en cellular signalnettverk organelle som er svært avhengig av effektiv protein transport. HASTIGHET mikroskopi kan gi høy oppløsning (< 10 nm) steder for fluorescently-merket molekyler idet de passerer gjennom enkeltpunkt belysning sentrert på TZ. Tidligere har det vært brukt for å studere protein smuglingen via NPC6,7,8. Men kan det u…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi takker Dr. Kristen Verhey (University of Michigan, Ann Arbor) og Dr. Gregory Pazour (University of Massachusetts Medical School) for å gi noen plasmider. Prosjektet ble støttet av tilskudd fra National Institutes of Health (NIH GM097037, GM116204 og GM122552 til W.Y.).
Materials
| 25 cm2 tissue culture dish | Corning | VV-01936-00 | |
| Penicillin/streptomycin | ThermoFisher | 15140122 | |
| Fetal bovine serum | ThermoFisher | 10438018 | |
| DMEM | ThermoFisher | 10566-016 | |
| OPTIMEM | ThermoFisher | 31985062 | |
| Trypsin | ThermoFisher | 25300054 | |
| Phosphate buffered saline | Sigma-Aldrich | P3813-1PAK | |
| Transit LT1 | Mirus | MIR 2300 | |
| 35 mm glass bottom dish | MatTek | P35GCOL-0-14-C | |
| AlexaFluor 647-conjugated streptavidin | ThermoFisher | S21374 | |
| Biotin | Sigma-Aldrich | B4501-100MG | |
| 633 nm He-Ne laser | Melles Griot | 25-LHP-928-249 | |
| 561 nm solid state laser | Coherent | OBIS 561-50 LS | |
| 488 nm solid state laser | Coherent | 1185053 | |
| Inverted fluorescence microscope | Olympus | IX81 | |
| 1.4-NA 100× oil-immersion apochromatic objective | Olympus | UPLSAPO 100× | |
| On-chip multiplication gain charge-coupled-device camera | Roper Scientific | Cascade 128+ | |
| Dichroic filter | Semrock | Di01- R405/488/561/635-25×36 | |
| Emission filter | Semrock | NF01-405/488/561/635-25X5.0 | |
| Slidebook 6.0 | Intelligent Imaging Innovations | digital microscopy software |
References
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu Rev Biochem. 78, 993-1016 (2009).
- Leung, B. O., Chou, K. C. Review of super-resolution fluorescence microscopy for biology. Appl Spectrosc. 65, 967-980 (2011).
- Willig, K. I., Rizzoli, S. O., Westphal, V., Jahn, R., Hell, S. W. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis. Nature. 440, 935-939 (2006).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313, 1642-1645 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Meth. 3, 793-796 (2006).
- Ma, J., Yang, W. Three-dimensional distribution of transient interactions in the nuclear pore complex obtained from single-molecule snapshots. Proc Natl Acad Sci USA. 107, 7305-7310 (2010).
- Ma, J., Goryaynov, A., Sarma, A., Yang, W. Self-regulated viscous channel in the nuclear pore complex. Proc Natl Acad Sci USA. 109, 7326-7331 (2012).
- Ma, J., et al. High-resolution three-dimensional mapping of mRNA export through the nuclear pore. Nat Comm. 4, (2013).
- Akey, C. W., Radermacher, M. Architecture of the Xenopus nuclear pore complex revealed by three-dimensional cryo-electron microscopy. J Cell Biol. 122, 1-19 (1993).
- Akey, C. W. Interactions and structure of the nuclear pore complex revealed by cryo-electron microscopy. J Cell Biol. 109, 955-970 (1989).
- Czarnecki, P. G., Shah, J. V. The ciliary transition zone: from morphology and molecules to medicine. Trends Cell Biol. 22, 201-210 (2012).
- Elf, J., Li, G. -. W., Xie, X. S. Probing transcription factor dynamics at the single-molecule level in a living cell. Science. 316, 1191-1194 (2007).
- Anzalone, A., Annibale, P., Gratton, E. 3D orbital tracking in a modified two-photon microscope: an application to the tracking of intracellular vesicles. J Vis Exp. , (2014).
- Ritter, J. G., Veith, R., Veenendaal, A., Siebrasse, J. P., Kubitscheck, U. Light sheet microscopy for single molecule tracking in living tissue. PloS one. 5, 11639 (2010).
- Marshall, W. F., Nonaka, S. Cilia: tuning in to the cell’s antenna. Curr Biol. 16, 604-614 (2006).
- Scholey, J. M., Anderson, K. V. Intraflagellar transport and cilium-based signaling. Cell. 125, 439-442 (2006).
- Yang, T. T., et al. Superresolution pattern recognition reveals the architectural map of the ciliary transition zone. Sci Rep. 5, 14096 (2015).
- Craige, B., et al. CEP290 tethers flagellar transition zone microtubules to the membrane and regulates flagellar protein content. J Cell Biol. 190, 927-940 (2010).
- Kee, H. L., et al. A size-exclusion permeability barrier and nucleoporins characterize a ciliary pore complex that regulates transport into cilia. Nat Cell Biol. 14, 431-437 (2012).
- Najafi, M., Maza, N. A., Calvert, P. D. Steric volume exclusion sets soluble protein concentrations in photoreceptor sensory cilia. Proc Natl Acad Sci USA. 109, 203-208 (2012).
- Nachury, M. V., Seeley, E. S., Jin, H. Trafficking to the ciliary membrane: how to get across the periciliary diffusion barrier. Annu Rev Cell Dev Biol. 26, 59-87 (2010).
- Ye, F., et al. Single molecule imaging reveals a major role for diffusion in the exploration of ciliary space by signaling receptors. Elife. 2, 00654 (2013).
- Ross, A. J., et al. Disruption of Bardet-Biedl syndrome ciliary proteins perturbs planar cell polarity in vertebrates. Nat Genetics. 37, 1135-1140 (2005).
- Handel, M., et al. Selective targeting of somatostatin receptor 3 to neuronal cilia. Neuroscience. 89, 909-926 (1999).
- Follit, J. A., Tuft, R. A., Fogarty, K. E., Pazour, G. J. The intraflagellar transport protein IFT20 is associated with the Golgi complex and is required for cilia assembly. Mol Biol Cell. 17, 3781-3792 (2006).
- Awata, J., et al. NPHP4 controls ciliary trafficking of membrane proteins and large soluble proteins at the transition zone. J Cell Sci. 127, 4714-4727 (2014).
- Howarth, M., Ting, A. Y. Imaging proteins in live mammalian cells with biotin ligase and monovalent streptavidin. Nat Protoc. 3, 534-545 (2008).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-dimensional super-resolution imaging by stochastic optical reconstruction microscopy. Science. 319, 810-813 (2008).

