Confocale microscopie onthult cel oppervlakte Receptor aggregatie via afbeelding correlatie spectroscopie
Summary
Antilichamen die zich aan target receptoren van het celoppervlak binden kunnen verlenen bevleesdheid en clustering wijzigingen. Deze dynamische veranderingen hebben gevolgen voor het karakteriseren van Geneesmiddelenontwikkeling in de doelcellen. Dit protocol maakt gebruik van de confocal microscopie en afbeelding correlatie spectroscopie via ImageJ/FIJI te kwantificeren van de omvang van de receptor clustering op het celoppervlak.
Abstract
Confocale microscopie biedt een toegankelijke methode om vast te leggen van cruciaal belang voor de karakterisering en de verdere ontwikkeling van pre-klinische agenten gelabeld met de fluorescerende sondes sub cellulaire interacties. Met de recente vooruitgang in antilichaam gebaseerd cytotoxische drug is levering systemen, inzicht in de wijzigingen veroorzaakt door deze agenten binnen het domein van de receptor aggregatie en internalisering van cruciaal belang. Dit protocol borduurt voort op de gevestigde methodologie van fluorescerende immunocytochemie en de verdeling van de opensource-FIJI voor ImageJ, met zijn ingebouwde autocorrelatie en de afbeelding wiskundige functies, voor het uitvoeren van ruimtelijke beeld correlatie spectroscopie (ICS). Dit protocol kwantificeert de fluorescerende intensiteit van gelabelde receptoren als een functie van de ruimte van de lichtbundel van de confocal microscoop. Dit biedt een kwantitatieve meting van de Braziliaanse deelstaat doel molecuul aggregatie op het celoppervlak. Deze methode is gericht op de karakterisatie van statische cellen met potentieel uit te breiden in temporele onderzoeken van receptor aggregatie. Dit protocol biedt een toegankelijk methodologie om een kwantificering van clustering van gebeurtenissen die plaatsvinden op het celoppervlak, technieken en niet-gespecialiseerde beeldvormende apparatuur met behulp van goed gevestigd.
Introduction
De ontwikkeling van therapeutische antistoffen heeft aangetoond opmerkelijke succes in de behandeling van meerdere tumor type1. De recente ontwikkelingen op het gebied van geconjugeerde (ADC) van de antilichaam-drug oppervlakte zoals uitvoeringsmechanismen voor cytotoxische stoffen heeft de eisen voor het begrip van de dynamiek van antilichaam: receptor interakties bij de cel uitgebreid2. Na de succesvolle targeting op van een antilichaam aan de cel-oppervlakte receptor, kunnen deze complexen veroorzaken vergelijkbare aggregatie patronen die waargenomen in ligand: antilichaam interacties3. Wijzigingen in de receptor aggregatie kunnen leiden tot wijzigingen in het membraan en het resultaat in de internalisering van de receptor en de verwijdering van het celoppervlak. In het kader van een geconjugeerde antilichaam-drug vrij dit proces vervolgens de cytotoxische nettolading in verinnerlijkte Endosomen en vervolgens het cytoplasma, resulterend in effectieve cel doden.
Confocale microscopie heeft een doeltreffend middel voor het visualiseren van deze belangrijke interacties van antilichamen en hun doel receptoren4verstrekt. Voor het verkennen van de veranderingen van de samenvoeging van de doelmolecule op het celoppervlak dit protocol maakt gebruik van nabewerking van confocale microscopie beelden via een ruimtelijk beeld correlatie spectroscopie (ICS) techniek 5,6,7 .
De Stichting voor beeld correlatie spectroscopie is de waarneming dat schommelingen van de intensiteit van de ruimtelijke fluorescentie een relatie met de dichtheid en de aggregatie-staat van de gelabelde structuren delen. Deze relatie komt tot stand na de berekening van de autocorrelatiefunctie van een ruimtelijke van een opname-5.
Alle varianten van afbeelding correlatie spectroscopie vereisen de berekening van de autocorrelatie van een afbeelding. Dit wordt gevolgd door het aanbrengen van deze functie een tweedimensionale Gauss-curve voor de extractie van kwantitatieve aggregatie-staat parameters opgenomen binnen het besturingselement image. In eenvoudige termen de berekening van de autocorrelatie van een afbeelding gaat vergelijken alle de mogelijke pixel paren deel uitmaakt van een afbeelding en het berekenen van de kans dat beide even zo helder als elkaar. Dit is als een functie van de afstand en richting van pixel scheiding8gevisualiseerd.
Het theoretisch kader voor de afbeelding correlatie spectroscopie werd vastgesteld en gedefinieerd door Petersen en Wiseman et al. 5 , 6. in dit protocol, de autocorrelatie berekeningen worden uitgevoerd in Fiji/ImageJ evenals een spreadsheetprogramma, de basis voor de intensiteit schommelingen ruimtelijke autocorrelatiefunctie kan worden omschreven als (Eq 1):
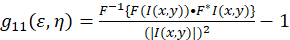
waar F vertegenwoordigt de Fourier-transformatie; F−1 de inverse Fourier transform; F * de complex geconjugeerde; en de ruimtelijke lag variabelen ε en η. In ruimtelijke ICS, zoals beschreven in dit protocol, kan de autocorrelatiefunctie worden berekend met behulp van een 2D snelle Fourier transform algoritme7,9. De autocorrelatiefunctie op nul ruimtelijke scheiding ook wel bekend als nul-lag, g11(0,0), biedt het omgekeerde gemiddelde aantal deeltjes per oppervlakte-straal van de Microscoop aanwezig. Het kan worden verkregen door het aanbrengen van de ruimtelijke autocorrelatiefunctie naar een tweedimensionale Gauss functie (Eq 2):
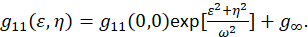
Als de pixels gevangen binnen een afbeelding binnen een set gebied zijn opgenomen en deze metingen niet uit te tot in het oneindige breiden doen, wordt de term g∞ gebruikt als een compensatie voor lange-afstands ruimtelijke correlaties die deel uitmaakt van de afbeelding. Voor moleculaire en middelgrote aggregaten, ω is de functie van de punt-spread van de Microscoop en beschreven door de volle breedte op half-maximale van de ruimtelijk autocorrelatiefunctie. Het gebied dat deel uitmaakt van het punt verspreiden-functie van het instrument kan worden gekalibreerd met behulp van sub resolutie fluorescerende kralen.
Voor de afbeelding correlatie spectroscopie protocol hierin beschreven, worden de autocorrelatie en wiskundige functies vereist voor het voltooien van de Internet-verbinding delen uitgevoerd met behulp van de open-sourceplatform imaging-verwerking, Fiji10, een verdeling van de ImageJ programma11,12. Fiji/ImageJ maakt gebruik van de vooraf geïnstalleerde snelle Fourier-transformatie in de FFT Math-functie. Deze functie vermindert de compute tijd die nodig is voor deze berekening door vermindering van het gegevensbereik met een factor twee in elke dimensie13. Zoals de 2D autocorrelatiefunctie ongeveer symmetrisch in x, y-as is kan een enkellijns profiel perceel door het beeld van de autocorrelatie worden gebruikt voor het meten van de ruwe autocorrelatie als een functie van de ruimtelijke lag. Geen nul-lag-geluid wordt verwijderd voorafgaand aan verdere berekening, met de daaruit voortvloeiende autocorrelatie amplitude (piekwaarde, g(0)T) gecorrigeerd voor de achtergrond met de expressie (Eq-3):
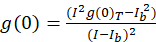
waar ikb is de gemiddelde intensiteit van een gebied op de achtergrond met uitzondering van de cel. De cluster densiteit of dichtheid van fluorescente voorwerpen, wordt gedefinieerd door (Eq 4):
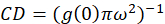
In het protocol hierin beschreven, verder we gewoon de berekening van de dichtheid van het cluster (CD), met de veronderstelling gebaseerd op de observatie dat een genormaliseerde autocorrelatiefunctie zal vergaan op een waarde 1.0 met toenemende ruimtelijke lag naderen. Met maximale ruimtelijke vertraging, er is niet langer een correlatie van fluorescentie intensiteitswaarden en dus zonder een correlatie zijn de berekeningen op deze regio computing de waarde van een intensiteit vermenigvuldigd met deze intensiteit die wordt vervolgens gedeeld door de kwadraat van die intensiteit, die per definitie gelijk is aan 1,0. Dus, kan de cluster dichtheid van een genormaliseerde autocorrelatiefunctie door af te trekken 1.0 van de genormaliseerde autocorrelatiefunctie alvorens de wederkerige (Eq 5)worden berekend:
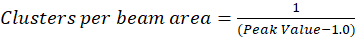
Verdere kalibratie van de lichtbundel gebied kan worden uitgevoerd om het kwantificeren van het aantal clusters deel uitmaakt van het gebied van het punt verspreiden-functie van het instrument. Dit moet worden gekalibreerd met behulp van dezelfde optische voorwaarden gebruikt tijdens de beeldanalyse correlatie spectroscopie.
Protocol
Representative Results
Discussion
De techniek van de afbeelding correlatie spectroscopie (ICS) die we in dit protocol beschrijven maakt gebruik van standaard confocal microscopen zonder de behoefte aan gespecialiseerde detectoren. De techniek van de Internet-verbinding delen beschreven maakt gebruik van gevestigde immunocytochemie methoden te voorzien van snelle bemonstering van meerdere behandeling voorwaarden voor verhoogde statistische analyse. Deze methode doet dat met een lichte daling in absolute precisie in vergelijking met alternatieve enkel mole…
Disclosures
The authors have nothing to disclose.
Acknowledgements
De auteurs erkennen financiering van de steun van NHMRC (1084178 van de Fellowship en subsidies 1087850, 1030469, 1075898 (AMS)), kanker Australië, Ludwig kankeronderzoek, John T Reid vertrouwt, Cure Brain Cancer Foundation, La Trobe University en het Victoria kanker Agentschap. Financiering van operationele infrastructuur ondersteuning wordt geboden door de Victoriaanse regering, wordt Australië ook erkend.
Materials
| Nunc Lab-Tek II Chambered Coverglass – 8 well | ThermoFisher Scientific | 155409 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 10099141 | |
| TrypLE Express Enzyme (1x), no phenol red | ThermoFisher Scientific | 12604021 | |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Goat anti-Human IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | ThermoFisher Scientific | A11013 | |
| TetraSpeck Fluorescent Microsphere Standards 0.1µm | ThermoFisher Scientific | T7279 | |
| Cetuximab | Merck Serono | 3023715501 | |
| Parafilm M 38mx100mm | Merck Millipore | BRND701605 | |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | ProSciTech | C004 | |
| Recombinant Human EGF | R&D System | 236-EG |
References
- Scott, A. M., Wolchok, J. D., Old, L. J. Antibody therapy of cancer. Nature reviews. Cancer. 12 (4), 278-287 (2012).
- Parslow, A. C., Parakh, S., Lee, F. -. T., Gan, H., Scott, A. Antibody-Drug Conjugates for Cancer Therapy. Biomedicines. 4 (3), 14 (2016).
- Sorkin, A., Waters, C. M. Endocytosis of growth factor receptors. BioEssays. 15 (6), 375-382 (1993).
- Pawley, J. . Handbook of Biological Confocal Microscopy. , (2006).
- Petersen, N. O., Höddelius, P. L., Wiseman, P. W., Seger, O., Magnusson, K. E. Quantitation of membrane receptor distributions by image correlation spectroscopy: concept and application. Biophysical Journal. 65 (3), 1135-1146 (1993).
- Wiseman, P. W., Petersen, N. O. Image Correlation Spectroscopy. II. Optimization for Ultrasensitive Detection of Preexisting Platelet-Derived Growth Factor-β Receptor Oligomers on Intact Cells. Biophysical Journal. 76 (2), 963-977 (1999).
- Costantino, S., Comeau, J. W. D., Kolin, D. L., Wiseman, P. W. Accuracy and Dynamic Range of Spatial Image Correlation and Cross-Correlation Spectroscopy. Biophysical Journal. 89 (2), 1251-1260 (2005).
- Claire Robertson, S. C. G. Theory and practical recommendations for autocorrelation-based image correlation spectroscopy. Journal of Biomedical Optics. 17 (8), 080801 (2012).
- Ciccotosto, G. D., Kozer, N., Chow, T. T. Y., Chon, J. W. M., Clayton, A. H. A. Aggregation Distributions on Cells Determined by Photobleaching Image Correlation Spectroscopy. Biophysical Journal. 104 (5), 1056-1064 (2013).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43 (1 Suppl), 25-30 (2007).
- Rappaz, B., Wiseman, P. W. Image correlation spectroscopy for measurements of particle densities and colocalization. Current protocols in cell biology. , (2013).
- tferr/Scripts: BAR 1.5.1. Zenodo Available from: https://zenodo.org/record/495245 (2017)
- Elson, E. L. Fluorescence Correlation Spectroscopy: Past, Present, Future. Biophysical Journal. 101 (12), 2855-2870 (2011).
- Jares-Erijman, E. A., Jovin, T. M. Imaging molecular interactions in living cells by FRET microscopy. Current opinion in chemical biology. 10 (5), 409-416 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-Resolution Fluorescence Microscopy. dx.doi.org.ez.library.latrobe.edu.au. 78 (1), 993-1016 (2009).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. The Journal of Cell Biology. 190 (2), 165-175 (2010).
- Nohe, A., Petersen, N. O. Image Correlation Spectroscopy. Sci. Signal. (417), pl7 (2007).

