Confocal 현미경 검사 법 밝혀 세포 표면 수용 체 이미지 상관 분광학을 통해 집계
Summary
바인딩할 대상 수용 체 세포 표면에 항 체 구조와 클러스터링 변경 부여 수 있습니다. 이러한 동적 변경 내용이 대상 셀에 약물 개발 특성화에 대 한 영향을 미칠. 이 프로토콜 confocal 현미경 검사 법 및 이미지 상호 관계 분광학 ImageJ/피지 수용 체 세포 표면에 클러스터링의 척도를 통해 활용 합니다.
Abstract
Confocal 현미경 검사 법 특성화 및 형광 프로브로 분류 하는 전 임상 에이전트의 추가 개발에 대 한 중요 한 하위 세포 상호 작용을 캡처를 액세스할 수 있는 방법론을 제공 합니다. 기반으로 하는 항 체 세포 독성 약물에 최근 전진으로 전달 시스템, 수용 체 집계 및 국제화의 영역 내에서 이러한 에이전트에 의해 유도 된 변경 이해 중요 한 중요성 이다. 이 프로토콜 활용 하 여 형광 immunocytochemistry의 잘 설립 방법론 및 오픈 소스 피지 분포 ImageJ, inbuilt 상관와 이미지 수학 함수, 공간 이미지 상관 관계를 수행 하 분광학 (IC)입니다. 이 프로토콜은 공초점 현미경의 광선 영역의 기능으로 레이블이 지정 된 수용 체의 형광 강도 quantitates. 이 세포 표면에 대상 분자 집단의 국가의 양적 측정을 제공합니다. 이 방법론은 수용 체 집합의 일시적인 수사로 확장 하는 잠재력을 가진 정적 셀의 특성에 초점. 이 프로토콜은 클러스터링 기술 및 비 전문 이미징 장치 설립 잘 활용 하 여 세포 표면에서 발생 하는 이벤트의 정량화를 제공 하는 접근 방법론을 선물 한다.
Introduction
치료 항 체의 개발에는 여러 종양 종류1의 치료에서 놀라운 성공을 보이고 있다. 마약 항 체 어원이 같은 말 (ADC)의 최근 발전으로 세포 독성 화합물에 대 한 전달 메커니즘 셀에 항 체: 수용 체 상호 작용의 역동성을 이해 하기 위한 요구 사항을 확대 하고있다2표면. 성공적인 타겟팅 세포 표면 수용 체에 항 체의, 다음이 단지 리간드: 항 체 상호 작용3에서 관찰 된 그 유사 집계 패턴을 유도할 수 있다. 수용 체 집계에서 변경 셀 표면에서 막 하는 수용 체와 그것의 제거의 결과 국제화에 변화를 유도할 수 있다. 항 체 약물 켤레의 맥락에서이 프로세스 이후에 내 면된 endosomes와 이후 효과적인 셀 죽이 결과 세포질 세포 독성 페이로드를 해제 합니다.
Confocal 현미경 검사 법은 항 체와 그들의 대상 수용 체4의 이러한 중요 한 상호 작용을 시각화 하는 효과적인 수단을 제공 했다. 집계 대상 분자 세포 표면에서의 변화를 탐험이 프로토콜 활용 공간 이미지 상호 관계 분광학 (IC) 기술 5,6,7 통해 confocal 현미경 이미지의 후 처리 .
이미지 상관 분광학의 기초 공간 형광 강도 변동 관계 레이블이 구조체의 밀도 및 집계 상태를 공유 하는 관찰 이다. 이 관계는 캡처된 이미지5의 공간 자기 상관 함수의 계산에 따라 설정 됩니다.
이미지 상관 분광학의 모든 이체는 이미지 상관의 계산이 필요합니다. 이것은이 기능을 양적 집계 상태 매개 변수는 이미지 내에 포함 된의 추출에 대 한 2 차원 가우스 곡선 피팅 옵니다. 간단히에서 이미지 상관의 계산 포함 됩니다 모두 이미지에 포함 된 및 가능성을 계산 가능한 픽셀 쌍을 비교 하는 둘 다 동등 하 게 서로 밝은. 이 거리의 기능과 픽셀 분리8방향으로 시각 이다.
이미지 상호 관계 분광학에 대 한 이론적 프레임 워크 그리고 피터슨과 Wiseman 외정의 설립 되었다. 5 , 6.이 프로토콜 상관 계산 피지/ImageJ 스프레드시트 응용 프로그램에서 수행 됩니다, 강도 변동 공간 자기 상관 함수에 대 한 기준 (Eq 1)로 기술 될 수 있다:
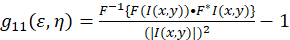
여기서 F 나타냅니다 푸리에 변환을; F− 1 역 푸리에 변환; F * 복소수; 공간 지연 변수 ε 그리고 η. 공간 IC에서이 프로토콜에서 설명 된 대로 자기 상관 함수 계산할 수는 2D 빠른 푸리에 변환 알고리즘7,9를 사용 하 여. 0-지연, g11(0, 0)로 그렇지 않으면 알려진 제로 공간 별거에 상관 입자 빔 현미경의 영역 당 현재 역 평균 수를 제공 합니다. 그것은 2 차원 가우스 함수 (Eq 2)공간 자기 상관 함수를 피팅 하 여 얻을 수 있습니다.
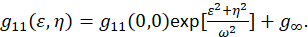
와 픽셀 이미지 내에서 캡처 영역 설정된에 포함 된 이러한 측정 무한대로 확장 되지 않습니다, 용어 g∞ 이미지 내에 포함 된 장거리 공간적 상관을 오프셋으로 사용 됩니다. 분자 크기의 집계, ω 현미경의 포인트 확산 함수 이며 반-최대 공간 자기 상관 함수에의 전체 폭에 의해 설명. 악기의 확산 기능에 포함 된 지역 하위 해상도 형광 구슬을 사용 하 여 측정 될 수 있다.
여기에 설명 된 이미지 상호 관계 분광학 프로토콜, 상관 및 ICS를 완료 하는 데 필요한 수학 함수는 사용 하 여 수행 오픈 소스 영상 처리 플랫폼, 피지10는 ImageJ의 분포 프로그램11,12. 피지/ImageJ FFT 수학 함수에 사전 설치 된 빠른 푸리에 변환을 사용합니다. 이 기능은 각 차원13에서 2의 요인에 의해 데이터의 범위를 줄임으로써이 계산의 계산 시간을 줄일 수 있습니다. 2D 자기 상관 함수는 x, y 축에서에서 대략 대칭 상관 이미지를 통해 한 줄 프로필 플롯 원시 자기 상관 공간 지연의 기능으로 측정을 사용할 수 있습니다. 모든 0 지연 잡음 추가 계산을 하기 전에, 결과 상관 진폭 (피크 값, g(0)T)와 식 (Eq 3)와 함께 배경에 대 한 수정 제거 됩니다.
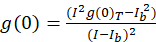
어디 내가b 셀을 제외 하는 배경 영역에서 평균 강도 이다. 클러스터 밀도, 또는 형광 개체의 밀도 (Eq 4)에 의해 정의 됩니다.
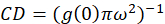
여기에 설명 된 프로토콜 우리 가정 접근 공간 지연 증가 함께 1.0 값을 정규화 된 자기 상관 함수 것입니다 붕괴는 관찰을 바탕으로 단순히 클러스터 밀도 (CD)의 계산을 더. 최대 공간 피로 더 이상 어떤 상관 관계가 형광의 강도 값 하 고 따라서 상관 없이이 지역에서 계산 컴퓨팅 나눈 이후에이 강도 곱한 강도 값은 그 강도, 정의 1.0의 광장. 따라서, 클러스터 정규화 된 자기 상관 함수에서 밀도 상호 (Eq 5)을복용 하기 전에 정규화 된 자기 상관 함수에서 1.0을 빼서 계산 될 수 있다:
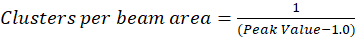
악기의 포인트 확산 함수의 영역 내에 포함 된 클러스터 수를 quantitate 하 빔 영역의 추가 보정을 수행할 수 있습니다. 이 교정은 이미지 상호 관계 분광학 분석 중에 사용 하는 동일한 광학 조건을 사용 하 여 수행 되어야 합니다.
Protocol
Representative Results
Discussion
우리가이 프로토콜에서 설명 하는 이미지 상호 관계 분광학 (IC)의 기술 특수 감지기에 대 한 필요 없이 표준 confocal 현미경을 사용 합니다. ICS 기술 설명 잘 설립 immunocytochemistry 메서드 증가 통계 분석에 대 한 여러 치료 조건의 빠른 샘플링을 사용 합니다. 이 방법론 confocal 볼륨, 형광 등을 통해 확산 모바일 분자의 형광 동요의 상관 관계에 따라 대체 단일 분자 기법에 비해 절대 정밀도에 약간의 ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
저자 인정 자금 지원을 NHMRC (교제 1084178와 보조금 1087850, 1030469, 1075898 (AMS))에서 암 호주, 루드비히 암 연구, 존 T 리드 신뢰, 치료 뇌 암 재단, 라 Trobe 대학교와 빅토리아 암 기관. Victorian 정부에 의해 제공 운영 인프라 지원 프로그램에서 자금, 호주는 또한 인정 했다.
Materials
| Nunc Lab-Tek II Chambered Coverglass – 8 well | ThermoFisher Scientific | 155409 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 10099141 | |
| TrypLE Express Enzyme (1x), no phenol red | ThermoFisher Scientific | 12604021 | |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Goat anti-Human IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | ThermoFisher Scientific | A11013 | |
| TetraSpeck Fluorescent Microsphere Standards 0.1µm | ThermoFisher Scientific | T7279 | |
| Cetuximab | Merck Serono | 3023715501 | |
| Parafilm M 38mx100mm | Merck Millipore | BRND701605 | |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | ProSciTech | C004 | |
| Recombinant Human EGF | R&D System | 236-EG |
References
- Scott, A. M., Wolchok, J. D., Old, L. J. Antibody therapy of cancer. Nature reviews. Cancer. 12 (4), 278-287 (2012).
- Parslow, A. C., Parakh, S., Lee, F. -. T., Gan, H., Scott, A. Antibody-Drug Conjugates for Cancer Therapy. Biomedicines. 4 (3), 14 (2016).
- Sorkin, A., Waters, C. M. Endocytosis of growth factor receptors. BioEssays. 15 (6), 375-382 (1993).
- Pawley, J. . Handbook of Biological Confocal Microscopy. , (2006).
- Petersen, N. O., Höddelius, P. L., Wiseman, P. W., Seger, O., Magnusson, K. E. Quantitation of membrane receptor distributions by image correlation spectroscopy: concept and application. Biophysical Journal. 65 (3), 1135-1146 (1993).
- Wiseman, P. W., Petersen, N. O. Image Correlation Spectroscopy. II. Optimization for Ultrasensitive Detection of Preexisting Platelet-Derived Growth Factor-β Receptor Oligomers on Intact Cells. Biophysical Journal. 76 (2), 963-977 (1999).
- Costantino, S., Comeau, J. W. D., Kolin, D. L., Wiseman, P. W. Accuracy and Dynamic Range of Spatial Image Correlation and Cross-Correlation Spectroscopy. Biophysical Journal. 89 (2), 1251-1260 (2005).
- Claire Robertson, S. C. G. Theory and practical recommendations for autocorrelation-based image correlation spectroscopy. Journal of Biomedical Optics. 17 (8), 080801 (2012).
- Ciccotosto, G. D., Kozer, N., Chow, T. T. Y., Chon, J. W. M., Clayton, A. H. A. Aggregation Distributions on Cells Determined by Photobleaching Image Correlation Spectroscopy. Biophysical Journal. 104 (5), 1056-1064 (2013).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43 (1 Suppl), 25-30 (2007).
- Rappaz, B., Wiseman, P. W. Image correlation spectroscopy for measurements of particle densities and colocalization. Current protocols in cell biology. , (2013).
- tferr/Scripts: BAR 1.5.1. Zenodo Available from: https://zenodo.org/record/495245 (2017)
- Elson, E. L. Fluorescence Correlation Spectroscopy: Past, Present, Future. Biophysical Journal. 101 (12), 2855-2870 (2011).
- Jares-Erijman, E. A., Jovin, T. M. Imaging molecular interactions in living cells by FRET microscopy. Current opinion in chemical biology. 10 (5), 409-416 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-Resolution Fluorescence Microscopy. dx.doi.org.ez.library.latrobe.edu.au. 78 (1), 993-1016 (2009).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. The Journal of Cell Biology. 190 (2), 165-175 (2010).
- Nohe, A., Petersen, N. O. Image Correlation Spectroscopy. Sci. Signal. (417), pl7 (2007).

