Microscopia confocal revela agregação de receptores de superfície celular através de espectroscopia de correlação de imagem
Summary
Anticorpos que se ligam a receptores de alvo na superfície da pilha podem conferir alterações clusterização e conformação. Estas mudanças dinâmicas têm implicações para caracterizar o desenvolvimento de drogas em células-alvo. Este protocolo utiliza a microscopia confocal e espectroscopia de correlação de imagem através do ImageJ/FIJI para quantificar a extensão do receptor na superfície das células de clustering.
Abstract
Microscopia confocal fornece uma metodologia acessível para capturar sub celulares interações críticas para a caracterização e desenvolvimento de agentes pré-clínicos rotulado com sondas fluorescentes. Com recentes avanços em drogas citotóxicas anticorpo com base em sistemas de distribuição, compreendendo as alterações induzidas por esses agentes dentro do Reino da agregação do receptor e internalização é de importância crítica. Este protocolo utiliza a metodologia bem estabelecida de imunocitoquímica fluorescente e a distribuição de FIJI de fonte aberta do ImageJ, com sua inerente autocorrelação e funções matemáticas de imagem, para realizar a correlação espacial de imagem espectroscopia (ICS). Este protocolo dosa a intensidade fluorescente de receptores rotuladas como uma função da área do feixe do microscópio confocal. Isto fornece uma medida quantitativa do estado de agregação de molécula alvo na superfície da célula. Esta metodologia está voltada para a caracterização de estáticas células com potencial para expandir em investigações temporais de agregação do receptor. Este protocolo apresenta uma metodologia acessível para fornecer a quantificação dos eventos que ocorrem na superfície da célula, utilizando bem estabelecida não especializada aparelhos de imagem e técnicas de clustering.
Introduction
O desenvolvimento de anticorpos terapêuticos demonstrou notável sucesso no tratamento de vários tipos de tumor1. Os avanços recentes da droga-anticorpo o cojugado (ADC) como mecanismos de entrega para compostos citotóxicos expandiu-se os requisitos para a compreensão da dinâmica de interações de anticorpo: receptor na célula superfície2. Após a bem sucedida como alvo de um anticorpo para o receptor de superfície celular, estes complexos podem induzir padrões de agregação semelhantes às observadas em ligante: anticorpo interações3. Alterações na agregação do receptor podem induzir alterações da membrana e resultado na internalização do receptor e sua remoção da superfície celular. No contexto de um conjugado anticorpo-droga, esse processo posteriormente libera a carga citotóxica em endossomos interiorizados e, posteriormente, o citoplasma, resultando na morte de célula eficaz.
Microscopia confocal forneceu um meio eficaz de visualizar estes importantes interações de anticorpos e seu alvo receptores4. Para explorar as mudanças da agregação da molécula alvo na superfície da célula, este protocolo utiliza pós-processamento de imagens de microscopia confocal, através de uma imagem espacial correlação espectroscopia (ICS) técnica 5,6,7 .
A base da espectroscopia de correlação de imagem é a observação que as flutuações de intensidade de fluorescência espacial compartilham um relacionamento para o estado de densidade e agregação das estruturas etiquetadas. Essa relação é estabelecida após o cálculo de uma função de autocorrelação espacial de uma imagem capturada5.
Todas as variantes de espectroscopia de correlação de imagem requerem o cálculo de uma imagem de autocorrelação. Isto é seguido por encaixe essa função a uma curva gaussiana bidimensional para a extração de parâmetros de estado de agregação quantitativos contidos dentro da imagem. Em termos simples, o cálculo de uma imagem de autocorrelação envolve comparando todos os pares possíveis pixel contidos em uma imagem e calcular a probabilidade que ambos igualmente tão brilhante quanto o outro. Isto é visualizado como uma função da distância e direções de pixel separação8.
O quadro teórico para a espectroscopia de correlação de imagem foi estabelecido e definido por Petersen e Wiseman et al. 5 , 6. no presente protocolo, os cálculos de autocorrelação serão executados em Fiji/ImageJ, bem como um aplicativo de planilha, a base para a função de autocorrelação espacial de flutuação de intensidade pode ser descrita como (Eq. 1):
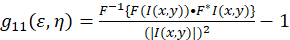
onde F representa a transformada de Fourier; F− 1 a inversa de Fourier transform; F * seu conjugado complexo; e a defasagem espacial variáveis ε e η. Em espacial ICS, conforme descrito no presente protocolo, a função de autocorrelação pode ser calculada usando um 2D fast Fourier transform algoritmo7,9. A autocorrelação no zero separação espacial, também conhecida como zero lag, g11(0,0), fornece o inverso número médio de partículas presentes por área de feixe do microscópio. Pode ser obtido por encaixe a função de autocorrelação espacial para uma função gaussiana bidimensional (Eq. 2):
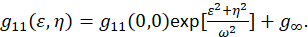
Como os pixels capturados dentro de uma imagem estão contidos dentro de uma área definida, e estas medidas não se estendem ao infinito, o termo g∞ é usado como um deslocamento para dar conta de longo alcance correlações espaciais contidas dentro da imagem. Para agregados de tamanho molecular, ω é a função de ponto-propagação do microscópio e descrito pela largura total no metade-máximo da função de autocorrelação espacial. A área contida dentro da função de ponto de espalhar do instrumento pode ser calibrada com o uso de grânulos fluorescentes resolução sub.
Para o protocolo espectroscopia de correlação imagem aqui descrito, a autocorrelação e funções matemáticas necessárias para completar o ICS são executadas usando a plataforma de processamento de imagem de código-fonte aberto, Fiji10, uma distribuição do ImageJ programa11,12. Fiji/ImageJ utiliza a transformação de Fourier rápida pré-instalado na função matemática de FFT. Esta função reduz o tempo de computação necessário deste cálculo, reduzindo o intervalo de dados por um fator de dois em cada dimensão13. Como a função de autocorrelação 2D é aproximadamente simétrica em x, eixo y, uma única linha perfil trama através da imagem de autocorrelação pode ser usada para medir a autocorrelação cru como uma função do GAL espacial. Qualquer ruído zero lag é removido antes da mais cálculo, com a amplitude resultante de autocorrelação (valor de pico, g(0)T) corrigido para plano de fundo com a expressão (Eq. 3):
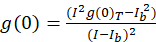
onde eub é a intensidade média de uma região de fundo, excluindo a célula. A densidade do aglomerado, ou densidade de objetos fluorescentes, é definida por (Eq. 4):
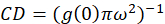
O protocolo descrito neste documento, estamos mais simplesmente o cálculo da densidade do aglomerado (CD), com a suposição, baseada na observação de que uma função de autocorrelação normalizado irá decair para um valor de 1.0 com o aumento da defasagem espacial aproximando-se. Com lag espacial máxima, há já não qualquer correlação de fluorescência valores de intensidade e, portanto, sem uma correlação os cálculos nesta região são computação do valor de uma intensidade multiplicada por essa intensidade que é posteriormente dividida pela Praça de que a intensidade, que, por definição, é igual a 1.0. Assim, a densidade do aglomerado de uma função de autocorrelação normalizado pode ser calculada subtraindo 1.0 da função de autocorrelação normalizado antes de tomar sua recíproca (Eq. 5):
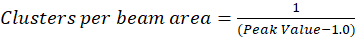
Calibração mais da área do feixe pode ser realizada para quantificar o número de clusters contidas dentro da área da função de ponto de espalhar do instrumento. Esta calibração deve ser executada usando as mesmas condições ópticas usadas durante a análise de espectroscopia de correlação de imagens.
Protocol
Representative Results
Discussion
A técnica de espectroscopia de correlação de imagem (ICS) que descrevemos neste protocolo usa microscópios confocal padrão sem a necessidade de detectores especializados. A técnica ICS descrita utiliza métodos de imunocitoquímica bem estabelecida para fornecer para amostragem rápida de várias condições de tratamento para a análise estatística aumentada. Esta metodologia faz isso com uma ligeira diminuição absoluta precisão em comparação com técnicas de molécula única alternativa com base na correla?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Os autores reconhecem o apoio financeiro de NHMRC (1084178 de bolsa de estudo e subsídios 1087850, 1030469, 1075898 (AMS)), câncer Austrália, Ludwig Cancer Research, John T Reid confia, cura cérebro Cancer Foundation, La Trobe University e a agência de câncer Victoria. Financiamento do programa de infra-estrutura de apoio operacional fornecido pelo governo de Victorian, Austrália também é reconhecida.
Materials
| Nunc Lab-Tek II Chambered Coverglass – 8 well | ThermoFisher Scientific | 155409 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 10099141 | |
| TrypLE Express Enzyme (1x), no phenol red | ThermoFisher Scientific | 12604021 | |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Goat anti-Human IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | ThermoFisher Scientific | A11013 | |
| TetraSpeck Fluorescent Microsphere Standards 0.1µm | ThermoFisher Scientific | T7279 | |
| Cetuximab | Merck Serono | 3023715501 | |
| Parafilm M 38mx100mm | Merck Millipore | BRND701605 | |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | ProSciTech | C004 | |
| Recombinant Human EGF | R&D System | 236-EG |
References
- Scott, A. M., Wolchok, J. D., Old, L. J. Antibody therapy of cancer. Nature reviews. Cancer. 12 (4), 278-287 (2012).
- Parslow, A. C., Parakh, S., Lee, F. -. T., Gan, H., Scott, A. Antibody-Drug Conjugates for Cancer Therapy. Biomedicines. 4 (3), 14 (2016).
- Sorkin, A., Waters, C. M. Endocytosis of growth factor receptors. BioEssays. 15 (6), 375-382 (1993).
- Pawley, J. . Handbook of Biological Confocal Microscopy. , (2006).
- Petersen, N. O., Höddelius, P. L., Wiseman, P. W., Seger, O., Magnusson, K. E. Quantitation of membrane receptor distributions by image correlation spectroscopy: concept and application. Biophysical Journal. 65 (3), 1135-1146 (1993).
- Wiseman, P. W., Petersen, N. O. Image Correlation Spectroscopy. II. Optimization for Ultrasensitive Detection of Preexisting Platelet-Derived Growth Factor-β Receptor Oligomers on Intact Cells. Biophysical Journal. 76 (2), 963-977 (1999).
- Costantino, S., Comeau, J. W. D., Kolin, D. L., Wiseman, P. W. Accuracy and Dynamic Range of Spatial Image Correlation and Cross-Correlation Spectroscopy. Biophysical Journal. 89 (2), 1251-1260 (2005).
- Claire Robertson, S. C. G. Theory and practical recommendations for autocorrelation-based image correlation spectroscopy. Journal of Biomedical Optics. 17 (8), 080801 (2012).
- Ciccotosto, G. D., Kozer, N., Chow, T. T. Y., Chon, J. W. M., Clayton, A. H. A. Aggregation Distributions on Cells Determined by Photobleaching Image Correlation Spectroscopy. Biophysical Journal. 104 (5), 1056-1064 (2013).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43 (1 Suppl), 25-30 (2007).
- Rappaz, B., Wiseman, P. W. Image correlation spectroscopy for measurements of particle densities and colocalization. Current protocols in cell biology. , (2013).
- tferr/Scripts: BAR 1.5.1. Zenodo Available from: https://zenodo.org/record/495245 (2017)
- Elson, E. L. Fluorescence Correlation Spectroscopy: Past, Present, Future. Biophysical Journal. 101 (12), 2855-2870 (2011).
- Jares-Erijman, E. A., Jovin, T. M. Imaging molecular interactions in living cells by FRET microscopy. Current opinion in chemical biology. 10 (5), 409-416 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-Resolution Fluorescence Microscopy. dx.doi.org.ez.library.latrobe.edu.au. 78 (1), 993-1016 (2009).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. The Journal of Cell Biology. 190 (2), 165-175 (2010).
- Nohe, A., Petersen, N. O. Image Correlation Spectroscopy. Sci. Signal. (417), pl7 (2007).

