Confocal микроскопии показывает клеток поверхности рецептор агрегации через спектроскопии корреляции изображений
Summary
Антитела, которые привязаны к целевой рецепторы на поверхности клеток может придать конформации и кластеризации изменения. Эти динамические изменения имеют последствия для развития наркотиков в клетки-мишени. Этот протокол использует confocal микроскопии и спектроскопии корреляции изображений через ImageJ/Фиджи для количественной оценки степени рецептора кластеризации на поверхности клеток.
Abstract
Конфокальная микроскопия предоставляет доступные методологию для захвата субклеточном взаимодействия критические характеристика и дальнейшего развития доклинических агентов, помечены флуоресцентных зондов. С последними достижениями в наркотиков цитотоксических антител на основе систем доставки, понимание изменений, вызванных этими агентами в сфере агрегации рецепторов и интернализации имеет решающее значение. Этот протокол использует устоявшейся методологии флуоресцентные иммуноцитохимии и открытым исходным кодом Фиджи распределение ImageJ, с его встроенными автокорреляции и изображения математических функций, для выполнения корреляции пространственного изображения спектроскопия (ICS). Этот протокол quantitates интенсивности флуоресценции рецепторов, помечены как функция пучка области конфокального микроскопа. Это дает количественную оценку положения комплексирования целевой молекулы на поверхности клеток. Эта методология направлена на характеристике статических клеток с потенциалом для расширения в височной исследования агрегации рецепторов. Этот протокол представляет доступной методологии для обеспечения количественной оценки кластеризации событий, происходящих на поверхности клеток, используя хорошо созданы методы и неспециализированных тепловизионной аппаратуры.
Introduction
Разработка терапевтических антител показал замечательный успех в лечении множественные опухоли типа1. Последние достижения антитела наркотиков конъюгатов (ADC) как механизмы доставки для цитотоксических соединений расширил требования для понимания динамики взаимодействия антитела: рецептор на клетки поверхность2. После успешного нападения на антитела к поверхности рецепторные клетки, эти комплексы может вызвать аналогичные структуры агрегирования с теми, которые наблюдались в лиганд: антитела взаимодействия3. Изменения в агрегации рецепторов могут вызвать изменения в мембраны и результат в интернализации рецептора и его удаление из клеточной поверхности. В контексте Конъюгат антител наркотиков этот процесс впоследствии выпускает цитотоксических полезной во внутреннюю endosomes и впоследствии цитоплазмы, что приводит к эффективной клетки убийства.
Конфокальная микроскопия предоставил эффективным средством визуализации этих важных взаимодействия антител и их целевой рецепторы4. Для изучения изменений агрегации целевой молекулы на поверхности клеток этот протокол использует пост-обработки confocal микроскопии изображений через пространственного изображения корреляции спектроскопии (ICS) техника 5,6,7 .
Основа спектроскопии корреляции изображений является наблюдение, что колебания интенсивности пространственных флуоресценции разделяют отношения в состояние плотности и агрегирования помечены структур. Эта связь устанавливается после расчета пространственных автокорреляционной функции образа5.
Все варианты спектроскопии корреляции изображений требуется Вычисление автокорреляции изображения. Это сопровождается уместно эту функцию для двумерных кривая Гаусса для извлечения параметров состояния количественных агрегации, содержащиеся в образе. В простых терминах Вычисление автокорреляции изображений включает в себя сравнение всех возможных пикселей пары содержащихся в изображении и расчета вероятности что оба одинаково как яркий, как друг с другом. Это визуализируется как функция расстояния и направления пикселей разделения8.
Теоретические основы для спектроскопии корреляции изображения была создана и определяется Петерсен и мудреца и др. 5 , 6. в настоящем Протоколе, автокорреляции вычисления выполняются в Фиджи/ImageJ, а также приложение электронной таблицы, основой для пространственных автокорреляционная функция колебания интенсивности может быть описан как (Eq 1):
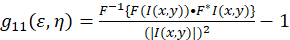
где F представляет Фурье; F−1 Фурье обратное преобразование; F * его сложный конъюгат; и пространственной ЛАГ переменные ε и η. В пространственной ICS как описано в настоящем Протоколе, автокорреляционная функция может быть рассчитана с помощью 2D быстрого преобразования Фурье преобразование алгоритм7,9. Автокорреляция на нулевой пространственного разделения, иначе известный как нуль ЛАГ, g11(0,0), обеспечивает обратное среднее количество частиц нынешней площади луч микроскопа. Она может быть получена путем установки пространственного автокорреляционная функция для двумерных Гауссова функция (Eq 2):
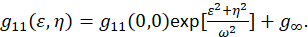
Как пикселей, захвачен в изображении содержатся в пределах установленного области, и эти измерения не распространяется на бесконечности, g∞ термин используется в качестве смещения для учета долгосрочных пространственных корреляций, содержащиеся в образе. Для молекулярного размера агрегатов ω — точки распространения функция микроскопа и описал полной ширины на половину максимум пространственных автокорреляционной функции. Области, содержащиеся в точки распространения функция документа может быть откалиброван с использованием флуоресцентных бусины подпункта резолюции.
Для протокола спектроскопии корреляции изображений, описываемые автокорреляционный и математических функций, необходимых для завершения ICS выполняются с использованием открытым исходным кодом платформы обработки изображений, Фиджи10, распределение ImageJ Программа11,12. Фиджи/ImageJ использует предустановленные быстрого преобразования Фурье в БПФ математические функции. Эта функция сокращает время вычисления этого расчета путем уменьшения диапазона данных по два в каждом измерении13раза. Как 2D автокорреляционная функция приблизительно симметрично в x, y оси, участок профиля одной линии через образ автокорреляции может использоваться для измерения сырье автокорреляции как функция пространственной ЛАГ. Ноль ЛАГ шум удаляется до дальнейшего вычисления, с результате автокорреляции амплитудой (пиковое значение, g(0)T) исправлены для фона с выражением (Eq 3):
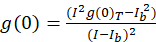
где яb -это средняя интенсивность от фона региона, исключая ячейки. Плотности кластера, или плотность флуоресцентных объектов, определяется (Eq 4):
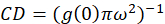
В протоколе, описанные здесь мы также просто расчет плотности кластера (CD), с предположение основано на том наблюдении, что нормализованных автокорреляционная функция будет распадаться значение приближается 1.0 с увеличением пространственных ЛАГ. С максимальной пространственных ЛАГ, это больше не корреляции флуоресценции значения интенсивности и таким образом без корреляции вычислений в этом регионе вычисления значения интенсивности, умноженное на такой интенсивности, которая затем делится на Площадь той интенсивностью, которая по определению равна 1.0. Таким образом кластер плотности от нормализованной автокорреляционная функция может быть вычислено путем вычитания 1.0 от нормализованной автокорреляционной функции до принятия его взаимные (Eq 5):
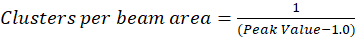
Дальнейшие области луч может быть калибрация чтобы quantitate количество кластеров, содержащихся в области точки распространения функция инструмента. Калибровка должна быть выполнена с использованием же оптические условия, используемые в ходе анализа спектроскопии корреляции изображений.
Protocol
Representative Results
Discussion
Метод спектроскопии корреляции изображения (ICS), что мы описываем в этот протокол использует стандартные конфокальные микроскопы без необходимости специализированные детекторы. ICS метод, описанный использует методы устоявшихся immunocytochemistry для обеспечения быстрого отбора нескольких у?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Авторы признают, что финансовая поддержка от NHMRC (1084178 стипендий и грантов 1087850, 1030469, 1075898 (AMS)), рак Австралии, Людвиг раковых исследований, Джон Рид T надеется, Фонд рака мозга лечение, Ла Троуб и рак агентство Виктория. Финансирование от оперативной программы поддержки инфраструктуры, предоставленного правительством викторианской, Австралия также признается.
Materials
| Nunc Lab-Tek II Chambered Coverglass – 8 well | ThermoFisher Scientific | 155409 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 10099141 | |
| TrypLE Express Enzyme (1x), no phenol red | ThermoFisher Scientific | 12604021 | |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Goat anti-Human IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | ThermoFisher Scientific | A11013 | |
| TetraSpeck Fluorescent Microsphere Standards 0.1µm | ThermoFisher Scientific | T7279 | |
| Cetuximab | Merck Serono | 3023715501 | |
| Parafilm M 38mx100mm | Merck Millipore | BRND701605 | |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | ProSciTech | C004 | |
| Recombinant Human EGF | R&D System | 236-EG |
References
- Scott, A. M., Wolchok, J. D., Old, L. J. Antibody therapy of cancer. Nature reviews. Cancer. 12 (4), 278-287 (2012).
- Parslow, A. C., Parakh, S., Lee, F. -. T., Gan, H., Scott, A. Antibody-Drug Conjugates for Cancer Therapy. Biomedicines. 4 (3), 14 (2016).
- Sorkin, A., Waters, C. M. Endocytosis of growth factor receptors. BioEssays. 15 (6), 375-382 (1993).
- Pawley, J. . Handbook of Biological Confocal Microscopy. , (2006).
- Petersen, N. O., Höddelius, P. L., Wiseman, P. W., Seger, O., Magnusson, K. E. Quantitation of membrane receptor distributions by image correlation spectroscopy: concept and application. Biophysical Journal. 65 (3), 1135-1146 (1993).
- Wiseman, P. W., Petersen, N. O. Image Correlation Spectroscopy. II. Optimization for Ultrasensitive Detection of Preexisting Platelet-Derived Growth Factor-β Receptor Oligomers on Intact Cells. Biophysical Journal. 76 (2), 963-977 (1999).
- Costantino, S., Comeau, J. W. D., Kolin, D. L., Wiseman, P. W. Accuracy and Dynamic Range of Spatial Image Correlation and Cross-Correlation Spectroscopy. Biophysical Journal. 89 (2), 1251-1260 (2005).
- Claire Robertson, S. C. G. Theory and practical recommendations for autocorrelation-based image correlation spectroscopy. Journal of Biomedical Optics. 17 (8), 080801 (2012).
- Ciccotosto, G. D., Kozer, N., Chow, T. T. Y., Chon, J. W. M., Clayton, A. H. A. Aggregation Distributions on Cells Determined by Photobleaching Image Correlation Spectroscopy. Biophysical Journal. 104 (5), 1056-1064 (2013).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43 (1 Suppl), 25-30 (2007).
- Rappaz, B., Wiseman, P. W. Image correlation spectroscopy for measurements of particle densities and colocalization. Current protocols in cell biology. , (2013).
- tferr/Scripts: BAR 1.5.1. Zenodo Available from: https://zenodo.org/record/495245 (2017)
- Elson, E. L. Fluorescence Correlation Spectroscopy: Past, Present, Future. Biophysical Journal. 101 (12), 2855-2870 (2011).
- Jares-Erijman, E. A., Jovin, T. M. Imaging molecular interactions in living cells by FRET microscopy. Current opinion in chemical biology. 10 (5), 409-416 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-Resolution Fluorescence Microscopy. dx.doi.org.ez.library.latrobe.edu.au. 78 (1), 993-1016 (2009).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. The Journal of Cell Biology. 190 (2), 165-175 (2010).
- Nohe, A., Petersen, N. O. Image Correlation Spectroscopy. Sci. Signal. (417), pl7 (2007).

