Confocal mikroskobu ortaya hücre yüzey reseptör toplama görüntü korelasyon spektroskopisi ile
Summary
Hedef reseptörleri hücre yüzeyinde bağlanan antikorlar uyum ve küme değişikliklerini görüşmek. Bu dinamik değişiklikler ilaç geliştirme hedef hücrelerdeki karakterize konusunda da etkileri vardır. Bu iletişim kuralı confocal mikroskobu ve görüntü korelasyon spektroskopisi ile hücre yüzeyinde kümeleme reseptör kapsamını ölçmek için ImageJ/FIJI kullanır.
Abstract
Confocal mikroskobu alt hücresel etkileşimlerin karakterizasyonu ve daha da geliştirilmesi ile floresan problar etiketli önceden klinik ajanların kritik yakalamak için erişilebilir bir yöntem sağlar. Antikor dayalı sitotoksik ilaç son gelişmeler ile dağıtım sistemleri, reseptör toplama ve içselleştirilmesi bölge içindeki Bu aracılar tarafından indüklenen değişiklikler anlama kritik öneme sahiptir. Floresan immunocytochemistry köklü metodolojisi ve ImageJ, açık kaynak FIJI dağıtım dahili otokorelasyon ve resim matematiksel işlevler kayma görüntü korelasyon gerçekleştirmek için bu iletişim kuralını güçlendirir spektroskopisi (ICS). Bu iletişim kuralı etiketli reseptörleri floresan yoğunluğu confocal mikroskop ışını alan bir fonksiyonu olarak quantitates. Bu hücre yüzeyinde niceliksel ölçüsüdür hedef molekül toplama durumunu sağlar. Bu metodoloji genişletin zamansal reseptör toplama soruşturmalar için potansiyeli statik hücrelerin karakterizasyonu odaklanmıştır. Bu protokolü de kullanan teknikleri ve görüntüleme cihazları-İhtisas kurulan hücre yüzeyde oluşan olaylar kümeleme miktar sağlamak için erişilebilir bir metodoloji sunar.
Introduction
Terapötik antikorlar gelişimi birden fazla tümör tip1tedavisinde olağanüstü başarı göstermiştir. Antikor: reseptör etkileşimleri hücreden dinamiklerini anlamak için gereksinimleri sitotoksik bileşikler için teslimat mekanizmalarını genişletti sıra antikor-uyuşturucu conjugates (ADC) son gelişmeler2yüzey. Başarılı bir antikor hücre yüzey reseptör için hedefleme takiben, bu komplekslerin olanlara ligand: antikor etkileşimleri3‘ te gözlemlenen benzer toplama modeller tetikleyebilir. Reseptör toplama içinde değişiklikler hücre yüzeyinden membran ve içselleştirilmesi sonucu reseptör ve onun kaldırma için değişiklikleri tetikleyebilir. Bir antikor-uyuşturucu eşlenik bağlamında, bu işlemi daha sonra içine içselleştirilmiş endosomes ve daha sonra etkili hücre öldürme kaynaklanan sitoplazma, sitotoksik yükü serbest bırakır.
Confocal mikroskobu antikorlar ve onların hedef reseptörleri4önemli bu etkileşimleri görselleştirmek için etkili bir yol sağlamıştır. Toplama hedef molekülün hücre yüzeyinde değişiklikler keşfetmek için bir kayma görüntü korelasyon spektroskopisi (ICS) tekniği 5,6,7 ile confocal mikroskobu görüntülerin işlem sonrası bu protokolü kullanır .
Görüntü korelasyon spektroskopisi kayma floresan yoğunluğu dalgalanmaları etiketli yapıları yoğunluğu ve toplama durumunu arasında bir ilişki paylaşmak gözlem temelidir. Bu ilişki bir kayma otokorelasyon işlev yakaladığınız görüntüyü5hesaplanması aşağıdaki kurulur.
Tüm değişik-in resim korelasyon spektroskopisi bir görüntü otokorelasyon hesaplanması gerekir. Bu iki boyutlu bir Gauss eğrisi görüntü içinde bulunan nicel toplama durumu parametreleri çıkarım için bu işleve yaklaştırarak takip ediyor. Tek bir görüntü içinde bulunan ve olasılığını hesaplamak mümkün piksel ikili karşılaştırma bir görüntü otokorelasyon hesaplanması açısından basit içerir bu ikisi de eşit diğer her kadar parlak. Bu işlev mesafe ve yön piksel ayrılık8görüntülenir.
Kuramsal çerçeve resim korelasyon spektroskopisi için kurulan ve Petersen ve Wiseman ve arktarafından tanımlanan. 5 , 6. bu protokol için otokorelasyon hesaplamalar Fiji/ImageJ gibi bir elektronik tablo uygulaması yapılır, yoğunluk dalgalanma kayma otokorelasyon fonksiyonu için temel (Eq 1)tarif edilebilir:
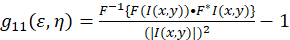
Burada F Fourier dönüşümü gösterir; F– 1 ters Fourier dönüşümü; F * onun karmaşık eşleniği; ve kayma gecikme değişkenleri ε ve η. Kayma ICS bu protokol için açıklandığı gibi otokorelasyon işlevi bir 2D hızlı Fourier dönüşümü algoritma7,9kullanılarak hesaplanabilir. Aksi halde sıfır-lag, g11(0,0) bilinen sıfır kayma ayırma, otokorelasyon parçacıklar mikroskop ışını alan mevcut ters ortalama sayısını sağlar. İki boyutlu bir Gauss işlev (Eq 2)kayma otokorelasyon işleve yaklaştırarak elde edilebilir:
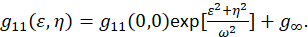
Bir görüntü içinde çekilen piksel ayarlama alanı içinde bulunan ve bu ölçümler sonsuza kadar uzatmak değil gibi dönem g∞ görüntü içinde bulunan uzun menzilli uzamsal ilişkiler için hesap için bir mahsup hesabı kullanılır. İçin toplamları, moleküler büyüklükteki ω mikroskop noktası yayıldı fonksiyonu ve yarı-maksimum kayma otokorelasyon işlevinin tam genişlikte tarafından açıklanan. Araç noktaya yayılmış işlev içinde yer alan alt çözünürlük floresan boncuklar kullanılarak kalibre edilmesi.
Burada açıklanan resim korelasyon spektroskopisi için protokol, otokorelasyon ve ICS tamamlamaya yönelik matematik fonksiyonları kullanarak açık kaynak görüntüleme-işlem platformu, Fiji10, ImageJ bir dağıtım gerçekleştirilir Program11,12. Fiji/ImageJ önceden yüklenmiş hızlı Fourier dönüşümü FFT matematik işlev kullanır. Bu işlev her boyut13‘ te ikinin katları tarafından veri aralığını azaltarak bu hesaplanması gereken compute süreyi azaltır. 2D otokorelasyon işlev yaklaşık x, y ekseni, simetrik olduğu gibi bir tek satır profil Arsa otokorelasyon görüntü yoluyla ham otokorelasyon kayma gecikme bir fonksiyonu olarak ölçmek için kullanılabilir. Herhangi bir sıfır-lag gürültü ifade (Eq 3)ile arka plan için düzeltilmiş daha fazla hesaplama, elde edilen otokorelasyon genlik (en yüksek değer, g(0)T) ile önce kaldırılır:
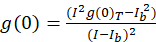
nerede benb hücre hariç bir arka plan bölgeden gelen ortalama yoğunluğu olduğunu. Küme yoğunluğu veya floresan nesneleri, yoğunluğu (Eq 4)tarafından tanımlanır:
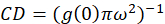
Burada açıklanan protokolünde bir normalleştirilmiş otokorelasyon işlevi artan kayma lag ile 1.0 yaklaşan bir değere çürüme gözlem temel varsayımı ile küme yoğunluğu (CD), sade bir şekilde hesaplanması daha ayrıntılı. Maksimum kayma gecikme ile yoğunluk değerleri floresans artık herhangi bir korelasyon yoktur ve böylece bir korelasyon hesaplamalar bu bölge, daha sonra bölünür Bu yoğunluğu ile çarpılır bir yoğunluk değerini bilgisayar Meydanı 1.0 için eşit olan tanımı gereği bu yoğunluk. Böylece, küme yoğunluğu bir normalleştirilmiş otokorelasyon işlevden 1.0 önce onun karşılıklı (Eq 5)alarak normalleştirilmiş otokorelasyon işlevden çıkararak hesaplanabilir:
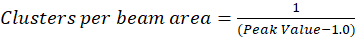
Eni çevrenin daha da kalibrasyon enstrümanın noktaya yayılmış işlev alanı içinde bulunan küme sayısı quantitate için gerçekleştirilebilir. Bu kalibrasyon görüntü korelasyon spektroskopisi çözümleme sırasında kullanılan aynı optik koşullar kullanarak gerçekleştirilmelidir.
Protocol
Representative Results
Discussion
Biz bu protokol için tarif görüntü korelasyon spektroskopisi (ICS) Teknik uzman Dedektörleri için gerek kalmadan standart confocal mikroskoplar kullanır. Açıklanan ICS tekniği artan istatistiksel analiz için birden fazla tedavi koşullardan hızlı örnekleme sağlamak için köklü immunocytochemistry yöntemleri kullanır. Bu metodoloji kadar tam olarak floresans dalgalanmaları floresans gibi confocal bir birim aracılığıyla difüzyon mobil moleküllerin korelasyon dayalı alternatif tek molekül teknikl…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Çekmek–dan NHMRC (arkadaş grubu 1084178 ve hibe 1087850, 1030469, 1075898 (AMS)), fon yazarlar kabul kanser Avustralya, Ludwig kanser araştırmaları, John Reid T güvenir, tedavi beyin kanseri Vakfı, La Trobe Üniversitesi ve Victoria kanser Ajansı. Operasyonel altyapı destek programı Victoria Hükümeti tarafından sağlanan fon, Avustralya da kabul edilmektedir.
Materials
| Nunc Lab-Tek II Chambered Coverglass – 8 well | ThermoFisher Scientific | 155409 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 10099141 | |
| TrypLE Express Enzyme (1x), no phenol red | ThermoFisher Scientific | 12604021 | |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Goat anti-Human IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | ThermoFisher Scientific | A11013 | |
| TetraSpeck Fluorescent Microsphere Standards 0.1µm | ThermoFisher Scientific | T7279 | |
| Cetuximab | Merck Serono | 3023715501 | |
| Parafilm M 38mx100mm | Merck Millipore | BRND701605 | |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | ProSciTech | C004 | |
| Recombinant Human EGF | R&D System | 236-EG |
References
- Scott, A. M., Wolchok, J. D., Old, L. J. Antibody therapy of cancer. Nature reviews. Cancer. 12 (4), 278-287 (2012).
- Parslow, A. C., Parakh, S., Lee, F. -. T., Gan, H., Scott, A. Antibody-Drug Conjugates for Cancer Therapy. Biomedicines. 4 (3), 14 (2016).
- Sorkin, A., Waters, C. M. Endocytosis of growth factor receptors. BioEssays. 15 (6), 375-382 (1993).
- Pawley, J. . Handbook of Biological Confocal Microscopy. , (2006).
- Petersen, N. O., Höddelius, P. L., Wiseman, P. W., Seger, O., Magnusson, K. E. Quantitation of membrane receptor distributions by image correlation spectroscopy: concept and application. Biophysical Journal. 65 (3), 1135-1146 (1993).
- Wiseman, P. W., Petersen, N. O. Image Correlation Spectroscopy. II. Optimization for Ultrasensitive Detection of Preexisting Platelet-Derived Growth Factor-β Receptor Oligomers on Intact Cells. Biophysical Journal. 76 (2), 963-977 (1999).
- Costantino, S., Comeau, J. W. D., Kolin, D. L., Wiseman, P. W. Accuracy and Dynamic Range of Spatial Image Correlation and Cross-Correlation Spectroscopy. Biophysical Journal. 89 (2), 1251-1260 (2005).
- Claire Robertson, S. C. G. Theory and practical recommendations for autocorrelation-based image correlation spectroscopy. Journal of Biomedical Optics. 17 (8), 080801 (2012).
- Ciccotosto, G. D., Kozer, N., Chow, T. T. Y., Chon, J. W. M., Clayton, A. H. A. Aggregation Distributions on Cells Determined by Photobleaching Image Correlation Spectroscopy. Biophysical Journal. 104 (5), 1056-1064 (2013).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43 (1 Suppl), 25-30 (2007).
- Rappaz, B., Wiseman, P. W. Image correlation spectroscopy for measurements of particle densities and colocalization. Current protocols in cell biology. , (2013).
- tferr/Scripts: BAR 1.5.1. Zenodo Available from: https://zenodo.org/record/495245 (2017)
- Elson, E. L. Fluorescence Correlation Spectroscopy: Past, Present, Future. Biophysical Journal. 101 (12), 2855-2870 (2011).
- Jares-Erijman, E. A., Jovin, T. M. Imaging molecular interactions in living cells by FRET microscopy. Current opinion in chemical biology. 10 (5), 409-416 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-Resolution Fluorescence Microscopy. dx.doi.org.ez.library.latrobe.edu.au. 78 (1), 993-1016 (2009).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. The Journal of Cell Biology. 190 (2), 165-175 (2010).
- Nohe, A., Petersen, N. O. Image Correlation Spectroscopy. Sci. Signal. (417), pl7 (2007).

