Konfokalmikroskopi avslöjar Cell Surface Receptor Aggregation genom bilden korrelation spektroskopi
Summary
Konformation och klustring förändringar kan ge antikroppar som binder till rikta receptorer på cellytan. Dessa dynamiska förändringar påverkar för kännetecknar läkemedelsutveckling i målceller. Detta protokoll använder konfokalmikroskopi och bild korrelation spektroskopi genom ImageJ/FIJI att kvantifiera omfattningen av receptorn klustring på cellytan.
Abstract
Konfokalmikroskopi ger en tillgänglig metod för att fånga sub cellulära interaktioner kritiska för karakterisering och vidareutveckling av prekliniska agenter märkta med fluorescerande sonder. Med senaste framstegen i antikropp baserat cytotoxiska läkemedel är leveranssystem, förstå de förändringar som induceras av dessa agenter inom sfären av receptorn aggregering och internalisering av avgörande betydelse. Detta protokoll utnyttjar den väletablerade metodiken av fluorescerande immuncytokemi och öppen källkod FIJI distribution av ImageJ, med dess inbyggda autokorrelation och bild matematiska funktioner, att utföra rumsliga bilden korrelation spektroskopi (ICS). Detta protokoll quantitates fluorescerande intensiteten av märkt receptorer som en funktion av området balk i mikroskopet confocal. Detta ger ett kvantitativt mått av målet molekyl aggregation på cellytan. Denna metod är inriktad på karakterisering av statiska celler med potential att expandera till temporal utredningar av receptorn aggregation. Detta protokoll presenterar en tillgänglig metod för att tillhandahålla kvantifiering av klustring händelser som inträffar på cellytan, använder väl etablerade tekniker och icke specialiserad bildhantering apparater.
Introduction
Utveckling av terapeutiska antikroppar har visat anmärkningsvärd framgång vid behandling av flera tumör typer1. De senaste framstegen i antikropp-drogen konjugat (ADC) surface som leveransmekanismer för cytotoxiska substanser har utökat kraven för att förstå dynamiken i antikropp: receptor interaktioner på cellen2. Efter framgångsrika målinriktning av en antikropp till cell surface receptorn, kan dessa komplex framkalla liknande aggregering mönster som de som observerades i ligand: antikropp interaktioner3. Förändringar i receptorn aggregation kan framkalla förändringar i membran och resultatet i internalisering av receptorn och dess avlägsnande från cellytan. I samband med ett antikropp-läkemedelskonjugat släpper denna process därefter cytotoxiska nyttolasten i internaliserade endosomes och därefter cytoplasman, vilket resulterar i effektiv cell dödande.
Konfokalmikroskopi har lämnat ett effektivt sätt att visualisera dessa viktiga interaktioner av antikroppar och deras mål receptorer4. För att utforska förändringarna om sammanläggning av målmolekyl på cellytan detta protokoll använder tredjeparts efterbearbetning av konfokalmikroskopi bilder via en rumslig bild korrelation spektroskopi (ICS) teknik 5,6,7 .
Grunden för bilden korrelation spektroskopi är observationen att rumsliga fluorescens intensitet fluktuationer delar en relation till tillståndet densitet och aggregering av de märkta strukturerna. Denna relation upprättas efter beräkningen av en spatial autokorrelation funktion av en tagen bild5.
Alla varianter av bilden korrelation spektroskopi kräver beräkning av en bild autokorrelation. Detta följs av passande denna funktion till en tvådimensionell Gaussisk kurva för utvinning av kvantitativa aggregation tillstånd parametrar som ingår i bilden. Enkelt uttryckt innebär beräkning av en bild autokorrelation jämföra alla möjliga pixel paren som ingår i en bild och beräkna sannolikheten att båda lika så ljust som varandra. Detta visualiseras som en funktion av avstånd och riktningar av pixel separation8.
Det teoretiska ramverket för den bilden korrelation spektroskopin inrättades och definieras av Petersen och Wiseman et al. 5 , 6. i detta protokoll, autokorrelation beräkningarna utförs i Fiji/ImageJ samt ett kalkylbladsprogram, till grund för funktionen intensitet fluktuation spatial autokorrelation kan beskrivas som (Eq 1):
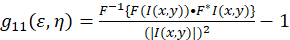
där F representerar fouriertransformen; F−1 inversen Fourier transform; F * dess komplexa konjugatet; och rumsliga eftersläpning variabler ε och η. I rumsliga ICS, som beskrivs i detta protokoll, kan autokorrelation funktion beräknas med hjälp av en 2D fast Fourier transform algoritm7,9. Autokorrelation på noll rumsliga avskiljandet annars känd som noll-lag, g11(0,0), ger omvänd medeltalet för antalet partiklar per balk av mikroskopet. Det kan erhållas genom att montera funktionen spatial autokorrelation till en tvådimensionell Gaussisk funktion (Eq 2):
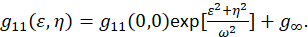
Som pixlar fångas inom en bild ingår i ett set område och dessa mätningar inte utökar till oändlighet, är den termen g∞ används som en offset för långväga rumsliga korrelationer som finns i bilden. För molekylär och medelstora aggregat, ω funktionen point-spread i mikroskopet och beskrivs av den full bredden på halv-maximum av funktionen spatial autokorrelation. Området som ingår i funktionen punkt spridningen av instrumentet kan kalibreras med hjälp av sub resolution fluorescerande pärlor.
För bild korrelation spektroskopi protokollet beskrivs häri, utförs den autokorrelation och matematiska funktioner som krävs för att slutföra ICS med plattformen med öppen källkod i imaging-bearbetning, Fiji10, en fördelning av ImageJ program11,12. Fiji/ImageJ använder tredjeparts förinstallerade snabb Fourier omformningen i funktionen FFT Math. Denna funktion minskar tidsåtgången vid denna beräkning beräkning genom att minska dataområdet med en faktor två i varje dimension13. Eftersom funktionen 2D autokorrelation är ungefärligt symmetrisk i x, y-axeln, kan en enda rad profil tomt genom autokorrelation bilden användas att mäta den råa autokorrelation som en funktion av den rumsliga eftersläpningen. Noll-lag buller tas bort före ytterligare beräkning, med resulterande autokorrelation amplituden (toppvärdet, g(0)T) korrigerat för bakgrund med uttrycket (Eq 3):
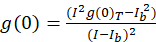
där jagb är genomsnittliga intensiteten från en bakgrund regionen exklusive cellen. Den kluster densitet eller täthet av fluorescerande objekt, definieras av (Eq 4):
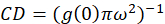
I protokollet beskrivs häri, ytterligare vi helt enkelt beräkningen av klustret densitet (CD), med antagandet baserat på observationen att en normaliserad autokorrelation funktion kommer att förfalla till ett värde som närmar sig 1,0 med ökande rumsliga eftersläpning. Med maximal rumsliga eftersläpning, finns det inte längre någon korrelation mellan fluorescens intensitetsvärdena och således utan en korrelation beräkningarna på denna region computing värdet på en intensitet som multipliceras denna intensitet som divideras därefter med den torget som intensitet, som per definition är lika med 1,0. Klustret densitet från en normaliserad autokorrelation funktion kan således beräknas genom att subtrahera 1.0 från normaliserade autokorrelation funktion innan dess ömsesidiga (Eq 5):
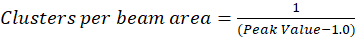
Ytterligare kalibrering av området balk kan utföras för att kvantifiera antalet kluster som finns inom området med funktionen punkt spridningen av instrumentet. Denna kalibrering måste utföras med samma optiska villkor används under bilden korrelation spektroskopi analysen.
Protocol
Representative Results
Discussion
Tekniken med bild korrelation spektroskopi (ICS) som vi beskriver i detta protokoll använder standard confocal Mikroskop utan behov av specialiserade detektorer. Den ICS-teknik som beskrivs utnyttjar väletablerade immuncytokemi metoder att ge för snabb provtagning av flera behandling villkor för ökad statistisk analys. Denna metod gör det med en liten minskning av absolut precision jämfört med alternativa enda molekyl tekniker som bygger på sambandet mellan fluorescens fluktuationer av mobila molekyler sprida ge…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Författarna erkänner finansieringsstöd från NHMRC (gemenskap 1084178 och bidrag 1087850, 1030469, 1075898 (AMS)), Cancer Australien, Ludwig Cancer Research, John T Reid förtroenden, bota hjärnan Cancer Foundation, La Trobe University och byråns Victoria Cancer. Finansiering från operativa infrastrukturen supportprogrammet som tillhandahålls av den viktorianska regeringen, är Australien också erkänt.
Materials
| Nunc Lab-Tek II Chambered Coverglass – 8 well | ThermoFisher Scientific | 155409 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 10099141 | |
| TrypLE Express Enzyme (1x), no phenol red | ThermoFisher Scientific | 12604021 | |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Goat anti-Human IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | ThermoFisher Scientific | A11013 | |
| TetraSpeck Fluorescent Microsphere Standards 0.1µm | ThermoFisher Scientific | T7279 | |
| Cetuximab | Merck Serono | 3023715501 | |
| Parafilm M 38mx100mm | Merck Millipore | BRND701605 | |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | ProSciTech | C004 | |
| Recombinant Human EGF | R&D System | 236-EG |
References
- Scott, A. M., Wolchok, J. D., Old, L. J. Antibody therapy of cancer. Nature reviews. Cancer. 12 (4), 278-287 (2012).
- Parslow, A. C., Parakh, S., Lee, F. -. T., Gan, H., Scott, A. Antibody-Drug Conjugates for Cancer Therapy. Biomedicines. 4 (3), 14 (2016).
- Sorkin, A., Waters, C. M. Endocytosis of growth factor receptors. BioEssays. 15 (6), 375-382 (1993).
- Pawley, J. . Handbook of Biological Confocal Microscopy. , (2006).
- Petersen, N. O., Höddelius, P. L., Wiseman, P. W., Seger, O., Magnusson, K. E. Quantitation of membrane receptor distributions by image correlation spectroscopy: concept and application. Biophysical Journal. 65 (3), 1135-1146 (1993).
- Wiseman, P. W., Petersen, N. O. Image Correlation Spectroscopy. II. Optimization for Ultrasensitive Detection of Preexisting Platelet-Derived Growth Factor-β Receptor Oligomers on Intact Cells. Biophysical Journal. 76 (2), 963-977 (1999).
- Costantino, S., Comeau, J. W. D., Kolin, D. L., Wiseman, P. W. Accuracy and Dynamic Range of Spatial Image Correlation and Cross-Correlation Spectroscopy. Biophysical Journal. 89 (2), 1251-1260 (2005).
- Claire Robertson, S. C. G. Theory and practical recommendations for autocorrelation-based image correlation spectroscopy. Journal of Biomedical Optics. 17 (8), 080801 (2012).
- Ciccotosto, G. D., Kozer, N., Chow, T. T. Y., Chon, J. W. M., Clayton, A. H. A. Aggregation Distributions on Cells Determined by Photobleaching Image Correlation Spectroscopy. Biophysical Journal. 104 (5), 1056-1064 (2013).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43 (1 Suppl), 25-30 (2007).
- Rappaz, B., Wiseman, P. W. Image correlation spectroscopy for measurements of particle densities and colocalization. Current protocols in cell biology. , (2013).
- tferr/Scripts: BAR 1.5.1. Zenodo Available from: https://zenodo.org/record/495245 (2017)
- Elson, E. L. Fluorescence Correlation Spectroscopy: Past, Present, Future. Biophysical Journal. 101 (12), 2855-2870 (2011).
- Jares-Erijman, E. A., Jovin, T. M. Imaging molecular interactions in living cells by FRET microscopy. Current opinion in chemical biology. 10 (5), 409-416 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-Resolution Fluorescence Microscopy. dx.doi.org.ez.library.latrobe.edu.au. 78 (1), 993-1016 (2009).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. The Journal of Cell Biology. 190 (2), 165-175 (2010).
- Nohe, A., Petersen, N. O. Image Correlation Spectroscopy. Sci. Signal. (417), pl7 (2007).

