مجهر ريفليكتوميتريك الطيفية على محاور عصبية ميليناتيد في الموقع
Summary
نقدم هنا، بروتوكول خطوة بخطوة للتصوير محاور عصبية myelinated في شريحة الدماغ ثابت باستخدام النانو خالية من التسمية التصوير تقنية تستند إلى ريفليكتوميتري الطيفية.
Abstract
في الجهاز العصبي الثدييات، يوفر المايلين عزل كهربائي التي انورابينج الألياف إكسون في دوامة متعدد الطبقات. مستوحاة من هندسته المعمارية سوبسيلولار نظم عالية، وضعنا مؤخرا طريقة جديدة لتصوير، المسمى ريفليكتوميتري الطيفية (صبري)، الذي يتيح التصوير النانوي خالية من التسمية لم يسبق لها مثيل من محاور عصبية myelinated يعيش في الموقع. والمبدأ الأساسي الحصول على معلومات نانوستروكتورال عن طريق تحليل الطيف الانعكاس لهيكل سوبسيلولار متعدد الطبقات. في هذه المقالة، نحن وصف بروتوكول مفصلة خطوة بخطوة للقيام تصوير صبري أساسية من أنسجة عصبية باستخدام نظام مجهرية [كنفوكل] تجارية، مزودة بليزر الضوء الأبيض وعامل تصفية الانضباطي. نحن تغطي إجراءات إعداد عينة، اقتناء البيانات الطيفية، ومعالجة للحصول على معلومات نانوستروكتورال الصور.
Introduction
في الجهاز العصبي الثدييات، يوفر المايلين التوصيل السريع العصب وسلامة محواري قبل انورابينج الألياف إكسون مع مانعات الغشائي متعدد الطبقات. يتكون هيكلها المتعدد الطبقات من النانو رقيقة-أفلام تتألف من أغشية البلازما بالتناوب (~ 5 نانومتر)، سيتوسول (~ 3 نانومتر)، والأماكن خارج الخلية (~ 7 نانومتر)1،2. مجهرية البصرية، بما في ذلك مجهرية فائقة القرار الأخير، ليست مناسبة لمراقبة ديناميات النانو المايلين بسبب القرار غير كاف بسبب الحيود الضوئية3،،من45. على الرغم من أن المجهر الإلكتروني يمكن أن توفر التفاصيل الدقيقة ل nanostructure المايلين، أنها لا تتوافق مع النظم البيولوجية الحية بسبب العينة الغازية عاليا الأعمال التحضيرية المتعلقة بالتثبيت الكيميائي وأولتراسيكتيونينج6،7 . حتى وقت قريب، كان هناك لا تقنية تنطبق على مراقبة ديناميات النانو من محاور عصبية ميليناتيد في الموقع.
سبق ذكر شين et al. أن محاور عصبية myelinated المعرض الانعكاس الخفيفة الملونة8. باعتماد التحليل سبيكتروسكوبيك في الضوء المنعكس، وضعنا طريقة تصوير جديدة للتصوير بالنانو لمحاور عصبية myelinated، المسمى ريفليكتوميتري الطيفية (صبري)9. ويستند صبري تدخل الأغشية الرقيقة التي تحدث في بنية متعددة الطبقات من غمد المايلين (الشكل 1). بالألياف البصرية والمحاكاة على مختلف محاور عصبية، أننا قد كشفت أن الطيف الانعكاس دالة دورية وافينومبير وعن تواتر (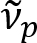 ) تناسبا عكسيا مع قطر إكسون (د). هذه العلاقة البسيطة (
) تناسبا عكسيا مع قطر إكسون (د). هذه العلاقة البسيطة (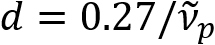 ) ويقدم سهلة التحديد الكمي لقطر إكسون من البيانات صبري. الاستفادة من هذا، يمكننا كشف إكسون انتشارا انتفاخ تحت إصابات الدماغ الرضية معتدل في تقريرنا السابق.
) ويقدم سهلة التحديد الكمي لقطر إكسون من البيانات صبري. الاستفادة من هذا، يمكننا كشف إكسون انتشارا انتفاخ تحت إصابات الدماغ الرضية معتدل في تقريرنا السابق.
نظام صبري يرتكز على الفحص المجهري [كنفوكل] ويتكون من مصدر الليزر المتخصصة ومرشحات (الشكل 2). مصدر الإدخال ليزر الضوء الأبيض، توفير النطاق العريض الإخراج الطيفية المرئية إلى مناطق الأشعة تحت الحمراء. لمسح طيفي، مجهزة النظام مع اثنين من الأجهزة البصرية أكوستو: أكوستو البصرية الانضباطي مرشح (أوتف) لإيصال طول موجي محدد من مصدر الإدخال النطاق العريض والخائن شعاع أكوستو البصرية (أوبس) لتوجيه المحدد ينعكس الطول الموجي للجهاز. البرنامج للفحص المجهري [كنفوكل] الفائقة الطيفية (انظر الجدول للمواد) يوفر خيار مسح طيفية لتخصيص للتتابع الحصول على صور الانعكاس في مختلف الأطوال الموجية الإدخال. وبالإضافة إلى ذلك، يمكن أن تتداخل زيغ حاسمة في القياس الطيفي؛ ولذلك، يوصي باستخدام عدسة الهدف أبوتشرومات.
ملاحظة، الليزر الضوء الأبيض تنتج ناتج طيفية متفاوتة والمكونات الضوئية تؤثر أيضا على الشخصية الطيفية. ولذلك، يحتاج الأطياف المكتسبة للمعايرة للتحليل الكمي اللاحقة. مرآة فضة محمية يستخدم عادة كمرجع، التي تنص انعكاس ثابتة تقريبا (> 97 في المائة) على مدى المنطقة المرئية الكاملة. ثم تنقسم أطياف المكتسبة من الأطياف المرجعية من النسخة المتطابقة.
يحدد حجم الخطوة الطيفية لمسح طيفي سرعة اقتناء؛ وبالتالي، ينبغي أن يكون الأمثل. كما إكسون أكبر فترة طيفية أعلى، فهو يتطلب الطيفية العينات الدقيقة. على سبيل المثال، قد إكسون التي يبلغ قطرها 10 ميكرون، واحدة من أكبر محاور الفسيولوجية عصبية، فترة طيفية ~ 8 نانومتر. عن طريق تطبيق معايير العينات نايكست، استخدمنا الفاصل الزمني أخذ العينات الطيفية 4 نانومتر لتغطية جميع محاور عصبية الفسيولوجية في أنسجة عصبية الماوس. هذا النهج يأخذ عادة خلال عدة ثوان لمسح كامل طيفية وهكذا ليست مناسبة للتطبيقات في فيفو ، حيث يتداخل الحركة الفسيولوجية (مثل التنفس وضربات القلب) اقتناء الطيفية مستقرة. ونحن سابقا حل هذه المسألة خلال تحرير مجهر تستقيم مخصصة، مصممة للحصول على الطيف الكامل لكل نقطة باستخدام مطياف صفيف (اكتساب السرعة ≈ 30 مللي كل بكسل).
في هذا التقرير، يصف لنا بروتوكول مفصل على تصوير صبري على شريحة الدماغ ثابتة، التي يمكن أن يؤديها في مجهر الطيفي تجارية (انظر الجدول للمواد). وهكذا، يمكن إكمال البروتوكول من المجربون دون خبرة في الأجهزة البصرية. ونحن أيضا تغطية المشاكل المحتملة واستكشاف الأخطاء وإصلاحها للحصول على البيانات وتحليلها صبري.
Protocol
Representative Results
Discussion
صبري هو خال من تسمية تصوير أسلوباً جديداً يستند إلى قياس التداخل الطيفي، الذي يقدم معلومات نانوية في محاور عصبية myelinated لايف للمرة الأولى،. في اقتناء البروتوكول الحالي، القرار المكانية لقطر إكسون وسام 10 نانومتر. وعلاوة على ذلك، يستخدم سبيري أوامر من حجم أقل جرعة خفيفة مقارنة بغيرها ميكروس…
Disclosures
The authors have nothing to disclose.
Acknowledgements
وأيد هذا العمل بمعهد العلوم الأساسية (IBS-R015-D1) ومن “برنامج بحوث العلوم الأساسية” عبر الوطنية بحوث مؤسسة من كوريا (جبهة الخلاص الوطني) تمولها وزارة التعليم (2017R1A6A1A03015642).
Materials
| Glass cutter | – | – | Can be purchased in a local convenience store or online stores. |
| Nail polish | – | – | Can be purchased in a local convenience store or online stores. |
| Apochromat objective 40×, NA 1.1 | Leica Microsystems | 15506357 | Water-immersion type |
| Fluoromyelin Green | Thermo Fisher | F34651 | Alternatively, Fluoromyelin Red (F34652) can be used. |
| Leica SP8 TCS microscope | Leica Microsystems | SP8 | Refer to the "Configuration of microscope" in Introduction Section for details. |
| Imaging software | Leica Microsystems | LAS-X | – |
| Matlab | MathWorks | – | – |
| Mirror | Thorlabs | PF10-03-P01 | Coated with protected silver. |
| Phosphate-buffered saline (PBS) | Life technologies | 14190-136 | – |
| Paraformaldehyde | Biosolution | BP031a | 4% v/v in PBS |
| Cover slip | Thermo Fisher | 3306 | Thickness: #1 (0.13 to 0.17 mm) |
| Slide glass | Muto Pure Chemicals | 5116-20F | Thickness: ~1 mm |
| Super glue | Henkel | Loctite 406 | Use a dispensing equipment to avoid skin or eye contact. |
| Syringe pump | Brainetree Scientific | BS-8000 DUAL | – |
| Vibratome | Leica Biosystems | VT1200S | – |
| White-light laser | NKT photonics | EXB-6 | EXB-6 was discontinued and replaced by EXU-6. |
References
- Fernandez-Moran, H., Finean, J. B. Electron microscope and low-angle x-ray diffraction studies of the nerve myelin sheath. Journal of Cell Biology. 3, (1957).
- Blaurock, A. E. The spaces between membrane bilayers within PNS myelin as characterized by X-ray diffraction. Brain Research. 210, 383-387 (1981).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. , 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED nanoscopy of actin dynamics in synapses deep inside living brain slices. Biophysics Journal. 101, 1277-1284 (2011).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nature Methods. 5, 155-157 (2008).
- Peters, A., Sethares, C. Is there remyelination during aging of the primate central nervous system?. Journal of Comparative Neurology. 460, 238-254 (2003).
- De Campos Vidal, B., Silveira Mello, M. L., Caseiro-Filho, A. C., Godo, C. Anisotropic properties of the myelin sheath. Acta Histochemica. 66, 32-39 (1980).
- Schain, A. J., Hill, R. A., Grutzendler, J. Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nature Medicine. 20, 443-449 (2014).
- Kwon, J., et al. Label-free nanoscale optical metrology on myelinated axons in vivo. Nature Communication. 8, 1832 (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. JoVE. (65), e3564 (2012).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. JoVE. (112), e54024 (2016).
- Waldchen, S., Lehmann, J., Klein, T., Van De Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348 (2015).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14, 593-599 (2017).
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. Journal of Cell Biology. 148, 45-58 (2000).

