제자리에 Myelinated 축 삭에 스펙트럼 Reflectometric 현미경
Summary
여기, 우리는 레이블 없는 나노 이미징 기술 스펙트럼 셋에 기반을 사용 하 여 고정된 뇌 조각에 myelinated 축 삭 이미징을 위한 단계별 프로토콜 제시.
Abstract
포유류 신 경계에서 수 초 다층된 소용돌이에 축 삭 섬유 enwrapping 여 전기 절연을 제공 합니다. 그것의 높은 조직 subcellular 아키텍처에 의해 영감을, 우리 최근 전례 없는 레이블 없는 나노 이미징 라이브 myelinated 축 삭 제자리의 가능 하 게 스펙트럼 셋 (SpeRe) 라는 새로운 이미징 적임 개발. 기본 원리는 다층된 subcellular 구조의 반사율 스펙트럼을 분석 하 여 nanostructural 정보를 얻을 것입니다. 이 문서에서는, 우리는 화이트 라이트 레이저와 가변 필터 상업 confocal 현미경 시스템을 사용 하 여 신경 조직의 기본 SpeRe 이미징 수행 하기 위한 자세한 단계별 프로토콜을 설명 합니다. 샘플 준비, 스펙트럼 데이터 및 nanostructural 정보를 얻기 위해 처리 하는 이미지의 취득의 절차 설명 합니다.
Introduction
포유류 신 경계에서 수 초 다층된 막 덮개와 축 삭 섬유 enwrapping 여 빠른 신경 전도 및 axonal 무결성 제공 합니다. 그것의 다층된 구조 번갈아 나노 박막-필름 플라즈마 세포 막의 구성의 구성 (~ 5 nm), cytosol (~ 3 nm), 및 세포 외 공간 (~ 7 nm)1,2. 광학 현미경 검사 법, 최근 슈퍼 해상도 현미경을 포함 하 여 광학 회절3,,45로 인해 부족 한 해상도 인해 나노 myelin 역학을 관찰을 위한 적합 하지 않습니다. 전자 현미경은 myelin nanostructure의 좋은 정보를 제공할 수 있습니다, 그것은 화학 고정 및 ultrasectioning6,7 매우 침략 샘플 준비 인 생활 생물 학적 시스템와 호환 . 최근까지, 거기 되었습니다 아무 기술 나노 역학 myelinated 축 삭 제자리의 관찰에 적용.
Schain 외. 이전 myelinated 축 삭 다채로운 빛 반사율8전시 보고. 채택 하 여 반사 된 빛의 분 광 분석, 우리는 새로운 이미징 형식 스펙트럼 셋 (SpeRe)9라는 myelinated 축 삭의 나노 이미징에 대 한 고안 했다. SpeRe 박막 간섭 myelin 칼 집 (그림 1)의 다층된 구조에서 발생을 기반으로 합니다. 다양 한 축 삭에 광학 시뮬레이션에 의해 우리는 밝혀 그 반사율 스펙트럼 wavenumber 및 그것의 주기 주기 기능 (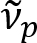 )은 축 삭 직경 (d)에 반비례 한다. 이 간단한 관계 (
)은 축 삭 직경 (d)에 반비례 한다. 이 간단한 관계 (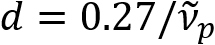 ) SpeRe 데이터에서 축 삭 직경의 손쉬운 정량화를 제공 합니다. 이 활용 하 여, 우리가 우리의 이전 보고서에서 온화한 외상 성 뇌 손상에서 불 룩 유행 축 삭을 밝혔다.
) SpeRe 데이터에서 축 삭 직경의 손쉬운 정량화를 제공 합니다. 이 활용 하 여, 우리가 우리의 이전 보고서에서 온화한 외상 성 뇌 손상에서 불 룩 유행 축 삭을 밝혔다.
SpeRe 시스템 confocal 현미경 검사 법에 따라 특수 레이저 소스 구성 되어 있으며 필터 (그림 2). 입력된 소스 화이트 라이트 레이저, 광대역 스펙트럼 출력 적외선 영역 표시를 제공 하는. 스펙트럼 검사에 대 한 시스템은 갖추고 두 acousto 광학 장치: 반영 선택한 지도 대 한 입력된 광대역 소스와 acousto 파이버 빔 스플리터 (AOBS)에서 선택 된 파장을 제공 하는 acousto 광학 가변 필터 (AOTF) 검출기의 파장 Hyperspectral confocal 현미경 검사 법에 대 한 소프트웨어 ( 재료의 표참조) 순차적으로 다양 한 입력된 파장에서 반사율 이미지를 수집 하는 사용자 정의 스펙트럼 스캔 옵션을 제공 합니다. 또한, 색수차 수 있습니다 비판적으로 간섭 스펙트럼 측정; 따라서,는 apochromat 렌즈의 사용을 권장 합니다.
메모의 화이트 라이트 레이저 고르지 스펙트럼 출력을 생성 하 고 광학 구성 요소 스펙트럼 프로필에도 영향을 줍니다. 따라서, 인수 스펙트럼 후속 정량 분석에 대 한 보정 필요. 보호은 거울은 일반적으로 전체 표시 영역 위로 거의 일정 한 반사율 (> 97%)을 제공 하는 참조로 사용 됩니다. 인수 스펙트럼 다음 미러에서 참조 스펙트럼으로 나누어집니다.
스펙트럼 검사에 대 한 스펙트럼 스텝 크기 결정 수집 속도; 따라서, 그것은 최적화가 필요 합니다. 더 큰 축 삭은 더 높은 스펙트럼 기간, 그것은 스펙트럼 샘플링을 세밀 하 게 필요 합니다. 예를 들어 가장 큰 생리 축 삭 중 10 µ m의 직경을 가진 축 삭 스펙트럼의 기간이 ~ 8 nm. 나이 키스 트 샘플링 조건을 적용 하 여 우리 고용 스펙트럼 샘플링 간격 4 nm 마우스 신경 조직에서 모든 생리 축 삭을 커버. 이 방법은 일반적으로 전체 스펙트럼 검사에 대 한 몇 초 동안 걸리며 따라서 적합 하지 않습니다 vivo에서 응용 프로그램 (예: 호흡 및 심장 박동) 생리 모션 안정적 스펙트럼 수집을 방해. 우리는 이전 배열 분석기 (수집 속도 ≈ 픽셀 당 30 밀리초)를 사용 하 여 각 지점에 대 한 전체 스펙트럼을 확보 하도록 설계 된 사용자 지정된 수직 현미경 계측 하 여이 문제를 해결.
이 보고서에서 우리는 상업 hyperspectral 현미경에서 실행 될 수 있는 고정된 뇌 조각에 SpeRe 이미징에 상세한 프로토콜을 설명 ( 재료의 표참조). 따라서, 프로토콜 광 계측에 전문성 없이 경험 하 여 완료할 수 있습니다. 우리는 또한 잠재적인 문제 및 수집 및 SpeRe 데이터의 분석에 대 한 문제 해결을 커버.
Protocol
Representative Results
Discussion
SpeRe는 새로운 라벨 무료 이미징 형식 스펙트럼 간섭계는 처음으로 라이브 myelinated 축 삭에서 나노 정보 제공에 따라 이다. 현재 수집 프로토콜에서 축 삭 직경에 대 한 공간적 해상도 10의 순서의 이다 nm. 또한, SpeRe 크기 순서 낮은 빛 복용량 다른 슈퍼 해상도 microscopies;에 비해 활용 따라서, phototoxicity 및 photobleaching에서 무료입니다. SpeRe myelinated 축 삭의 나노 역학 공부에 대 한 새로운 길을 제공할…
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 작품은 기초 과학 연구소 (IBS-R015-D1)에 의해 그리고 기본적인 과학 연구 프로그램을 통해 국가 연구 재단의 한국 (NRF) 교육부 (2017R1A6A1A03015642)에 의해 자금에 의해 지원 되었다.
Materials
| Glass cutter | – | – | Can be purchased in a local convenience store or online stores. |
| Nail polish | – | – | Can be purchased in a local convenience store or online stores. |
| Apochromat objective 40×, NA 1.1 | Leica Microsystems | 15506357 | Water-immersion type |
| Fluoromyelin Green | Thermo Fisher | F34651 | Alternatively, Fluoromyelin Red (F34652) can be used. |
| Leica SP8 TCS microscope | Leica Microsystems | SP8 | Refer to the "Configuration of microscope" in Introduction Section for details. |
| Imaging software | Leica Microsystems | LAS-X | – |
| Matlab | MathWorks | – | – |
| Mirror | Thorlabs | PF10-03-P01 | Coated with protected silver. |
| Phosphate-buffered saline (PBS) | Life technologies | 14190-136 | – |
| Paraformaldehyde | Biosolution | BP031a | 4% v/v in PBS |
| Cover slip | Thermo Fisher | 3306 | Thickness: #1 (0.13 to 0.17 mm) |
| Slide glass | Muto Pure Chemicals | 5116-20F | Thickness: ~1 mm |
| Super glue | Henkel | Loctite 406 | Use a dispensing equipment to avoid skin or eye contact. |
| Syringe pump | Brainetree Scientific | BS-8000 DUAL | – |
| Vibratome | Leica Biosystems | VT1200S | – |
| White-light laser | NKT photonics | EXB-6 | EXB-6 was discontinued and replaced by EXU-6. |
References
- Fernandez-Moran, H., Finean, J. B. Electron microscope and low-angle x-ray diffraction studies of the nerve myelin sheath. Journal of Cell Biology. 3, (1957).
- Blaurock, A. E. The spaces between membrane bilayers within PNS myelin as characterized by X-ray diffraction. Brain Research. 210, 383-387 (1981).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. , 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED nanoscopy of actin dynamics in synapses deep inside living brain slices. Biophysics Journal. 101, 1277-1284 (2011).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nature Methods. 5, 155-157 (2008).
- Peters, A., Sethares, C. Is there remyelination during aging of the primate central nervous system?. Journal of Comparative Neurology. 460, 238-254 (2003).
- De Campos Vidal, B., Silveira Mello, M. L., Caseiro-Filho, A. C., Godo, C. Anisotropic properties of the myelin sheath. Acta Histochemica. 66, 32-39 (1980).
- Schain, A. J., Hill, R. A., Grutzendler, J. Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nature Medicine. 20, 443-449 (2014).
- Kwon, J., et al. Label-free nanoscale optical metrology on myelinated axons in vivo. Nature Communication. 8, 1832 (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. JoVE. (65), e3564 (2012).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. JoVE. (112), e54024 (2016).
- Waldchen, S., Lehmann, J., Klein, T., Van De Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348 (2015).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14, 593-599 (2017).
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. Journal of Cell Biology. 148, 45-58 (2000).

