Spektrale Reflectometric Mikroskopie auf Markhaltige Axone In Situ
Summary
Hier präsentieren wir Ihnen eine Schritt für Schritt Protokoll für imaging Markhaltige Axone in einer festen Gehirn-Scheibe mit imaging-Technik basierend auf spektrale Reflectometry markierungsfreie Nanobereich.
Abstract
In einem Säugetier Nervensystem bietet Myelin eine elektrische Isolierung durch hüllt die Axon-Fasern in einer vielschichtigen Spirale. Inspiriert durch seine hoch organisiert subzelluläre Architektur, entwickelten wir vor kurzem eine neue bildgebende Modalität, benannt spektrale Reflectometry (brange), die noch nie da gewesenen markierungsfreie nanoskaligen Bildgebung von live Markhaltige Axone in Situermöglicht. Das Prinzip beruht auf nanostruktureller Auskunft durch die Analyse der Reflexion Spektrum der vielschichtigen subzelluläre Struktur. In diesem Artikel beschreiben wir ein detaillierte Schritt für Schritt-Protokoll für die Durchführung einer grundlegenden brange Bildgebung der nervösen Gewebe mit einem kommerziellen konfokale mikroskopische System, ausgestattet mit einem Weißlicht-Laser und einen durchstimmbaren Filter. Wir decken die Verfahren der Probenvorbereitung, Erwerb von Spektraldaten und Bildverarbeitung für nanostruktureller Informationsbeschaffung.
Introduction
In den Säugetieren Nervensystem bietet Myelin rasche Nervenleitung und axonalen Integrität durch hüllt die Axon-Fasern mit vielschichtigen häutigen scheiden. Seine vielschichtige Struktur besteht aus abwechselnd nanoskaligen Dünnschichten bestehend aus Plasmamembranen (~ 5 nm), Zellflüssigkeit (~ 3 nm), und extrazellulären Raum (~ 7 nm)1,2. Optische Mikroskopie, einschließlich der jüngsten Höchstauflösung Mikroskopie, eignen sich nicht für die Beobachtung der nanoskaligen Myelin Dynamik aufgrund ihrer unzureichenden Auflösung aufgrund der optischen Beugung3,4,5. Obwohl Elektronenmikroskopie feine Details der Myelin Nanostruktur bereitstellen können, ist es nicht kompatibel mit den lebenden biologischen Systemen aufgrund sehr invasive Probe Vorbereitungen mit chemischen Fixierung und Ultrasectioning6,7 . Bis vor kurzem gab es keine Technik anwendbar, nanoskaligen Dynamik der Markhaltige Axone in Situzu beobachten.
Schain Et Al. berichtete zuvor, dass Markhaltige Axone bunte Lichtreflexion8aufweisen. Durch die Annahme der Spektralanalyse auf das reflektierte Licht, haben wir eine neue bildgebende Modalität für nanoskalige Bildgebung Markhaltige Axone, benannt spektrale Reflectometry (brange)9entwickelt. Brange basiert auf der Dünnschicht-Störungen, die in den mehrschichtigen Aufbau der Myelinscheide (Abbildung 1). Durch optische Simulation auf verschiedenen Axone haben wir gezeigt, dass das Reflexionsvermögen-Spektrum eine periodische Funktion der Wellenzahl und seiner Periodizität ist (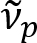 ) ist umgekehrt proportional zu den Axon-Durchmesser (d). Diese einfache Beziehung (
) ist umgekehrt proportional zu den Axon-Durchmesser (d). Diese einfache Beziehung (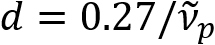 ) bietet einfache Quantifizierung der Axon Durchmesser aus den Daten der brange. Nutzen dies, offenbart wir das vorherrschende Axon prall unter milden traumatischen Hirnverletzungen in unserem vorherigen Bericht.
) bietet einfache Quantifizierung der Axon Durchmesser aus den Daten der brange. Nutzen dies, offenbart wir das vorherrschende Axon prall unter milden traumatischen Hirnverletzungen in unserem vorherigen Bericht.
Die brange System basiert auf konfokalen Mikroskopie und besteht aus einer speziellen Laserquelle und Filter (Abbildung 2). Die Eingabequelle ist ein Weißlicht-Laser, Breitband spektrale Leistung für Infrarot-Regionen sichtbar. Für die Spektral Scan, das System ist ausgestattet mit zwei Akusto-optische Geräte: ein Akusto-optischen Durchstimmbare Filter (Aventurien) für die Bereitstellung einer ausgewählten Wellenlänge von Breitband-Eingangsquelle und eine Akusto-optischen Strahlteiler (AOBS) für die Führung der ausgewählten reflektiert Wellenlänge zum Detektor. Die Software für die Hyperspektrale konfokalen Mikroskopie bietet (siehe Tabelle der Materialien) eine anpassbare spektrale Scanoption nacheinander die Reflexion Bilder bei verschiedenen Wellenlängen Eingang erwerben. Darüber hinaus können die chromatische Aberration kritisch in der spektralen Messung beeinträchtigen. Daher ist ein Apochromat Objektiv empfohlen.
Der Hinweis Weißlicht-Laser erzeugen eine ungleichmäßige spektrale Leistung und die optischen Komponenten beeinflussen auch die spektrale Profil. Daher müssen die erworbenen Spektren für die anschließende Quantitative Analyse kalibriert werden. Eine geschützte Silberspiegel dient in der Regel als Referenz, die eine nahezu konstante Reflexion (> 97 %) bietet über den vollen und sichtbaren Bereich. Die erworbenen Spektren werden dann durch die Referenz-Spektren aus dem Spiegel unterteilt.
Die spektrale Schrittweite für die Spektral Scan bestimmt die Geschwindigkeit, Erwerb; Es muss daher optimiert werden. Wie eine größere Axon eine höhere spektrale Periode wurde, erfordert es feiner spektrale Probenahme. Zum Beispiel hat ein Axon mit einem Durchmesser von 10 µm, eines der größten physiologischen Axone spektrale beträgt ca. 8 nm. Nach Nyquist Sampling Kriterien, wir Beschäftigten die spektrale Samplingintervall von 4 nm um die physiologischen Axone in die Maus Nervengewebe zu decken. Dieser Ansatz dauert in der Regel über mehrere Sekunden für eine volle spektrale Scan und damit ist nicht geeignet für in-Vivo Anwendungen, wo stört die physiologische Bewegung (z.B. Atmung und Herzschlag) stabile spektralen Erwerb. Wir lösten vorher dieses Problem durch Instrumentieren maßgeschneiderte aufrechte Mikroskop, entworfen, um das gesamte Spektrum für jeden Punkt mit einem Array Spektrometer (Erwerb Geschwindigkeit ≈ 30 ms pro Pixel) zu erwerben.
In diesem Bericht beschreiben wir ein detailliertes Protokoll auf der brange Bildgebung auf einer festen Gehirn-Scheibe, die in einem kommerziellen Hyperspektrale Mikroskop ausgeführt werden können (siehe Tabelle der Materialien). Somit kann das Protokoll von Experimentatoren ohne Fachkenntnisse in optischen Instrumenten erfolgen. Wir decken auch die potenziellen Probleme und Problembehandlung für Erfassung und Analyse von Daten der brange.
Protocol
Representative Results
Discussion
Brange ist eine neue markierungsfreie imaging-Modalität basierend auf spektrale Interferometrie, die zum ersten Mal im Leben Markhaltige Axone der nanoskaligen Informationen bietet. In der aktuellen Übernahme-Protokoll ist die räumliche Auflösung für den Axon Durchmesser des Ordens 10 nm. Darüber hinaus nutzt brange der Größenordnungen niedriger Lichtdosis im Vergleich zu anderen super-Resolution-Microscopies; Somit ist es frei von Phototoxizität und Immunofluoreszenz. Brange böte eine neue Allee für nanoskali…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde durch die Institute der Grundlagenforschung (IBS-R015-D1) und grundlegende Wissenschaft Forschungsprogramm durch die National Research Foundation von Korea (NRF) finanziert durch das Ministerium für Bildung (2017R1A6A1A03015642) unterstützt.
Materials
| Glass cutter | – | – | Can be purchased in a local convenience store or online stores. |
| Nail polish | – | – | Can be purchased in a local convenience store or online stores. |
| Apochromat objective 40×, NA 1.1 | Leica Microsystems | 15506357 | Water-immersion type |
| Fluoromyelin Green | Thermo Fisher | F34651 | Alternatively, Fluoromyelin Red (F34652) can be used. |
| Leica SP8 TCS microscope | Leica Microsystems | SP8 | Refer to the "Configuration of microscope" in Introduction Section for details. |
| Imaging software | Leica Microsystems | LAS-X | – |
| Matlab | MathWorks | – | – |
| Mirror | Thorlabs | PF10-03-P01 | Coated with protected silver. |
| Phosphate-buffered saline (PBS) | Life technologies | 14190-136 | – |
| Paraformaldehyde | Biosolution | BP031a | 4% v/v in PBS |
| Cover slip | Thermo Fisher | 3306 | Thickness: #1 (0.13 to 0.17 mm) |
| Slide glass | Muto Pure Chemicals | 5116-20F | Thickness: ~1 mm |
| Super glue | Henkel | Loctite 406 | Use a dispensing equipment to avoid skin or eye contact. |
| Syringe pump | Brainetree Scientific | BS-8000 DUAL | – |
| Vibratome | Leica Biosystems | VT1200S | – |
| White-light laser | NKT photonics | EXB-6 | EXB-6 was discontinued and replaced by EXU-6. |
References
- Fernandez-Moran, H., Finean, J. B. Electron microscope and low-angle x-ray diffraction studies of the nerve myelin sheath. Journal of Cell Biology. 3, (1957).
- Blaurock, A. E. The spaces between membrane bilayers within PNS myelin as characterized by X-ray diffraction. Brain Research. 210, 383-387 (1981).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. , 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED nanoscopy of actin dynamics in synapses deep inside living brain slices. Biophysics Journal. 101, 1277-1284 (2011).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nature Methods. 5, 155-157 (2008).
- Peters, A., Sethares, C. Is there remyelination during aging of the primate central nervous system?. Journal of Comparative Neurology. 460, 238-254 (2003).
- De Campos Vidal, B., Silveira Mello, M. L., Caseiro-Filho, A. C., Godo, C. Anisotropic properties of the myelin sheath. Acta Histochemica. 66, 32-39 (1980).
- Schain, A. J., Hill, R. A., Grutzendler, J. Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nature Medicine. 20, 443-449 (2014).
- Kwon, J., et al. Label-free nanoscale optical metrology on myelinated axons in vivo. Nature Communication. 8, 1832 (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. JoVE. (65), e3564 (2012).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. JoVE. (112), e54024 (2016).
- Waldchen, S., Lehmann, J., Klein, T., Van De Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348 (2015).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14, 593-599 (2017).
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. Journal of Cell Biology. 148, 45-58 (2000).

