Microscopía espectral reflectométrico en axones mielinizados en Situ
Summary
Aquí, presentamos un protocolo paso a paso de axones myelinated en un trozo de cerebro fija usando una nanoescala libre etiqueta técnica basado en reflectometría spectral de la proyección de imagen de la proyección de imagen.
Abstract
En un mamífero sistema nervioso, mielina proporciona un aislamiento eléctrico enwrapping las fibras del axón en una espiral de varias capas. Inspirado por su arquitectura subcelular altamente organizado, recientemente desarrollamos una nueva modalidad de imágenes, llamada reflectometría espectral (SpeRe), que permite la proyección de imagen de nanoescala etiqueta-libre sin precedentes de los axones myelinated vivo in situ. El principio subyacente es obtener información nano-estructural analizando el espectro de reflectancia de la estructura subcelular de varias capas. En este artículo se describe un protocolo detallado paso a paso para realizar una básica SpeRe la proyección de imagen de los tejidos nerviosos mediante un sistema microscopio confocal comercial, equipado con un láser de luz blanca y un filtro sintonizable. Cubrimos los procedimientos de preparación de muestras, adquisición de datos espectrales y procesamiento de imagen para obtener información de nano-estructural.
Introduction
En el mamífero sistema nervioso, mielina proporciona integridad axonal y conducción nerviosa rápida enwrapping las fibras de axones con varias capas envolturas membranosas. Su estructura multicapa se compone de alterna de nanoescala películas delgadas compuestas de membranas del plasma (~ 5 nm), citosol (~ 3 nm) y espacios extracelulares (~ 7 nm)1,2. Microscopía óptica, incluyendo la microscopía de superresolución recientes, no son adecuados para la observación de la dinámica de la mielina de escala nanométrica debido a su insuficiente resolución debido a la difracción óptica3,4,5. Aunque la microscopía electrónica puede proporcionar detalles finos de la nanoestructura de la mielina, no es compatible con los sistemas biológicos vivos debido a preparaciones de muestra altamente invasiva que involucra la fijación química y ultrasectioning6,7 . Hasta hace poco, no se ha producido ninguna técnica aplicable para observar dinámicas de nanoescala de axones myelinated en situ.
Schain Ciencias et al había divulgado previamente que axones myelinated exhiben colores reflectancia luz8. Adoptando el análisis espectroscópico de la luz reflejada, hemos ideado una nueva modalidad de imagen para imágenes a nanoescala de axones myelinated, llamado reflectometría espectral (SpeRe)9. SpeRe se basa en la interferencia de película delgada que ocurre en la estructura de varias capas de la vaina de mielina (figura 1). Por simulación óptica en varios axones, ha revelado que el espectro de reflectancia es una función periódica del número y su periodicidad (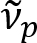 ) es inversamente proporcional al diámetro del axón (d). Esta relación simple (
) es inversamente proporcional al diámetro del axón (d). Esta relación simple (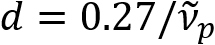 ) ofrece fácil cuantificación de diámetro de axón de los datos de SpeRe. Utilizando esto, nos reveló el frecuente axón abultamiento bajo craneoencefálico leve en nuestro informe anterior.
) ofrece fácil cuantificación de diámetro de axón de los datos de SpeRe. Utilizando esto, nos reveló el frecuente axón abultamiento bajo craneoencefálico leve en nuestro informe anterior.
El sistema SpeRe está basado en la microscopia confocal y consiste en una fuente de láser especializado y filtros (figura 2). La fuente de entrada es un láser de luz blanca, proporciona banda ancha salida espectral visible a infrarrojo regiones. Para el análisis espectral, el sistema está equipado con dos dispositivos de acusto-óptica: un filtro sintonizable de acusto-óptica (AOTF) para la entrega de una longitud de onda seleccionada de la fuente de entrada de banda ancha y un divisor de viga de acusto-óptico (AOBS) para orientar el seleccionado refleja longitud de onda del detector. El software para microscopía confocal hiperespectral (véase Tabla de materiales) ofrece una opción de análisis espectral personalizable para adquirir secuencialmente las imágenes de reflectividad en distintas longitudes de onda en la entrada. Además, la aberración cromática críticamente puede interferir en la medición espectral; por lo tanto, se recomienda el uso de una lente de objetivo de apochromat.
De nota, láseres de luz blanca producen una salida espectral desigual y los componentes ópticos también afectan el perfil espectral. Por lo tanto, los espectros adquiridos deben ser calibrados para el posterior análisis cuantitativo. Un espejo de plata protegido se utiliza normalmente como una referencia, que proporciona una reflexión casi constante (> 97%) en la región visible completo. Luego se dividen los espectros adquiridos por los espectros de referencia desde el espejo.
El tamaño de paso espectral para el análisis espectral determina la velocidad de adquisición; por lo tanto, debe ser optimizado. Como un axon más grande tiene un mayor periodo espectral, requiere más espectral muestreo. Por ejemplo, un axón con un diámetro de 10 μm, uno de los más grandes axones fisiológicos, tiene un periodo espectral de 8 nm. Mediante la aplicación de criterios de muestreo de Nyquist, se empleó el intervalo de muestreo espectral de 4 nm para cubrir todos los axones fisiológicos en los tejidos nerviosos de ratón. Este enfoque por lo general toma varios segundos para un análisis espectral completo y así no es adecuado para aplicaciones en vivo , donde el movimiento fisiológico (por ejemplo, la respiración y del latido del corazón) interfiere adquisición espectral estable. Ya resolvimos esta cuestión por equipar un microscopio vertical personalizado, diseñado para adquirir la gama completa para cada punto usando un espectrómetro de matriz (adquisición velocidad ≈ 30 m por píxel).
En este informe, describimos un protocolo detallado en la proyección de imagen de SpeRe en una rebanada del cerebro fija, que puede realizarse en un microscopio hiperespectral comercial (véase Tabla de materiales). Así, el protocolo puede ser completado por experimentadores sin conocimientos en instrumentación óptica. También cubrimos los posibles problemas y solución de problemas para la adquisición y análisis de datos SpeRe.
Protocol
Representative Results
Discussion
SpeRe es una modalidad de etiqueta-libre nuevo basada en interferometría espectral, que por primera vez, ofrece la información de nanoescala en axones mielinizados energizados. En el actual protocolo de adquisición, la resolución espacial para el diámetro del axon es del orden de 10 nm. Por otra parte, SpeRe utiliza órdenes de la magnitud dosis más baja de luz en comparación con otras Microscopías de súper-resolución; por lo tanto, es libre de fototoxicidad y photobleaching. SpeRe proporcionaría una nueva ví…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue financiado por el Instituto de ciencias básicas (IBS-R015-D1) y programa de investigación de ciencia básica a través de la nacional investigación Fundación de Corea (NRF) financiado por el Ministerio de Educación (2017R1A6A1A03015642).
Materials
| Glass cutter | – | – | Can be purchased in a local convenience store or online stores. |
| Nail polish | – | – | Can be purchased in a local convenience store or online stores. |
| Apochromat objective 40×, NA 1.1 | Leica Microsystems | 15506357 | Water-immersion type |
| Fluoromyelin Green | Thermo Fisher | F34651 | Alternatively, Fluoromyelin Red (F34652) can be used. |
| Leica SP8 TCS microscope | Leica Microsystems | SP8 | Refer to the "Configuration of microscope" in Introduction Section for details. |
| Imaging software | Leica Microsystems | LAS-X | – |
| Matlab | MathWorks | – | – |
| Mirror | Thorlabs | PF10-03-P01 | Coated with protected silver. |
| Phosphate-buffered saline (PBS) | Life technologies | 14190-136 | – |
| Paraformaldehyde | Biosolution | BP031a | 4% v/v in PBS |
| Cover slip | Thermo Fisher | 3306 | Thickness: #1 (0.13 to 0.17 mm) |
| Slide glass | Muto Pure Chemicals | 5116-20F | Thickness: ~1 mm |
| Super glue | Henkel | Loctite 406 | Use a dispensing equipment to avoid skin or eye contact. |
| Syringe pump | Brainetree Scientific | BS-8000 DUAL | – |
| Vibratome | Leica Biosystems | VT1200S | – |
| White-light laser | NKT photonics | EXB-6 | EXB-6 was discontinued and replaced by EXU-6. |
References
- Fernandez-Moran, H., Finean, J. B. Electron microscope and low-angle x-ray diffraction studies of the nerve myelin sheath. Journal of Cell Biology. 3, (1957).
- Blaurock, A. E. The spaces between membrane bilayers within PNS myelin as characterized by X-ray diffraction. Brain Research. 210, 383-387 (1981).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. , 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED nanoscopy of actin dynamics in synapses deep inside living brain slices. Biophysics Journal. 101, 1277-1284 (2011).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nature Methods. 5, 155-157 (2008).
- Peters, A., Sethares, C. Is there remyelination during aging of the primate central nervous system?. Journal of Comparative Neurology. 460, 238-254 (2003).
- De Campos Vidal, B., Silveira Mello, M. L., Caseiro-Filho, A. C., Godo, C. Anisotropic properties of the myelin sheath. Acta Histochemica. 66, 32-39 (1980).
- Schain, A. J., Hill, R. A., Grutzendler, J. Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nature Medicine. 20, 443-449 (2014).
- Kwon, J., et al. Label-free nanoscale optical metrology on myelinated axons in vivo. Nature Communication. 8, 1832 (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. JoVE. (65), e3564 (2012).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. JoVE. (112), e54024 (2016).
- Waldchen, S., Lehmann, J., Klein, T., Van De Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348 (2015).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14, 593-599 (2017).
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. Journal of Cell Biology. 148, 45-58 (2000).

